![]()
【本讲教育信息】
一. 教学内容:
原子核外电子排布及其周期性变化规律
二. 教学目标
1. 知识与技能目标
使学生初步掌握原子核外电子排布、原子半径和元素主要化合价的周期性变化
2. 过程与方法目标
使学生初步掌握从大量的事实和数据中分析总结规律、透过现象看本质、宏观与微观相互转化等科学抽象方法。
3. 情感态度与价值观目标
结合元素周期律的学习,使学生树立由量变到质变以及“客观事物本来是相互联系的和具有内部规律的”辩证唯物主义观点。
三. 教学重点、难点
1. 原子核外电子排布
2. 原子核外电子排布的周期性变化规律
3. 微粒半径大小的判断
四. 教学方法
讨论,分析,探究
[教学过程]
一、核外电子排布
(一)核外电子运动的特征:
(1)质量很小( 9.1×10-31kg)带负电荷
(2)运动范围小(直径约为10-10m )
(3)高速运动,接近光速
用电子出现的几率来表示电子的运动(电子云)

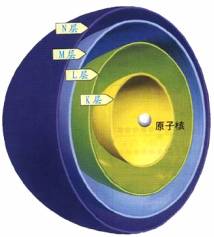
(二)原子核外电子的排布
![]()
电子层序数(n) 1 2
3 4 5 6 7
电子层符号 K L
M N O
P Q
小结:核外电子排布规律
1. 分层排布
2. 能量最低原理:电子总是尽先排布在能量较低的轨道上。
3 其它规律:
(1)每层最多容纳电子数为2n2个。
(2)最外层电子数不超过8个(K层是最外层时,最多不超过2个),次外层电子数不超过18个,倒数第三层电子数不超过32个。
例:判断Ca元素的原子的电子排布为:
2、8、9、1
我们知道了原子的核电荷数和电子层排布后,就可以画出原子结构示意图。

课堂练习:
1. 画出1-18号原子结构示意图,并指出其在元素周期表中的位置
2. 画出19、35、37号原子结构示意图, 并指出其在元素周期表中的位置
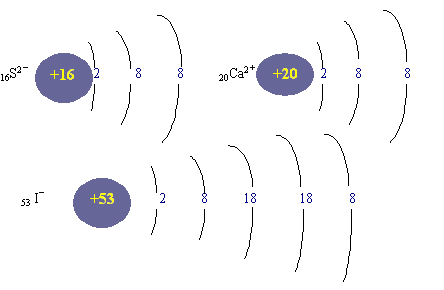
3. 画出 16S2-
20Ca2+ 53 I-离子结构示意图。
二、核外电子排布的周期性变化
(一)核外电子排布呈现周期性变化
第二周期:原子序数由3 递增到10,原子核外最外层电子由1递增到8,最后达到8电子稳定结构;
第三周期:原子序数由11递增到18,原子核外最外层电子由1递增到8,最后达到8电子稳定结构;
第四周期:第五周期等依此发生周而复始的变化,我们称为周期性变化。
结论:随着原子序数的递增,元素原子的最外层电子排布呈现 周期性 变化。
(二)原子半径的周期性变化

2. 微粒半径大小判断规律(一看电子层数,二看核电荷数,三看电子数)
(1)谁的电子层数越多,谁的半径越大
(2)电子层数相同,谁的核电荷数越多,谁的半径越小
(3)电子层数和核电荷数相同,谁的电子越多,谁的半径越大
随堂练习:比较微粒间半径的大小
(1)Na、Mg、Al、Si、P、S、Cl 依次减小
(2)Na与Na+;Cl与Cl- 大于,小于
(3)Na、Ca、H Ca > Na > H
微粒半径大小比较规律
⑴一般情况下,电子层数相同时,随着核电荷数的递增,原子半径逐渐 变小
⑵一般情况下,最外层电子数相同时,随着核电荷数的递增, 原子半径逐渐
增大
⑶ 对于电子层结构相同的离子,核电荷数越大,则离子半径 越小
⑷ 对于同种元素:
①阴离子半径 > 原子半径 > 阳离子半径
②阳离子所带正电荷数越多,则离子半径 越小
③阴离子所带负电荷数越多,则离子半径 越大
3. 结论: 随着原子序数的递增,元素原子半径呈现周期性变化。
课堂练习:
1. 下列元素的原子半径依次减小的是( AB )
A. Na、Mg、Al B.
N、O、F
C. P、Si、Al D.
C、Si、P
2. 下列各组微粒半径(r)之比大于1的是( AB )
A. rCl / rF B.
rI-/rI
C. rMg2+/Na+ D.
rF-/rCl-
3. 列出具有10电子和18电子的微粒。

【模拟试题】
一、选择题:
1. 最外层电子数是次外层电子数2倍和3倍的元素分别是( )
A. C ,S B.
Si ,O C.
C ,O D.
Si ,S
2. 某元素原子的核电荷数是电子层数的5倍, 其质子数是最外层电子数的3倍,该原子为( )
A. N B.
S C.
Ar D.
P
3. 短周期元素中,族序数等于周期序数的元素是( )
A. H Be P B.
H Li Al
C. Be Al Ge D.H Be Al
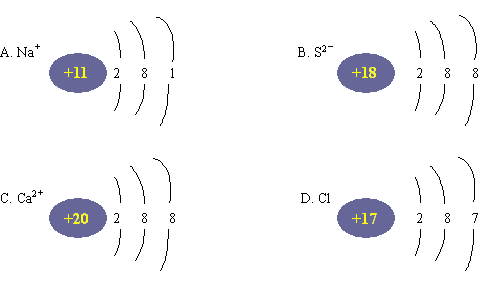
4. 下列微粒的结构示意图正确的是( )
5. 下列微粒中,半径最小的是( )
A. Li+ B、Na+ C.
F— D、Cl—
6. 下列微粒半径大小比较中,正确的是( )
A. Na > Al > Mg B.
N > O > F
C. S > Cl > O D.K
> Mg > Ca
7. 下列各组微粒半径大小比较中,不正确的是( )
A. r(K) > r(Na) > r(Li)
B. r(Mg2+) > r(Na+) > r(F-)
C. r(Na+) > r(Mg2+) > r(Al3+)
D. R(Cl-) > r(F-) > r(F)
8. 下列各组微粒,半径由小到大的顺序排列的是( )
A. Mg2+ 、 Na+ 、 K+
B. S2- 、 O2- 、 F-
C. Al 、Si 、P
D. B 、C 、N
二、填空题:
9. 1~18号元素中符合下列条件的元素
(1)原子核内无中子的原子:______
(2)最外层有1个电子的元素:______
(3)最外层电子数等于次外层电子数的元素______
(4)最外层电子数是次外层电子数2倍的元素______;是次外层电子数3倍的元素______;是次外层电子数4倍的元素______
(5)电子层数与最外层电子数相等的元素:______
(6)次外层电子数是最外层电子数2倍的元素:_____
(7)内层电子总数是最外层电子数2倍的元素:_____
![]()
【试题答案】
一、1. C 2. D 3. D 4. CD 5. A 6. B 7. B 8. A
二、9. (1)H
(2)H (3)Be,Ar (4)C,O,Ne
(5)Be,Ar (6)Li,Si (7)Li,P