![]()
【本讲教育信息】
一. 教学内容:
硫的化合物
二. 教学目标
1. 知识与技能目标
(1)掌握硫的氧化物SO2的性质,用途和危害;
(2)在稀硫酸的基础上,掌握浓硫酸的的特性.
2. 过程与方法目标
培养学生的观察能力和思维能力,推理探究能力。
3. 情感态度与价值观目标
对学生进行辩证唯物主义观点的教育,激发学习兴趣,培养学生严谨求实的科学作风。
三. 教学重点、难点
1. SO2的化学性质;
2. 浓硫酸的特性。
四. 教学方法
讨论+探究+实验
[教学过程]
空气质量日报
|
城市名称 |
污染指数 |
首要污染物 |
空气质量级别 |
空气质量状况 |
|
北京 |
60 |
可吸入颗粒物 |
Ⅱ |
良 |
|
天津 |
68 |
二氧化硫 |
Ⅱ |
良 |
|
上海 |
69 |
可吸入颗粒物 |
Ⅱ |
良 |
|
南京 |
77 |
可吸入颗粒物 |
Ⅱ |
良 |
|
长沙 |
78 |
二氧化硫 |
Ⅱ |
良 |
|
珠海 |
46 |
…… |
Ⅰ |
优 |
|
汕头 |
37 |
…… |
Ⅰ |
优 |
|
兰州 |
175 |
可吸入颗粒物 |
Ⅲ2 |
轻度污染 |
想想:你了解二氧化硫有多少?
一、二 氧 化 硫
1、物理性质;无色刺激性气味的有毒气体,易溶于水
SO2能否溶于水?
探究实验1:
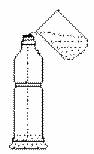
向一个收集满二氧化硫气体的塑料瓶中加入一定体积的水,立即盖上瓶盖。
|
试验现象 |
塑料瓶被变瘪了 |
|
分析 |
瓶里压强减小,证明二氧化硫溶于水 |
2. 化学性质
(1)再想想
根据二氧化硫的元素组成和元素的化合价,你能预测它有哪些性质吗?
(2)讨论
设计实验探究二氧化硫的化学性质
SO2与水有没有发生化学反应?
探究实验2:
向通入了SO2的水中加入紫色石蕊试液
|
试验现象 |
紫色石蕊试液变红 |
|
分析 |
溶液中有H+,有新物质生成. |
SO2+H2O=H2SO3
![]()
H2SO3是否稳定?
探究实验3:
在H2SO3上方放一张PH试纸,
|
试验现象 |
PH试纸变红 |
|
分析 |
有SO2生成 |
H2SO3 = SO2↑+H2O

小结:SO2+H2O![]() H2SO3
H2SO3
思考: 能否用水来吸收SO2
因为SO2为可逆,所以用水来吸收不彻底.
可以用什么来吸收SO2?
SO2+2NaOH=Na2SO3+H2O
探究实验4:
|
实验步骤 |
现象 |
结论 |
|
往装有SO2的针筒内抽取0.5mL品红溶液,用橡胶塞封好后上下摇匀 |
品红溶液褪色 |
SO2有漂白作用 |
|
把针筒内液体转移到小烧杯内加热 |
溶液变回红色 |
被SO2漂白不稳定,容易变回原来的颜色 |
|
在烧杯口放一块花瓣 |
花瓣褪色 |
溶液重新分解出SO2 |
小结:
1、与水反应 SO2+H2O ![]() H2SO3
H2SO3
2、与碱性氧化物和碱反应 SO2+Na2O=Na2SO3
SO2+2NaOH=Na2SO3+H2O
3、氧化性 2H2S + SO2 = 3S↓ + 2H2O
4、较强的还原性(与Cl2、O2、Fe3+等)
2SO2 + Cl2 + H2O = H2SO4 + 2HCl
5、漂白性
读一读
白木耳又叫银耳,属真菌类食品,具有生津、止咳、降火等功效。但一些不法生产者,为了得到更白的银耳,在大棚内放置了硫磺,采用这种传统的“硫磺熏蒸”工艺生产出来的银耳往往会残留一定量的二氧化硫。目前,上海质监部门对银耳产品进行了一次专项抽查,结果发现被抽检的21种银耳产品居然全部存在二氧化硫残留量超标的现象。部分银耳产品的二氧化硫残留量居然高达2.83g/kg,最低的二氧化硫残留量也有0.125g/kg。我国《食品添加剂使用卫生标准》对食品中二氧化硫的允许残留量做了强制性的规定,根据这一标准,银耳产品中不得含有二氧化硫残留。因此银耳并非越白越好。
讨 论
二氧化硫的性质决定了它有哪些用途和危害呢?
(1)二氧化硫的用途
A、制硫酸
B、漂白纸浆、毛、丝、草帽
C、杀菌消毒
(2)二氧化硫的危害
A、对人体健康造成直接危害
B、形成酸雨——“空中死神”
形成酸雨的途径:
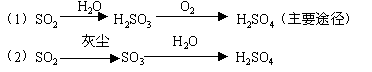
2SO2 + O2 ![]() 2SO3
2SO3
SO3 + H2O = H2SO4

多诺拉事件:
多诺拉是美国宾夕法尼亚州的一个城镇。1948年10月26至31日,河谷地带持续大雾天气,使大气中二氧化硫浓度达0.5 ~ 2.0ppm,并存在明显尘粒。全镇有5911人有眼、鼻、喉刺激症状,并伴有胸痛、呼吸困难、剧烈头痛和恶心、呕吐等症状,死亡17人。这是美国最大一次大气污染事件。是世界八大公害之一。
伦敦烟雾事件:
1952年12月5日至8日,英国伦敦上空连续烟雾弥漫,烟尘经久不散,大气中烟尘浓度高达4.46mg/m3,二氧化硫达3.8mg/m3。温度逆增,逆温层在40-15m低空。造成4天中死亡人数较常年同期多死4000人,这也是震惊一时,闻名世界的八大公害之一。

你知道吗?
6月5日的世界环境日——1983年主题:
管理和处置有害废弃物,防治酸雨 破坏和提高能源利用率
课后作业:
点击 www.kepu.com.cn 查阅资料并回答
(1)空气中SO2的主要来源?
(2)如何防止SO2污染环境?
讨论
1、SO2能使氯水、KMnO4溶液褪色与SO2使品红褪色,实质相同吗?
2、在潮湿条件下,若将等物质的量的SO2气体和Cl2同时作用于有色物质,漂白效果会更好吗?为什么?
3、CO2和SO2在化学性质上既有相似性又有差异性,如何用化学方法鉴别这两种气体呢?
二、硫 酸
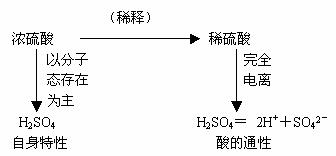
复习:稀硫酸具有哪些酸的通性?
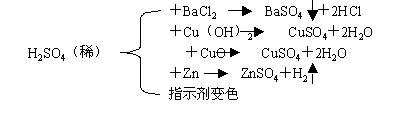
浓硫酸
(一)物理性质
硫酸是一种色状体。常用的浓硫酸中H2SO4的质量分数为______,若其密度为1.84g/cm3,则其物质的量浓度为_____mol/L。硫酸是一种高沸点______挥发的酸,___溶于水,能以_____比与水混溶。浓硫酸溶解时释放大量的热,因此稀释浓硫酸的时候一定要将浓硫酸慢慢注入水中并不断搅拌 (为什么?)。
(二)浓硫酸的特性:
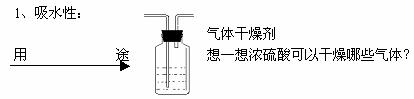
2、脱水性:
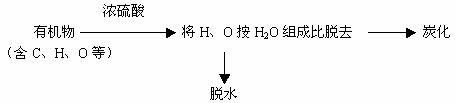
C12H22O11(蔗糖)![]() 12C + 11H2O
12C + 11H2O
想一想?
蔗糖脱水后为何变得疏松多孔?
3、强氧化性
(1)与某些固态非金属单质的反应:
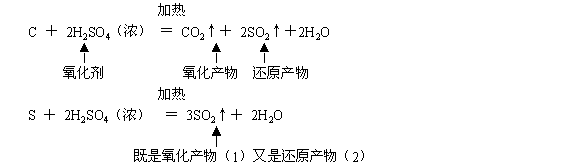 (2)与金属反应
(2)与金属反应
与铜反应(演示实验)
Cu + 2H2SO4(浓)![]() CuSO4+ SO2 +2H2O
CuSO4+ SO2 +2H2O
① 1molCu 和2molH2SO4(浓)共热能否得到1molSO2?
②浓硫酸的作用?
想一想?
工业上为何能用铝槽车盛放、运输浓硫酸?
小结:硫酸的性质
1、稀硫酸和金属反应
2、浓硫酸和金属反应
3、浓硫酸的特性
三、硫酸的用途:
思考题:
下列现象体现了硫酸的哪些性质?
(1)把浓硫酸滴入放在蒸发皿里的蔗糖上,蔗糖就会炭化变黑
(2)把浓硫酸露置在空气里,质量会增加
(3)把锌粒放入稀硫酸里,会产生氢气。
(4)把铜片放入浓硫酸里并加热,会产生SO2。
(5)利用浓硫酸和食盐固体反应,制HCl气体。
【模拟试题】
一、不定项选择题
1. 将SO2气体通入下列足量溶液中,有新气体反应放出的是( )
A. 溴水 B. 酸性KMnO4 C. 浓HNO3 D. CuSO4溶液
2. 下列对SO2和SO3的叙述正确的是( )
A. 通常条件下都是无色气体,都易溶于水
B. 都是酸性氧化物,其水溶液都是强酸
C. 都可使品红溶液褪色
D. 都能与碱溶液反应
3. 下列反应不属于可逆反应的是( )
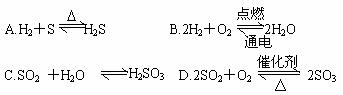
4. 下列反应产生的气体通入Na2SO3溶液,不能反应的是( )
A. CO通过加热的CuO B. 萤石与浓H2SO4共热
C. 浓H2SO4和MgCl2固体 D. FeS和稀H2SO4
5. 在空气中不易变质的是( )
A. Na2SO3 B.
NaHSO4 C.
亚硫酸 D.
氢硫酸
6. 以下气体能用NaOH固体干燥的是( )
A. NH3 B.
SO2 C.
CO2 D.
HCl
7. 下列关于浓H2SO4的叙述中,错误的是( )
A. 常温下可使某些金属钝化
B. 具有脱水性,故能作干燥剂
C. 加热条件下可与木炭反应,其还原产物为CO2、SO2
D. 溶于水放出大量的热
8. 在下述反应中,浓H2SO4既表现出氧化性,又表现出酸性的是( )
A. C+H2SO4 B. H2S+H2SO4 C. NaCl+H2SO4 D. Cu+H2SO4
9. 足量的锌和下列酸反应,产生H2的物质的量最多的是( )
A. 10mL 18.4mol/L H2SO4 B. 30mL 3mol/L盐酸
C. 30mL 2mol/L H2SO4 D. 30mL 5mol/L HNO3
10. 下列各组气体,实验室可用硫酸制取,又能用浓H2SO4干燥的是( )
A. HCl、HBr、HI B.
H2S、CO2、H2
C. H2、SO2、HCl D. NH3、HF、H2
11. 足量的浓H2SO4和mg铜完全反应,得到标准状况下的n LSO2,则被还原的硫酸是( )
A. ![]() B.
B.
![]() C.
C.
![]() D.
D.
![]()
12. 只用一种试剂就能鉴别Na2S、Na2SO3、Na2CO3、Na2SO4的是( )
A. BaC2溶液 B. 盐酸 C. 品红溶液 D. NH4Cl
13. 将CuSO4·5H2O放入浓H2SO4中后,颜色变为( )
A. 蓝 B. 黑 C. 红 D. 白
14. 若用浓H2SO4时不慎沾在皮肤上,清洗的方法是( )
A. 先用NaOH中和,再用水洗
B. 用纱布擦净后涂油
C. 用大量水冲洗
D. 用布擦后,用水冲洗,再用NaHCO3溶液(3%-5%)冲洗
二、填空题:
15. 写出符合下列情况的化学方程式:
(1)SO2作还原剂 ;
(2)SO2作氧化剂 ;
(3)SO2既不作还原剂又不作氧化剂 。
(4)浓硫酸既作酸又作氧化剂
16. 某亚硫酸钠试剂已部分被氧化,为确定它的纯度,要进行如下实验:①称取样品w1g; ②将样品溶解;③给溶液加入稍过量的盐酸酸化了的BaCl2溶液;④过滤、洗涤、干燥沉淀,称其质量为w2g.试回答:
(1)BaCl2要用盐酸酸化的原因是
(2)BaCl2溶液要稍过量的原因是
(3)判断操作③是否完成的方法是
(4)判断沉淀是否洗净的方法是
(5)Na2SO3纯度的表示式为
三、计算题
17. 76g硫酸钠、亚硫酸钠、亚硫酸氢钠的混合物和足量的硫酸作用逸出气体672mL(标准状况),同样质量的混合物恰好和24.04mL3.2%的氢氧化钠溶液(密度为1.04g/mL)反应,试计算 在混合物中亚硫酸钠的质量分数.
![]()
【试题答案】
一、1.C 2.D
3.B 4.AB 5.B
6.A 7.BC 8.D
9.C 10.C 11.AC 12.B 13.D 14.D
二、15.(1)SO2+Br2+2H2O=H2SO4+2HBr
(2)2H2S+SO2 =3S↓+2H2O
(3)SO2+2NaOH =Na2SO3+H2O
(4)Cu + 2H2SO4(浓)![]() CuSO4+ SO2 +2H2O
CuSO4+ SO2 +2H2O
16. (1)防止BaSO3生成
(2)使SO42-完全转化为BaSO4
(3)取上层清液少许,滴加稀H2SO4,若有白色沉淀生成则操作③完成,否则未完成。
(4)取最后几滴洗液,滴加AgNO3,若无沉淀,已洗净,反之,未洗净。
(5)Na2SO3%=[(233W2-142W2)/233W1]×100%
17. 26.5%