![]()
【本讲教育信息】
一. 教学内容:
金属与O2的反应
二. 教学目标
1. 知识与技能目标
(1)了解Na的物理性质,掌握不同条件下Na与O2的不同反应,初步理解Na的化学性质。
(2)了解铝的物理性质,掌握铝跟氧气反应的条件和氧化膜的性质,初步理解铝的化学性质。
2. 过程与方法目标
通过探究实验和实验探究,培养学生根据实验现象分析、推理和判断的能力。
3. 情感态度与价值观目标
让学生在实验中感受化学的美妙,在探究实验和实验探究中感受化学学习的快乐,体味自我价值实现的满足感。
三. 教学重点
Na与O2的反应,Al与O2的反应
四. 难点
对实验现象的观察和分析
五. 教学过程
(引入)今天开始,我们一起学习金属及其化合物的性质。首先,我们一起来看看大自然中的金属。
自然界中的金属
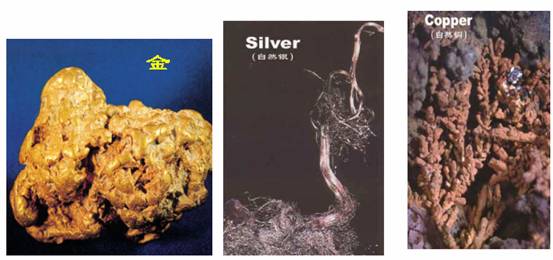




问题:
自然界中金属以哪些形态存在?
为什么会以不同形态存在?
结论:
大多数金属以化合态(即化合物)存在,只有Ag、Pt、Au等极少数的金属以游离态(单质)存在。
思考和交流:
金属有哪些共同的化学性质?
回忆+联想:金属可以与哪些物质反应?
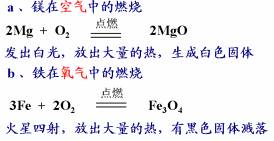
①与氧气等非金属单质反应
②与酸反应
③与盐溶液反应
实例:

2Al+3CuSO4=Al2(SO4)3+3Cu 2Mg+O2 ![]() 2MgO
2MgO

Cu+2AgNO3=Cu(NO3)2+2Ag Mg+2HCl=MgCl2+H2↑
讨论:
根据上述四个反应,请从原子结构的角度,结合氧化还原反应知识谈谈你对金属的认识。
金属与氧气的反应
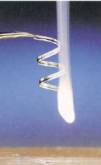
c、钠与氧气的反应
金属钠的切割:
镊子夹取——用滤纸吸干煤油——用小刀在玻璃片上切割——切去外皮——露出庐山真面目
观察与思考:
1、切开的钠的颜色和光泽
2、新切开的钠的颜色和光泽在空气中发生的变化
3、钠为什么保存在煤油中
[实验3-1]
{闻}
气味
钠保存在煤油中—ρ(钠)>ρ(煤油)—与外界隔绝
{切} 观察断面 —钠是柔软的、银白色的金属
{看} 钠久置后表面的颜色变化 —变暗
钠的物理性质:
1. 为银白色金属光泽的固体
2. 质软(硬度小)
3. 密度大于煤油的密度
思考:切开的钠表面,为什么迅速变暗?
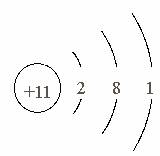
画出钠的原子结构示意图
![]()
⑴ 4Na + O2 = 2Na2O (白色)
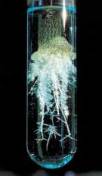
思考:把一小块金属钠放在坩埚中(或石棉网上),加热,有何现象发生?
实验3-2:加热时钠和氧气的反应
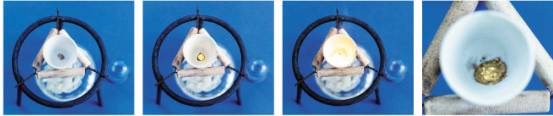
现象:
钠熔化成小球状
燃烧、产生黄色火焰
生成淡黄色固体物质(过氧化钠)
化学方程式:
⑵2Na + O2 =Na2O2 (淡黄色)
思考:Na与O2 的反应
为什么反应物相同,产物不同?
4Na + O2 = 2Na2O
;
2Na + O2 = Na2O2
Na2O与Na2O2的性质
讨论: 你认为Na2O和Na2O2会有什么性质?
探究:怎样用实验来验证你的推断?
2Na2O2+2H2O=4NaOH+O2↑
2Na2O2+2CO2 =2Na2CO3+O2↑
火 警 ![]()
少量金属钠着火,怎么办?
注:常用的灭火剂有水、泡沫灭火剂(H2O和CO2) 、二氧化碳、干粉(NaHCO3)、四氯化碳灭火剂等都不能用来灭金属钠着的火。
d. 铝与氧气的反应
初中知识:
铝箔能在纯氧中点燃
探究实验:用坩埚钳夹住一小块铝箔,在酒精灯上加热,可观察到什么现象?
现象:失去光泽,铝箔熔化,熔化的铝并不滴落,好像有一层膜兜着
探究实验:打磨后的铝箔受热是否会燃烧?
现象:除去铝箔表面的保护膜后,再加热至熔化,熔化的铝仍不滴落
[分析实验]:
|
物质 |
铝 |
氧化铝 |
|
熔点 |
660℃ |
2050℃ |
问题解决:致密、熔点高的氧化铝包在铝的外面。所以熔点低的铝融化后不会滴下来。也不能和氧气接触而燃烧。
实验探究:
怎样验证Al2O3的致密性?
小结:
铝表面容易形成致密的氧化物,可以隔绝铝与空气的接触,阻止内部铝被氧化。正因为如此,铝成为一种应用广泛的金属材料,特别是耐火材料。
思考讨论:如何设计实验,能够观察到铝燃烧的现象?
归纳小结:
根据金属与Na,Mg,Al与氧气反应的情况,结合已有的知识以及生产,生活中的实例,推断其他的金属能否与氧气反应? 反应的条件,现象是什么?
反馈练习:
1. 如何除去Na2O2中混有的Na2O?
加热
2. 生活中很多人用钢丝球刷铝锅,这种方法妥当吗?为什么?不妥当,破坏了铝的保护膜——氧化铝
3. 可否用铁桶盛放硫酸铜溶液? 不能,铁会与硫酸铜反应
【模拟试题】
一. 选择题
1. 下列元素在自然界中能以游离态存在的是( )
A. Na B. Mg C. Al D. Au
2. 金属材料在人类社会的发展史上一直发挥着重要的作用。人类历史上使用最早的金属是( )
A. 铜 B. 铁 C. 铝 D. 钛
3. 下列关于金属的叙述中正确的是( )
A. 所有的金属都是固态的
B. 金属具有导电性、导热性和延展性
C. 活泼的金属、或较活泼的金属能与酸反应,但不能与碱反应
D. 金属元素在自然界中都是以化合态存在的
4. 通过你的观察和推理,判断下列实验室中对于少量Na的保存方法正确的是( )
A. 保存在水中 B. 密封,保存在广口瓶中
C. 用铝箔包裹,密封在广口瓶中 D. 密封,保存在煤油中
5. 从生活常识角度考虑,试推断钠元素在自然界中存在的主要形式是( )
A. Na B. NaCl C. NaOH D. Na2O
6. 下列物质中,有一种物质的颜色与其它三种的颜色不同,这种物质是 ( )
A. NaOH B. Na2O C. Na2O2 D. NaHCO3
7. 铝在空气中能够稳定存在的原因是( )
A. 铝的活泼性差 B. 铝的还原性差
C. 铝与氧气不反应 D. 铝表面有氧化膜
8. 下列关于金属Na的叙述中,说法正确的是( )
A. Na在空气中燃烧,发出黄色火焰 B. Na在空气中燃烧,产物是Na2O
C. Na是银白色金属,硬度大,熔点高 D. Na、K合金可作原子反应堆的导热剂
9. 下列关于金属铝的叙述中,说法不正确的是( )
A. Al 是地壳中含量最多的元素
B. Al 是比较活泼的金属,在化学反应中容易失去电子,表现还原性
C. Al箔在空气中受热可以熔化,且发生剧烈燃烧
D. Al箔在空气中受热可以熔化,由于氧化膜的存在,熔化的Al 并不滴落
实验是人为的再现物质的变化过程,因此实验过程中要注意控制温度、压强、溶液的浓度等条件,因为同样的反应物在不同的条件下,会有不同的反应。请解第10题。
10. 下列各组中的两物质相互反应时,若改变反应条件(温度、反应物用量比),化学反应的本质并不改变的是( )
A. Na和O2 B. NaOH和CO2 C. Na2O2和CO2 D. 木炭(C)和O2
11. Na2O2与水反应能够产生O2,这一反应在呼吸面具、潜水艇及太空飞船中可为人体提供呼吸所用的O2。下面对该反应的说法中正确的是( )
A. 这是一个氧化还原反应,Na2O2既是氧化剂,又是还原剂
B. 这是一个氧化还原反应,Na2O2是氧化剂,水是还原剂
C. 这是一个氧化还原反应,Na2O2是还原剂,水是氧化剂
D. 这是一个置换反应,有单质O2产生
12. 钾(K)与Na在性质上具有很大的相似性,但K比Na的活泼性强,下面是根据Na的性质对K的性质的预测,其中正确的是( )
A. 因为K的活泼性强,所以钾应该保存在煤油
B. K在空气可以被空气中的氧气所氧化,且产物是K2O
C. K 与水能够反应,但不如Na与水的反应剧烈,但产物都有氢气
D. K可以与水剧烈反应,生成氢气
二、填空题
13. 运用比较方法是化学科学中研究物质性质的基本方法之一,请运用比较法解答题
过氧化钠几乎可与所有的常见气态非金属氧化物反应。如:2Na2O2+2CO2=2Na2CO3+O2↑,Na2O2+2CO=Na2CO3。
(1) 试分别写出Na2O2与SO2、SO3反应的化学方程式:
。
。
(2) 通过比较可知,当非金属元素处于 价时,其氧化物与过氧化钠反应有O2生成。
三、计算题
14. 将一块部分被氧化的金属钠(假设氧化产物只有Na2O2)投入盛满水且倒置水槽内的容器中,此时在容器中可收集到448mL(STP)气体(假定各步反应完全,并产生的所有气体全部被收集到容器中),以电火花引燃容器里的气体,最终剩余112mL(STP)氢气。求被氧化的金属钠中钠及Na2O2的物质的量。
![]()
【试题答案】
一. 1.D 2. A 3. B 4. D 5. B 6. C 7. D 8. AD 9. AC 10. C 11. A 12. AC
二. 13 (1) SO2+Na2O2=Na2SO4;2SO3+2Na2O2=2Na2SO4+O2;(2) 最高
三. 14. 解:整个过程涉及到的化学反应有:
① 2Na + 2H2O = 2NaOH + H2
② 2Na2O2+2H2O = 4NaOH+ O2
③![]()
由题意可知,448mL-112mL=336 mL正好是③式反应的氢气和氧气,所以H2和O2的物质的量分别为:
n(H2)=(224+112)×10-3 L/22.4L=0.015mol
n(O2)=112×10-3 L/22.4L=0.005mol
由方程式①和②可以求出Na和Na2O2的物质的量分别为:
n(Na) =0.015mol ×2=0.03mol
n(Na2O2) =0.005mol×2=0.01mol
所以,被氧化的金属钠中Na及Na2O2物质的量分别为0.03mol和0.01mol。