![]()
【本讲教育信息】
一. 教学内容:
海水中的元素——氯
二. 教学目标
1. 知识与技能目标
(1)初步认识氯气的主要化学性质,了解氯气是一种活泼的非金属单质;
(2)了解日常生活中涉及氯元素的一些应用实例;
(3)掌握氯离子的检验方法.
2. 过程与方法目标
(1)通过实验探究的形式,培养学生大胆质疑,用科学的方式解决实际问题的能力;
(2)在参与问题探讨的过程中,学生的团队协作精神得到加强。
3. 情感态度与价值观目标
在化学学习中增强亲身实践的意识,保持不断探索的兴趣,学会认识物质,了解物质的一般方法。
三. 教学重点、难点
1. 氯气的化学性质
2. 氯水的成分和性质
3. 漂白液(漂白粉)的成分及漂白原理
四. 教学方法
讨论+探究+实验
五. 教学过程
重庆天原化工总厂

重庆氯气泄漏抢险纪实: 命悬一线 15万人大转移
新华网重庆4月17日(记者黄豁 张琴)16日凌晨,当繁华的山城已沉入梦乡的时候,一场意想不到的危险却悄然降临了。“嘭!”重庆天原化工总厂在寂静的黑夜中发出一声闷响,厂里2号氯冷凝器发生爆炸,黄绿色的氯气如同从瓶中释放的魔鬼弥漫开来。下午17时57分,正在抢险的化工厂再次发生爆炸,当即造成死亡和失踪9人……

不同浓度的氯气对人体的危害
|
C(mg/m3) |
危害状况 |
|
3~9 |
有明显气味,刺激眼鼻 |
|
90 |
咳嗽发作,难以耐受 |
|
120~180 |
30分钟以上,引起严重损害 |
|
300 |
造成致命损害 |
大气中氯气的浓度不得超过0.1mg/m3,生产车间不超过1mg/m3,居民区不超过0.03mg/m3。
如果中毒,保持安静,注意保温,吸入少量乙醇和乙醚蒸汽或氨气。
氯 气
一、物理性质
颜色:黄绿色
状态:气体
气味:刺激性气味(闻?)
密度:比空气大
溶解性:能溶于水(1:2)
(水中)
易液化: 黄色油状液体 ( 液氯) (两种途径?)

二、化学性质
结构分析:结构决定性质
![]()
I、与金属单质反应
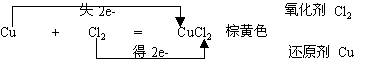
铜与氯气的反应
现象:剧烈燃烧,生成棕黄色的烟。加水后,溶液 呈蓝绿色(浓)或蓝色(稀)
反应方程式 :
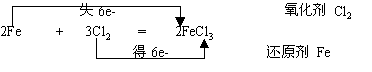
铁与氯气的反应
现象:剧烈燃烧,生成红棕色的烟。加水后,溶液呈黄色。
反应方程式 :
比较:
铁与盐酸反应
Fe + 2 HCl = FeCl2 +H2↑
铁与氯气反应
2Fe + 3Cl2 = 2FeCl3 (点燃)
氧化性:氯气强于盐酸( H+ )
氯气与金属单质反应小结:
容易得电子,表现强氧化性;
与变价的金属反应时生成金属的高价氯化物 。
写出氯气与下列金属反应的化学方程式
Mg + Cl2
Al + Cl2
Ti + Cl2
II、与非金属单质反应
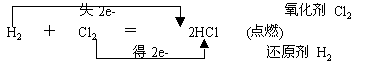
氯气与氢气的反应
①氢气在氯气中燃烧
现象:安静的燃烧,火焰呈苍白色,瓶口有白雾( ? )产生
反应方程式 :
②氢气与氯气的混合气体在强光条件下
现象:迅速化合并发生爆炸,释放大量的热。
H2 + Cl2 = 2HCl (光照)
概念拓展:
燃烧——任何发光发热的剧烈的化学反应
常见助燃剂:O2 、 Cl2
小结:
Cl2是很活泼的非金属单质,表现强氧化性:
能与多种金属单质、非金属单质化合
思考:P+Cl2产物是什么?
答案:产物是PCl3(液)和PCl5(固),现象是:产生白色的烟雾
Ⅲ、与水的反应
现象:氯气溶于水称氯水,呈浅黄绿色。
反应方程式:
H2O + Cl2 = HCl+HClO
思考1 : 产物HClO有什么性质?
思考2: 氯水中有哪些成分?久置后呢?
次氯酸的性质:
氢氯酸(盐酸)是强酸,较稳定。次氯酸是弱酸,酸性比碳酸还弱,且不稳定易分解放出氧气。
2HClO =(光照)2HCl+O2↑
HClO具有强氧化性(能漂白、杀菌、消毒)
请回答:次氯酸的三大特性是?
请思考1: 如何检验次氯酸?检验氯气?
用湿润的红布条来检验氯气,它能使其褪色。
请思考2: 氯气可以使用湿润的红布条褪色,不能使干燥的红布条褪色这是为什么?
氯水的成分:
液氯、新制氯水和久置氯水的比较
|
|
液氯(或氯气) |
氯 水 |
|
|
分类 |
纯净物 |
新 制 |
久 置 |
|
混 合 物 |
|||
|
成分 |
只有
Cl2分子 |
分子:Cl2、HClO、H2O 离子:H+ 、 Cl- 、ClO- 、 OH- |
分子:H2O 离子:H+ 、 Cl- 、OH- |
|
性质 |
有氧化性、无酸性和漂白性 |
有酸性、有氧化性、能漂白、消毒、光照时HClO分解 |
酸性(比新制的强)无漂白、消毒作用 |
IV、与碱的反应
通式:氯气+碱 = 氯化物+次氯酸盐+水
例如: 2NaOH+Cl2= NaCl
+ NaClO
+H2O
本质:
2OH-+Cl2=ClO-+Cl-+H2O 用途:制漂白液
例如: 2 Ca(OH)2+2Cl2=Ca(ClO)2+CaCl2+2H2O
用途: 制漂白粉或漂粉精
漂白粉
主要成分:Ca(ClO)2、CaCl2是混合物。
有效成分:Ca(ClO)2
漂白原理:强酸制弱酸
(1)日常: Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO
(2)工业: Ca(ClO)2+2HCl(稀)=CaCl2+2HClO
思考:漂白粉长时间放置漂白能力会下降吗,为什么?
会:因为Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO
光照
2HClO = 2HCl+O2↑
【模拟试题】
一、单选题
1. 海水中含量最多的离子是( )
A. 钠离子 B. 氯离子 C. 钙离子 D. 镁离子
2. 关于氯气的叙述中,下列正确的是( )
A. 氯气是一种黄绿色、有毒的气体
B. 氯气在自然界中既可以以化合态存在,也可以以游离态存在
C. 氯气不能溶解于水,所以可用排水法收集氯气
D. 氯气、氯水、液氯是同一种物质,只是状态不同,都属于纯净物
3. 下列物质中,不能使有色布条褪色的是( )
A. Cl2 B. 氯水
C. NaClO溶液 D. Na2O2与水反应后的溶液
4. 下列关于对燃烧现象的认识中,不正确的是( )
A. 燃烧一定是氧化还原反应 B. 燃烧一定发光放热
C.
燃烧一定是化学反应 D.
燃烧一定有氧气参与
5. 下列物质中不会因见光而分解的是( )
A. HNO3 B. AgNO3 C. HClO D. NaHCO3
6. 制取漂白液的化学方程式是:Cl2+2NaOH=NaCl+NaClO+H2O,该反应的氧化剂与还原剂之比为( )
A. 1:1 B. 1:2 C. 2:1 D. 3:2
二、不定项选择题(每小题有1—2个正确答案)
7. 下列关于氯水的叙述中,正确的是( )
A. 新制氯水中既有分子,又有离子
B. 新制氯水在光照的条件下,可以产生气体,该气体是氯气
C. 新制氯水中滴加硝酸银溶液,没有任何现象
D. 新制氯水可以使干燥的布条褪色
8. 下列氯化物中,不能通过单质之间直接制取的是( )
A. FeCl2 B. FeCl3 C. CuCl D. CuCl2
9.
自来水可以用氯气消毒。如果实验室中临时没有蒸馏水,可以用自来水配制某些急需的药品,但有些药品若用自来水配制,则明显会导致药品变质。下列哪些药品不能用自来水配制( )
A. Na2SO4 B. NaCl C. AgNO3 D. AlCl3
10. 下列离子方程式中,正确的是( )
A. 向氯化亚铁溶液中通入氯气 Fe2++Cl2=Fe3++2Cl-
B. 氯气通入冷的氢氧化钠溶液中 Cl2+2OH-=Cl-+ClO-+H2O
C. 铝片跟氢氧化钠溶液反应 Al+2OH-=AlO2-+H2↑
D. 金属铝溶于盐酸中 Al+2H +=Al3++H2↑
三、填空题
11. (1)如图所示,将氯气依次通过盛有干燥有色布条的广口瓶和盛有潮湿有色布条的广口瓶,可观察到的现象是_______ ________________。
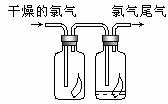
(2)为防止氯气尾气污染空气,根据氯水显酸性的性质,可用 溶液吸收多余的氯气,原理是(用化学方程式表示)_________________________________。
根据这一原理,工业上常用廉价的石灰乳吸收工业氯气尾气制得漂白粉,漂白粉的有效成分是__________(填化学式),长期露置于空气中的漂白粉,加稀盐酸后产生的气体是__________(用字母代号填)。
A. O2 B. Cl2 C. CO2 D. HClO
(3)据“北方网”报道,2004年4月15日至16日,位于重庆市江北区的天原化工总厂相继发生氯气泄漏和爆炸事故。截至记者发稿时,已有9人在事故中失踪死亡,3人受伤,15万人被紧急疏散。当人们逃离爆炸现场时,可以用浸有一定浓度的某种物质的水溶液的毛巾捂住鼻子,最适宜采用的该物质是 。
A. NaOH B. NaCl C. KBr D. Na2CO3
四、计算题
12. 用KMnO4氧化密度为1.19g/cm3,溶质质量为36.5%的 HCl。反应方程式如下:
2KMnO4 + 16HCl = 2KCl + 2MnCl 2+ 5Cl 2↑ + 8H2O
(1)15.8g KMnO4能使多少克HCl发生上述反应?有多少克HCl被氧化?
(2)若Cl 2在标准状况下的密度为3.17g/L,则产生的Cl2在标准状况下的体积为多少?
![]()
【试题答案】
1. B 2. A 3. A 4. D 5. D
6. A 7. AD 8. AC 9. C 10. B
11. (1)干燥有色布条不褪色,湿润的有色布条褪色
(2)NaOH, NaOH + Cl2 = NaCl + NaClO Ca(ClO)2 C
(3)D
12. (1)29.2 ; 18.25
(2)5.6L