![]()
【本讲教育信息】
一. 教学内容:
了解化合物之间的相互转化
使学生了解不同材料的性能、用途以及在使用过程中出现的环境保护问题。
二. 重点、难点
掌握物质间相互转化的规律
利用物质转化的规律寻找物质制取的途径,利用所学知识学会对物质的鉴别、甚至鉴定
钢铁的锈蚀与防锈。
三. 教学过程
1. 【实验】:鸡蛋的变化
将一只鸡蛋放到盛有稀盐酸的容器中,观察现象是:鸡蛋不断地上浮和下沉。
2. 两分钟后,将生鸡蛋从酸中取出,用水冲洗干净,蛋壳发生什么变化?蛋壳凹凸不平。
3. 将鸡蛋继续放置在盐酸中,10分钟后,用水冲洗干净,鸡蛋又发生什么变化?变成软壳蛋。
4. 解释变化的原因:CaCO3+2HCl=CaCl2+CO2↑+H2O。
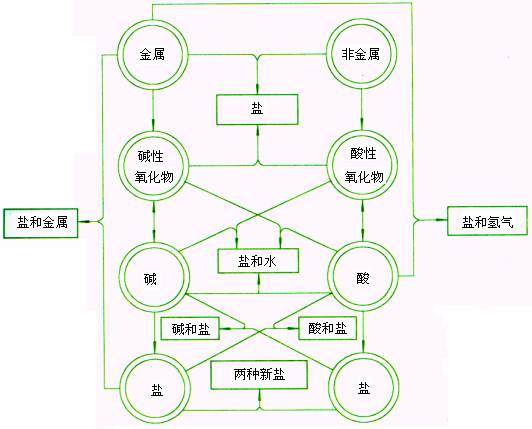
各类物质的相互关系
【探究一】:根据上面表格,讨论各类物质间的互相转化规律:
A. 两条纵线:
1. ![]()
2. ![]()
B. 四条横线:
金属+非金属→无氧酸盐
2Fe+3Cl2=2FeCl3
金属氧化物+非金属氧化物→含氧酸盐
CaO+SiO2=CaSiO3
酸+碱→盐+H2O
HCl+NaOH=NaCl+H2O
盐+盐→新盐+新盐
AgNO3+NaCl=NaNO3+AgCl↓
C. 两条交叉线:
1. 金属氧化物+酸→盐+H2O
Fe2O3+6HCl=2FeCl3+3H2O
2. 非金属氧化物+碱→盐+H2O
SO2+2NaOH=2Na2SO3+H2O
D. 两条弯线:
1. 金属+盐→新金属+盐
Fe+CuSO4=Cu+FeSO4
2. 金属+酸→盐+H2
Zn+H2SO4=ZnSO4+H2↑
【探究二】:根据上面表格,查找各类物质主要的化学性质:
如:酸的性质
交叉线:酸+金属氧化物→盐+H2O
横线:酸+碱→盐+H2O
弯线:酸+金属→盐+H2
竖线:酸+盐→新酸+新盐
【探究三】:根据上面表格,查找制取各类物质的可能途径:
如:制取盐的可能途径:(8条)
1. 金属+非金属→无氧酸盐
2. 金属氧化物+非金属氧化物→含氧酸盐
3. 酸+碱→盐+H2O
4. 盐+盐→新盐+新盐
5. 金属氧化物+酸→盐+H2O
6. 非金属氧化物+碱→盐+H2O
7. 金属+盐→新金属+盐
8. 金属+酸→盐+H2
总结①、沉淀的颜色
|
颜 色 |
沉 淀 |
溶不溶于稀硝酸或盐酸 |
|
|
AgCl、BaSO4 |
|
|
|
CaCO3、BaCO3 |
|
|
|
Mg(OH)2、Al(OH)3 |
|
|
|
Fe(OH)3 |
|
|
|
Cu(OH)2 |
|
总结②、固体的颜色
|
颜 色 |
固 体 物 质 |
|
|
NaOH、Ca(OH)2、CaCO3、无水CuSO4、 NaCl、Na2CO3、CaO等 |
|
|
Cu、Fe2O3 |
|
|
炭粉(C)、MnO2、Fe3O4、CuO |
|
|
Cu2(OH)2CO3 |
|
|
CuSO4•5H2O |
|
|
KMnO4 |
总结③、溶液的颜色
|
颜 色 |
溶 液 |
|
|
铜盐(Cu2+)溶液,如CuSO4溶液、CuCl2溶液 |
|
|
铁盐(Fe3+)溶液,如Fe2(SO4)3溶液、FeCl3溶液 |
|
|
亚铁盐(Fe2+)溶液,如FeSO4溶液、FeCl2溶液 |
|
|
KMnO4溶液 |
|
|
钠盐(Na+)、钾盐(K+)、钙盐(Ca2+)、 钡盐(Ba2+)等溶液 |
总结④、离子的鉴别
|
离 子 |
检 验
试 剂 |
|
H+ |
|
|
OH- |
|
|
Cl- |
|
|
SO42- |
|
|
CO32- |
|
参考答案:
|
所含离子 |
H+ |
OH- |
Cl- |
CO32- |
SO42- |
|
所用试剂 |
紫色石蕊 |
紫色石蕊或酚酞 |
AgNO3溶液和稀HNO3 |
酸或含Ca2+、Ba2+的溶液 |
含Ba2+的溶液和稀硝酸 |
|
现象 |
变红 |
使石蕊试液变蓝,酚酞变红 |
生成白色沉淀不溶于稀HNO3 |
加酸有气体生成;加含Ca2+、Ba2+的溶液生成白色沉淀 |
生成白色沉淀不溶于稀HNO3 |
[常见的材料]
(一)金属材料:
合金――2种或2种以上的金属熔合在一起形成的混合物。(也可以是金属与非金属结合)
铁的合金——钢
钢:质坚硬,有弹性和延展性,机械性能好,可煅轧、压延、可铸造。
可以分为两大类:碳素钢和合金钢。
碳素钢:根据含碳量可分为低碳钢、中碳钢和高碳钢
合金钢:根据所加的合金元素分。如不锈钢(含铬、镍元素)、锰钢、硅钢、钨钢等。
铁还有另两种合金:生铁和熟铁。
探究实验:探索铁生锈的条件?
①提出问题:铁生锈的条件是什么?
②设计方案——提供器材:带塞子的试管若干支,普通铁钉、蒸馏水、干燥剂
③画出实验装置图(如下)
提示:可以采用控制变量法,来探索决定的因素有哪些。
介绍:若用一块纯铁片来进行上述实验,反而不宜发生锈蚀现象。
④得出的结论:铁生锈,实际上是铁、氧气和水等物质相互作用,发生的一系列复杂的化学反应。
铁锈的成分很复杂,主要是氧化铁。铁锈很疏松,易吸水。因此,铁制品表面的锈如不及时除去,会加快铁制品的生锈速度。
金属的锈蚀既与周围环境中的水、空气有关,还与金属内部的结构有关。
*防锈两大措施:
①保护膜法
如刷油漆、涂机油、封塑料膜、电镀
②改变钢铁内部结构法
如制成不锈钢
*金属的回收和利用
金属被填埋的危害:①金属一般不会自行分解,会影响土质;
②有毒的金属被腐蚀后会溶于水形成金属离子,随雨水流入河中或渗入土层,而对土壤、水源造成环境的污染。
*解决金属垃圾危害的方法:生活垃圾的分类收集、可循环再生利用。
(二)无机非金属材料
三大无机材料:水泥、陶瓷、玻璃
①水泥:常见的是硅酸盐水泥,是由石灰石与黏土混在一起在炉中燃烧成熟料后加石膏磨细而成。
钢筋混泥土:水泥、钢筋、沙、石、水搅拌一起形成的。具有牢固结实的特点。
②玻璃:普通玻璃是由石英砂、苏打、石灰石经过配料、熔化、成型、退火等工序制成。
③陶瓷:硅酸盐和其他矿物原料制成。具有耐水、耐酸碱和绝缘性等优点。
(三)有机合成材料
三大合成材料:合成塑料、合成橡胶、合成纤维
①塑料:最早的塑料叫赛璐路(乒乓球的材料)celluloid
具有可塑性,即加热到一定温度能熔化,趁热注入模具内形成各种制品。
*讨论:如果丢弃厨房里含塑料的物品,则你家厨房里的物品还剩什么?
——说明塑料对现在生活的重要性。
性能:轻而结实,加工容易,性质稳定,良好绝缘,逐渐取代了其他材料。
缺点:结构稳定,不易分解,会造成严重的环境污染“白色污染”。
[材料的发展]
1. 材料的发展历程:
石器→陶器→青铜器→钢铁的使用→合成材料的使用→新型材料的使用
2. 新型材料——指新出现或正在发展中的、具有优异特性和功能并能满足技术进步所需的材料。
——包括:光电子信息材料、先进复合材料、超级陶瓷材料、新型金属材料、新型高分子材料、超导材料。
光电子材料:实现光子变电子、电子变光子、一种频率的光子变为另一种频率的光子,或自发辐射变为受激辐射的技术,称为光电子技术。
先进复合材料:树脂基复合材料、金属基复合材料、陶瓷基复合材料、碳纤维复合材料
超级陶瓷材料:纳米陶瓷等
新型金属材料:记忆合金、铝合金、金属玻璃等
新型高分子材料:导电塑料做成的塑料电池、人工器官、可降解材料、高吸水性高分子
超导材料:

纳米材料:纳米材料是指由粒径在1-100纳米之间的粒子组成的材料。将宏观物体细分成纳米粒子后,它将显著的不同。
【典型例题】
[练习1]怎样以铜为主要原料制备硫酸铜
1. 设计实验方案:课本介绍了一种方案,其它方案由学生讨论拟定。
2. 讨论时说出实验的原理:
答案:方案一: Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
方案二: 2Cu+O2![]() 2CuO
2CuO
CuO+H2SO4![]() CuSO4+H2O
CuSO4+H2O
方案三: Cu+2AgNO3=2Ag+Cu(NO3)2
Cu(NO3)2+2NaOH=Cu(OH)2↓+2NaNO3
Cu(OH)2+H2SO4=CuSO4+2H2O
3. 针对原料的利用率、产生的污染、制备成本等方面进行讨论
方案一:利用率低、会产生污染
方案二:可以利用
方案三:成本高、步骤繁琐
化工生产原则:除了处理“三废”,不要努力提高原料的利用率,增加产品的产量,从根本上降低生产对环境造成的污染。
[练习2]随着计算机的日益普及和不断更新,废电脑材料的回收利用逐渐引起人们的重视。写出电脑配件中两种常用材料的类别(填“金属材料”、“矿物质材料”、“高分子合成材料”)
|
材料 |
铜 |
塑料 |
|
类别 |
|
|
答案:金属材料,高分子合成材料
练习3:炎热的夏季,你一定想喝一杯冰水解暑。某冷饮店出售一种特制的冰水,由服务员在水中加入一些雪状物质,该物质一放入水中立即冒出大量气泡,很快就得到一杯清凉可口的冰水,饮用时有碳酸饮料的口感。
(1)请你判断雪状的物质是 ;
(2)请你设计一个实验验证这种物质的成分。
|
操作步骤 |
实验现象 |
结论或有关化学方程式 |
|
|
|
|
答案:干冰
|
取雪状物质少量放入试管中加热,再把放出的气体通入澄清石灰水(或燃着的木条放试管口) |
试管中固体消失,石灰水变浑浊(或燃着的木条熄灭) |
干冰升华CO2+Ca(OH)2=CaCO3↓+H2O (或产生CO2不支持燃烧) |
[练习4]某同学对一种无色溶液进行鉴定实验,试根据他实验报告中的步骤和现象,填写相应的实验结论。(该溶液只含一种溶质)
|
实验步骤 |
实验现象 |
结 论 |
|
a. 取该溶液少许,向其中加几滴酚酞试液 |
溶液无变化 |
该溶液一定不显 性 |
|
b. 另取溶液少许,向其中加入锌粒,并用燃着的细木条放在试管口 |
有无色气体放出,该气体能燃烧,火焰呈淡蓝色 |
生成的气体是 说明该溶液属于 类 |
|
c. 再取该溶液少许,向其中加入硝酸银溶液,再加入足量的稀硝酸 |
有白色沉淀生成,该沉淀不溶于稀硝酸 |
白色沉淀为 说明该溶液为 |
答案:该溶液一定不显 碱 性;生成的气体是 H2 说明该溶液属于 酸 类;白色沉淀为 AgCl 说明该溶液为 盐酸 。
【模拟试题】(答题时间:45分钟)
一. 选择题
1. 纳米材料为21世纪最有前途的新型材料,纳米管是一种由碳原子构成的直径为几个纳米(1nm=10-9米)的空心管,下列说法错误的是( )
A. 纳米碳管材料如果完全燃烧,生成物是二氧化碳
B. 纳米碳管是一种新型的有机化合物
C. 纳米碳管材料管道多,表面积大,吸附能力强
D. 纳米碳管在常温下化学性质稳定
2.
在脸盆、饭盘等铁制品表面烧搪瓷的目的是( )
A. 增大硬度防止撞坏
B. 增大厚度防止摩损
C. 防止生锈且美观
D. 无任何作用
3. 用铁矿石(主要成分是Fe2O3)炼铁,反应中CO是( )
A. 燃料 B. 还原剂 C.
氧化剂 D. 催化剂
4. 下列常见材料中,属于有机合成材料的是 ( )
A. 光导纤维 B. 树脂镜片 C. 棉布 D. 钛合金眼镜架
5. 一次,小明在马路上看见一辆运输石油的油灌车的尾部拖着一条长的铁链到地上,他后来知道了这是因为车内的石油震荡,容易引发火灾,有了这条拖地链,可以预防火灾。则这里利用了铁的 ( )
A. 铁的氧化性 B 铁的延展性 C铁的导电性 D铁拖地会发出声音
6. 下列叙述错误的是( )
A. 日常生活中使用的金属材料,大多数属于合金
B. 铜呈紫红色,在潮湿的空气中它会生锈
C. 铁属于黑色金属,所以纯铁是黑色的
D. 水银是金属,在常温下呈液态
7. 某同学将沾有清水的细铁丝放在下图的装置中,经过数小时后能观察到的现象到是( )
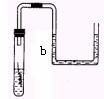
A. 铁丝不变,导管中b水面上升
B. 铁丝不变,导管中b水面不变
C. 铁丝生锈,导管中b水面上升
D. 铁丝生锈,导管中b水面不变
8. 下列各组盐能用金属与稀硫酸反应制得的是( )
A. Al2(SO4)3 B. CuSO4 C. Fe2(SO4)3 D. Ag2SO4
9. 现有①FeO、②Fe2O3、③Fe3O4、④FeS2四种含铁化合物,其含铁元素的质量分数由大到小的排列顺序是( )
A. ③>②>①>④ B. ①>③>②>④
C. ④>③>②>① D. ①>②>③>④
10. 从对人体是否有危害的角度出发,你认为炒菜的锅最好用( )
A. 铜锅 B. 铝锅 C. 不锈钢锅 D. 铁锅
11. 有一种矿石叫辰砂,加热辰砂和铁粉的混合物,完全反应后得到的产物是水银和硫化亚铁,由此可以判断辰砂的组成中一定含有的元素是…………………………( )
A. 汞 B. 硫 C. 汞和硫 D. 汞、硫、铁
12. 为了增强市民的环保意识,实行垃圾回收。以下哪些废弃物质可以回收利用 ( )
①干电池 ②口香糖 ③菜叶 ④果皮 ⑤易拉罐
A. ①⑤ B. ①③④⑤ C. ②③④ D. ①④⑤
13. 常用作食品包装的是( )
A. 聚氯化烯 B. 聚苯乙烯 C. 酚醛树脂 D. 聚乙烯
14. 收藏家收藏的清末铝制品,至今保存十分完好,该艺术品不易锈损的主要原因是( )
A. 铝不易发生化学反应
B. 铝的氧化物易发生还原反应
C. 铝不易氧化
D. 铝易氧化,但铝表面的氧化铝具有保护内部铝的作用
15. 钛和钛的合金被认为是21世纪的重要材料,它们具有很多优良的性能,如熔点高、密度小、可塑性好、易于加工,钛合金与人体有很好的“相容性”。根据它们的主要性能,下列用途不切合实际的是( )
A. 用来做保险丝 B. 用于制造航天飞机
C. 用来制造人造骨
D. 用于制造船舶
16. “绿色化学工艺”是预防污染的基本手段,其理想状态是反应物里的原子全部转化到欲制取的产物中,对环境实现零排放。下列反应类型中,一定属于“绿色化学工艺”的是( )
A. 分解反应 B. 化合反应 C. 置换反应 D. 复分解反应
17. 世界卫生组织已把铝确定为食品污染源之一,加以控制使用。铝在下列应用中应加以控制的是( )
①制铝合金 ②制炊具 ③用明矾[KAl(SO4)2]净水
④包装糖果和小食品 ⑤制电线
A. ①⑤ B. ②③④ C. ①②⑤ D. ①②③④⑤
18. 制造飞翼船时,采用了大量的铝合金材料,其原因是( )
A. 铝合金材料密度小 B. 铝合金材料强度大
C. 铝合金材料有较强的抗氧化防腐蚀能力 D. 以上都是
19. 所谓合金,就是不同金属(或非金属)在熔化状态下形成的一种具有金属特性的熔合物。根据下列四种金属的熔沸点,其中不能形成合金的是………………………( )
|
金属 |
Cu |
Al |
Fe |
Na |
|
熔点(°C) |
1083 |
660 |
1535 |
97.5 |
|
沸点(°C) |
2595 |
2200 |
3000 |
883 |
A. Fe和Na B. Al和Na C. Fe和Cu D. Al和Cu
20. 从金属材料的发展历史来看,先是青铜器时代,而后是铁器时代,铝的利用是近百年的事,这个先后顺序跟什么有关( )
①金属活动性顺序 ②地壳中金属元素的含量 ③金属的延展性
④金属的导电性 ⑤金属的冶炼难易程度
A. ①④ B. ①⑤ C. ②③ D. ④⑤
二. 简答题:
21. 市场上出售的“热敷袋”其主要成分是铁屑、炭粉、木屑和少量氧化钠、水等。热敷袋启用之前用塑料袋使其与空气隔绝,启用时打开塑料袋轻轻揉搓就会放出热量,使用完后发现有大量铁锈存在。
(1)铁锈的主要成分的化学式是 。
(2)热敷袋放出的热量是利用了 放出的热量。
22. 在常见金属中,地壳中含量最多的金属元素是 ,导电性仅次于银的金属是 。用作灯丝材料的金属是 ,常温下量液态的金属是 ,用作真空包装食品的金属箔片是 。
23. 铁可以拉成铁丝,压成铁片,是因为它具有 性,铁锅可以用来炒菜,是因为铁是 的导体。
24. 铜钱在历史上曾经是一种广泛流通的货币,已知铜的熔点是1083.4℃,铁的熔点是1534.8℃。试从物理性质和化学性质的角度分析,为什么用铜而不用铁来铸造货币?
, 。
25. 某学校附近的一化工厂排放的废水中含有大量的AgNO3、Fe(NO3)3和Ba(NO3)2,这种废水的直接排放既造成水资源的污染,又造成很大的浪费。该校学生课外活动小组决定净化废水,改善环境,变废为宝,根据现有的试剂:NaCl溶液、NaOH溶液、Ba(OH)2溶液、FeCl3溶液和稀盐酸。将废水处理得到AgCl、Fe(OH)3和Ba(NO3)2三种物质,操作流程设计如图所示。
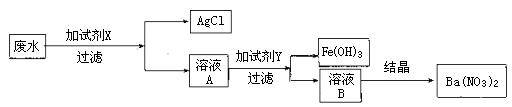
试依据上述实验回答:
(1) X最好选用 溶液,Y最好选用 溶液;
(2) 写出加入X试剂后的化学反应方程式为 。
26.
某市有一家化工厂,处理含铜垃圾的生产流程如下:
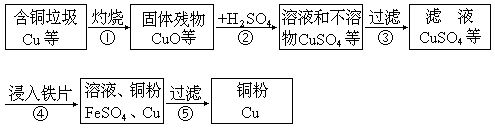
试写出上述生产流程中跟提取铜直接有关的①②④3个反应的化学方程式:
①__________________________________________
②__________________________________________
④__________________________________________
三. 分析计算题:
27. 工业上常用赤铁矿(主要成分为Fe2O3)来冶炼生铁。若赤铁矿中含Fe2O380%,则100吨赤铁矿可冶炼含杂质4%的生铁多少吨?
28. 钠蒸气放电发光问题早在1950年就得以解决,由于没有一种能抵御钠蒸气强烈腐蚀的特殊材料,直到1965年才制出第一支高压钠灯。高压钠灯的外罩是玻璃。里面的灯管是氧化铝陶瓷,又叫人造刚玉,是一种高温结构陶瓷。高温结构陶瓷是新型无机非金属材料中的一类。氧化铝陶瓷的主要性能如下:熔点高、硬度大、透明、耐高温。
问:为什么高压钠灯的灯管要用氧化铝陶瓷来制造呢?
【试题答案】
1—5 BCBBC 6—10 CCABD 11—15 CBDDA 16—20 BBDAB
21. Fe2O3
铁氧化时
22. 铝;铜;钨;汞;锡
23. 延展;导热性。
24. 铜的熔点比铁低易于铸造 , 铁比铜活泼容易锈蚀
25. (1)FeC13,Ba(OH)2;
(2)FeCl3+3AgNO3=Fe(NO3)3+3AgCl↓
26. ①2Cu+O2=2CuO
②CuO+H2SO4=CuSO4+H2O
④Fe+CuSO4=FeSO4+Cu
27. 58.3吨
28. 氧化铝陶瓷熔点高,硬度大,透明,耐高温