![]()
【同步教育信息】
一. 本周教学内容:
电解原理的应用
二. 教学目标:
1、掌握电极反应式及电解方程式的书写
2、了解电解饱和食盐水、电镀、电解精炼的原理和特点
三. 教学重点、难点:
电极反应式及电解方程式的书写
电解饱和食盐水、电镀、电解精炼的原理和特点
四. 知识分析:
电解原理在工业生产中有着广泛的应用。对于比较活泼的金属,我们常用电解的方法制取,还可以采用电解的方法对某些金属进行精炼提纯;也可以采用电解的方法制取氢氧化钠、氢气和氯气等;为了增强美观,我们可以在金属或其他物品表面镀上一薄层其他金属或合金,以增强金属的抗腐蚀能力——这就是电镀。
(一)电解饱和食盐水制氢氧化钠:电极:惰性电极;电解液:饱和NaCl溶液
阳极:2Cl――2e-=Cl2;
阴极:2H++2e-=H2;
电极总反应式:2NaCl+2H2O=2NaOH+H2↑+Cl2↑
说明:
1. 由于粗盐中含有Ca2+、Mg2+、SO42-等杂质离子,在制取NaOH时可能堵塞隔膜,同时也可能混入杂质,因此,在电解前对所用食盐必须精制,从而减少耗电量及对石墨的损耗.
2. 精制食盐的方法:

过滤除去沉淀[除去BaSO4、BaCO3、CaCO3、MgCO3、Mg(OH)2等沉淀]
加盐酸调节溶液的pH值为7.
操作中A、B、C三步的操作顺序可分为:ABC或ACB或CAB,只要保证B在A后即可.
3. 生产设备:离子交换树脂电解槽:用碳钢网制成阴极,钛网制成阳极,两极之间有阳离子交换膜.
4. 阳离子交换膜的作用:将电解槽分成阴极室和阳极室两个部分,阳离子交换膜只有阳离子可以通过,阴离子和气体分子等不能通过;防止阴极产生的氢气和阳极产生的氯气混合引起爆炸;Cl2和NaOH反应产生副产物而影响NaOH的纯度.
5. 生产流程:
粗盐→精炼→精盐的饱和溶液→阳离子交换膜中进行电解→阳极产生Cl2,阴极产生NaOH溶液和H2
(二)电解法冶炼活泼性较强的金属。金属元素中有许多活泼性较强的金属,在用还原剂还原时,由于单质的还原性较强,能与氧化产物等重新反应生成别的物质。因此,工业上往往通过电解熔融的含有金属阳离子的盐制取它们的单质。
说明:
1、用惰性电极电解熔融的NaCl制取金属钠
阳极:2Cl――2e-=Cl2;
阴极:2Na++2e-=2Na;
电极总反应式:2NaCl=2Na+Cl2↑
2、电解熔融的氧化铝、冰晶石制取金属铝。

①电极材料:碳块作阳极,钢板作阴极;②由于氧化铝的熔点很高,再熔融时往往向其中加入冰晶石作为熔剂,使氧化铝在较低的温度下熔化;③电解时要不断地从电解槽中将电解出来的铝取走,同时,要不断地向电解槽中补充氧化铝;④由于阳极附近温度较高,易发生副反应使碳块损耗,故电解时要不断补充阳极碳块。
3、采用电解法可用来冶炼:钠、镁、铝等活泼性较强的金属单质。
(三)电解精炼:利用电解的原理可以提纯铜等金属,如:电解精炼铜。
说明:
1、粗铜中含Zn、Fe、Ni、Ag、Pt、Au等杂质,可以利用电解原理精炼。
2、将不纯的金属(如粗铜)作阳极,较纯的金属作阴极,含有被提纯金属阳离子的盐溶液做电解液,就可以构成电解精炼的装置。
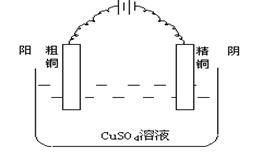
电极反应
阳极(粗铜)![]()
依照金属活动顺序,应先有Zn、Fe、Ni放电,成为离子进入溶液中,
例如![]()
阴极(粗铜)![]()
3、在阳极Zn、Fe、Ni等金属的失电子能力强于铜,先于铜失去电子进入溶液中,而溶液中Zn2+、Ni2+等阳离子得电子能力小于Cu2+,只能留在电解质溶液中。
4、金属活动顺序排在Cu后的Ag、Pt、Au等失电子能力小于Cu,以金属单质形式沉积于阳极,俗称“阳极泥”。因此,电解精炼不仅可以提纯金属,同时还可以得到Ag、Pt、Au等贵重金属。
(四)电镀:应用电解原理在某些金属表面镀上一层其他金属或合金的过程。镀层金属:通常是在空气或溶液中不易起变化的金属,如Cr、Zn、Ag、Cu等。
说明:
1、电镀:镀层金属作阳极,待镀金属作阴极,含有镀层金属阳离子的盐溶液做电解液就可以构成电镀装置。
2、金属做阳极本身失去电子,含有镀层金属阳离子的盐溶液做电解液,电镀之后为使镀层稳固,还应放在钝化液中,控制一定条件使H+、OH-不参加反应。
3、电镀的结果是:阳极金属不断减少,阴极镀层金属不断增加,而电镀液中所含金属离子的浓度保持不变。
4、电镀与电解一般区别为:①电镀时阳极为镀层金属,阳极参加反应,而电解时阳极不一定参加反应;②电镀液中的金属阳离子与阳极金属相同,而电解时则不一定相同;③电镀后电解液浓度不变,而电解时电解液浓度可能发生变化。
5、原电池、电解池和电镀池该如何判别:
(1)单池判断规律:若无外接电源则为原电池(符合原电池的构成原理),若有外接电源且阳极材料与电解液中阳离子为同种元素则为电镀池,有外接电源符合电解池的基本构造则为电解池;
(2)组合池判断规律:当多池组合时,若无外电源,则该组合中必有一池为原电池,通常选择两极活泼性差异最大的池,若有外电源,则各池均为电解池(再看是否有特殊构造以判断是否有电镀池)。
【典型例题】
[例1]关于电解NaCl水溶液,下列叙述正确的是: ( )
A. 电解时在阳极得到氯气,在阴极得到金属钠
B. 若在阳极附近的溶液中滴入KI溶液,溶液呈棕色
C. 若在阴极附近的溶液中滴入酚酞试液,溶液呈无色
D. 电解一段时间后,将全部电解液转移到烧杯中,充分搅拌后溶液呈中性
解析:电解食盐水的反应为:
阳极:2Cl――2e-=Cl2;
阴极:2H++2e-=H2;
电极总反应式:2NaCl+2H2O=2NaOH+H2↑+Cl2↑
对照分析选项,A错误;阳极附近的溶液中会溶有少量的Cl2,滴入KI溶液后发生反应:Cl2+2KI=2KCl+I2,溶液呈棕色,B正确;阴极附近产生大量的OH-,滴加酚酞后显红色,C错误;电解后生成NaOH溶液,溶液呈碱性,D错误.
答案:B
[例2]1L0.1mol/L的AgNO3溶液在以银作阳极,铁作阴极的电解槽中电解,当阴极增重2.16g时,下列判断正确的是(设电解按理论进行,溶液不蒸发)
A. 溶液的浓度变为0.08mol/L B. 阳极上产生112mL的氧气(标准状况)
C. 转移的电子数是1.204×1022个 D. 反应中有0.02mol的Ag被氧化
解析:
依据电极和电解液可知该装置为电镀池,其电极反应为:阳极Ag-e-=Ag+;阴极:Ag++e-=Ag;由此可知在电镀过程中溶液的浓度并没有发生改变,所以选项A是不正确的;由于阳极上没有氧气生成,所以选项B也是错误的;在电极反应中转移的电子的数目为:(2.16g/108g/mol)×6.02×1023/mol=1.204×1022,且有0.02mol的Ag失去电子.
答案:CD
[例3]以A、B两根石墨电极电解足量的硝酸银溶液,通电t分钟,在B极收到11.2mL标况下气体,此后将电源反接,以相同的电流强度通电t/2分钟。问:(1)A、B分别是什么极?(2)电源反接后A、B电极质量如何变化?(3)若溶液体积为200mL,则通电t/2分钟时的溶液pH=?
解析:(1)石墨电极电解足量的硝酸银溶液,通电t分钟.此时的电极反应为:
阳极:4OH--4e-=2H2O+O2,阴极:4Ag++4e-=Ag,4AgNO3+2H2O=4Ag+O2↑+4HNO3
此时B极收到11.2mL标况下气体,说明B极是阳极,A极是阴极. B极产生0.0005mol的O2,通过的电子的物质的量为0.002mol,A极生成银: 0.002mol×108g/mol=0.216g,电解液中生成0.002mol的HNO3.
(2)将电源反接,再通过t/2分钟,此时A极属于阳极,B极为阴极,电解液为硝酸银溶液,则形成电镀装置. 则两极发生的反应为:A极(阳极)Ag-e-=Ag+;B极(阴极):Ag++e-=Ag;通过的电子的物质的量为0.001mol;即阳极“溶解”0.001mol×108g/mol=0.108g的银,阴极析出0.001mol×108g/mol=0.108g的银;此时,电解液的成分和物质的量都没有发生变化,则生成的HNO3的物质的量浓度为:0.002mol/0.2L=0.01mol/L. 即![]() =0.01mol/L,pH=2
=0.01mol/L,pH=2
答案:(1)A极是阴极B极是阳极;(2)电源反接后,A极质量减轻0.108g,B极质量增加0.108g;(3)pH=2
【模拟试题】
1. 金属镍有广泛的用途. 粗镍中含有少量Fe,Ze,Cu,Pt等杂质,可用电解法制备高纯
度的镍,下列叙述正确的是 ( )
(已知:氧化性Fe2+<Ni2+<Cu2+)
A. 阳极发生还原反应:其电极反应式:Ni2++2e-=Ni
B. 电解过程中,阳极质量的减少与阴极质量的增加相等
C. 电解后,溶液中存在的金属阳离子只有Fe2+和Zn2+
D. 电解后,电解槽底部的阳极泥中只有Cu和Pt
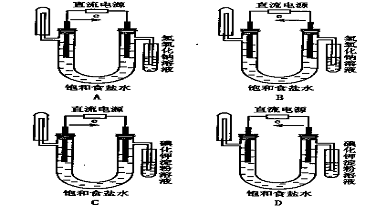
2. 下图中能验证氯化钠溶液(含酚酞)电解产物的装置是 ( )
3. CuI是一种不溶于水的白色固体,它可由反应:2Cu2++4I-=2CuI↓+I2而得到. 现以
石墨为阴极,以Cu为阳极电解KI溶液,通电前电解液中加入少量酚酞和淀粉溶液. 电解开始不久阴极区溶液呈红色,而阳极区溶液呈蓝色,对这个现象正确的解释是 ( )
①阴极电极反应2H++2e-=H2↑使c(OH-)>c(H+) ②阳极2Cu+4I-―4e-=2CuI↓+I2;I2遇淀粉变蓝 ③阳极Cu-2e-=Cu2+,Cu2+显蓝色 ④阳极2I――2e-=I2,I2遇淀粉变蓝
A. ①② B. ①③
C. ①④ D. ③④
4. 下列描述中,不符合生产实际的是 ( )
A. 电解熔融的氧化铝制取金属铝,用铁作阳极
B. 电解法精炼粗铜,用纯铜作阴极
C. 电解饱和食盐水制烧碱,用涂镍碳钢网作阴极
D. 在镀件上电镀锌,用锌作阳极
5. 电解饱和食盐水制取氯气,已知铅蓄电池的电极反应为:![]() ,今若制得0.05mol的氯气,此时电池内消耗的硫酸的物质的量至少是 ( )
,今若制得0.05mol的氯气,此时电池内消耗的硫酸的物质的量至少是 ( )
A、0.025mol B、0.05mol C、0.10mol D、0.20mol
6. 将分别盛有熔融的氯化钾、氯化镁、氧化铝的三个电解槽串联,在一定条件下通电电解一段时间后,析出钾、镁、铝的物质的量之比为 ( )
A、1∶2∶3 B、3∶2∶1 C、6∶3∶1 D、6∶3∶2
7. 1L K2SO4和CuSO4的混合溶液中![]() =2mol/L,用石墨电极电解此溶液,通电一段时间后,两极均收集到22.4L(标准状况)气体,则原溶液中K+的浓度为 ( )
=2mol/L,用石墨电极电解此溶液,通电一段时间后,两极均收集到22.4L(标准状况)气体,则原溶液中K+的浓度为 ( )
A、0.5mol/L B、1mol/L C、1.5mol/L D、2mol/L
8. 两根镍棒分别与电源正负极相连,并都插入NiSO4溶液中,若电流强度为I,通电时间为t,结果阳极失重m g,已知每个电子的电量为1.6×10-19Q(库仑),镍的摩尔质量为:58.69g/mol,则可推知阿伏加德罗常数为: ( )
![]() 9. 电解原理在化学工业中有广泛应用. 图为一个电解池,装有电解液a;X,Y是两块电
9. 电解原理在化学工业中有广泛应用. 图为一个电解池,装有电解液a;X,Y是两块电
极板,通过导线与直流电源相连.
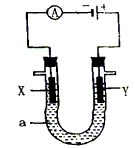
请回答以下问题:
(1)若X,Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则:
①电解池中X极上的电极反应式是 . 在X极附近观察到的现象是 .
②Y电极上的电极反应式是 ,检验该电极反应产物的方法是 .
(2)如果要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则
①X电极的材料是 ,电极反应式是 .
②Y电极的材料是 ,电极反应式是 .
(说明:杂质发生的电极反应不必写出)
10. 工业上为了处理含有Cr2O72-的酸性工业废水,采用下面的处理方法:往工业废水中加入适量NaCl,以Fe为电极进行电解,经过一段时间,有Cr(OH)3和Fe(OH)3沉淀生成,工业废水中铬的含量已低于排放标准. 请回答问题:
(1)两极发生反应的电极反应式:
阳极: ;阴极: .
(2)写出Cr2O72-变为Cr3+的离子方程式: .
(3)工业废水由酸性变为碱性的原因是 ;
(4) (填“能”或“不能”)改用石墨电极,原因是: .
11. 在玻璃圆筒中盛有两种无色的互不相溶的中性液体。上层液体中插入两根石墨电极,圆筒内还放有一根下端弯成环状的玻璃搅棒,可以上下搅动液体,装置如图。接通电源,阳极周围的液体呈现棕色,且颜色由浅变深,阴极上有气泡生成。停止通电,取出电极,用搅棒上下剧烈搅动。静置后液体又分成两层,下层液体呈紫红色,上层液体几乎无色。根据上述实验回答:
(1)阳极上的电极反应式为________________________________。
(2)阴极上的电极反应式为________________________________。
(3)原上层液体是________________________________________。
(4)原下层液体是________________________________________。
(5)搅拌后两层液体颜色发生变化的原因是_______________________________。
(6)要检验上层液体中含有的金属离子,其方法是_________________________,现象是_________________________________________________________________________。

12. 用铂电极电解AgNO3饱和溶液(溶质的质量分数为17%),当银全部析出时,阳极放出5.6L气体(标准状况),此时溶液密度为1.038g/cm3。
求:(1)电解前AgNO3饱和溶液的质量和析出银的质量
(2)电解后溶液中溶质的质量分数和物质的量浓度。
![]()
【试题答案】
1、D 2、D 3、A 4、A 5、C 6、D 7、D 8、C
9、(1)①2H++2e-=H2↑ 放出气体,溶液变红
②2Cl――2e-=Cl2↑
把湿润的碘化钾淀粉试纸放在Y电极附近,试纸变蓝色。
(2)①纯铜 Cu2++2e-=Cu
②粗铜 Cu-2e-=Cu2+
10、(1):Fe-2e-=Fe2+;2H++2e-=H2;
(2)Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O
(3)H+不断放电,Cr2O72-与Fe2+反应消耗H+,打破了水的电离平衡,使溶液中![]()
(4)不能,因为用石墨作电极,阳极产生氯气,得不到Fe2+,缺少还原剂
11、(1)2![]() =I2
=I2
(2)2![]() =H2↑
=H2↑
(3)KI(或NaI等)水溶液
(4)CCl4(或CHCl3等)
(5)I2在CCl4中的溶解度大于在水中的溶解度,所以绝大部分I2都转移到CCl4中
(6)焰色反应 透过蓝色钴玻璃观察火焰呈紫色(其它合理答案同样给分。例如,若(3)中答NaI水溶液,这里答火焰呈黄色。)
12、(1)1000g,108g (2)7.13%;1.17mol/L
【励志故事】
同样一斤米
一青年向一禅师求教。
“大师,有人赞我是天才,将来必有一番作为;也有人骂我是笨蛋,一辈子不会有多大出息。依您看呢?”
“你是如何看待自己的?”禅师反问。
青年摇摇头,一脸茫然。
“譬如同样一斤米,用不同眼光去看,它的价值也就迥然不同。在炊妇眼中,它不过做两三碗大米饭而已;在农民看来,它最多值1元钱罢了;在卖粽子人的眼里,包扎成粽子后,它可卖出3元钱;在制饼者看来,它能被加工成饼干,卖5元钱;在味精厂家眼中,它可提炼出味精,卖8元钱;在制酒商看来,它能酿成酒,勾兑后,卖40元钱。不过,米还是那斤米。”
大师顿了顿,接着说:“同样一个人,有人将你抬得很高,有人把你贬得很低,其实,你就是你。你究竟有多大出息,取决于你到底怎样看待自己。”
青年豁然开朗。