乙炔 炔烃
1.复习重点
1.乙炔的分子结构、化学性质、实验室制法;
2.炔烃的组成、结构、通式、通性。
2.难点聚焦
一、乙炔分子的结构和组成
分子式 电子式 结构式
C2H2 ![]() H-C≡C-H 乙炔分子的比例模型
H-C≡C-H 乙炔分子的比例模型
二、乙炔的实验室制法
CaC2+2H2O ![]() C2H2↑+Ca(OH)2
C2H2↑+Ca(OH)2
乙炔可以通过电石和水反应得到。实验中又该注意哪些问题呢?
[投影显示]实验室制乙炔的几点说明:
①实验装置在使用前要先检验气密性,只有气密性合格才能使用;
②盛电石的试剂瓶要及时密封,严防电石吸水而失效;
③取电石要用镊子夹取,切忌用手拿电石;
④作为反应容器的烧瓶在使用前要进行干燥处理;
⑤向烧瓶里加入电石时,要使电石沿烧瓶内壁慢慢滑下,严防让电石打破烧瓶;
⑥电石与水反应很剧烈,向烧瓶里加水时要使水逐滴慢慢地滴下,当乙炔气流达到所需要求时,要及时关闭分液漏斗活塞,停止加水;电石是固体,水是液体,且二者很易发生反应生成C2H2气体。很显然C2H2的生成符合固、液,且不加热制气体型的特点,那是不是说就可以用启普发生器或简易的启普发生器来制取乙炔呢?
⑦实验室中不可用启普发生器或具有启普发生器原理的实验装置作制备乙炔气体的实验装置。主要原因是:
a.反应剧烈,难以控制。
b.当关闭启普发生器导气管上的活塞使液态水和电石固体分离后,电石与水蒸气的反应还在进行,不能达到“关之即停”的目的。
c.反应放出大量的热,启普发生器是厚玻璃仪器,容易因受热不均而炸裂。
d.生成物Ca(OH)2微溶于水,易形成糊状泡沫,堵塞导气管与球形漏斗。
该如何收集乙炔气呢?
乙炔的相对分子质量为26,与空气比较接近,还是用排水法合适。
熟悉和体会有关乙炔气体制备的注意事项及收集方法,并由两名学生上前按教材图5—14乙炔的制取装置图组装仪器,检查气密性,将电石用镊子小心地夹取沿平底烧瓶内壁缓慢滑下,打开分液漏斗的活塞使水一滴一滴地缓慢滴下,排空气后,用排水法收集乙炔气于一大试管中。
由几个学生代表嗅闻所制乙炔气的气味。
请大家根据乙炔分子的结构和所收集的乙炔气来总结乙炔具有哪些物理性质?
三、乙炔的性质
1.物理性质
无色、无味、ρ=1.16g/L、微溶于水、易溶于有机溶剂
实际上纯的乙炔气是没有气味的,大家之所以闻到特殊难闻的臭味是由于一般所制备得到的乙炔气中常含有PH3、H2S等杂质造成的。
根据乙炔、乙烯和乙烷的分子结构特点,预测乙炔该有哪些化学性质?
[小组讨论]乙烷分子中两个碳原子的价键达到饱和,所以其化学性质稳定;乙烯分子中含有碳碳双键,而双键中有一个键不稳定,易被打开,所以容易发生加成反应和聚合反应;乙炔分子中两个碳原子以叁键形式结合,碳原子也不饱和,因此也应该不稳定,也应能发生加成反应等。
大家所推测的究竟合理不合理,下边我们来予以验证。
[演示实验5—7](由两名学生操作)将原反应装置中导气管换成带玻璃尖嘴的导管,打开分液漏斗活塞,使水缓慢滴下,排空气,先用试管收集一些乙炔气验纯,之后用火柴将符合点燃纯度要求的乙炔气体按教材图5—14所示的方法点燃。观察现象:点燃条件下,乙炔在空气中燃烧,火焰明亮而伴有浓烈的黑烟。
乙炔可以燃烧,产物为H2O和CO2,在相同条件下与乙烯相比,乙炔燃烧的更不充分,因为碳原子的质量分数乙炔比乙烯更高,碳没有得到充分燃烧而致。
(补充说明)乙炔燃烧时可放出大量的热,如在氧气中燃烧,产生的氧炔焰温度可达3000℃以上,因此可用氧炔焰来焊接和切割金属。
2.乙炔的化学性质
(1)氧化反应
a.燃烧 2CH≡CH+5O2![]() 4CO2+2H2O
4CO2+2H2O
检验其能否被酸性KMnO4溶液所氧化。
[演示实验5—8](另外两名学生操作)打开分液漏斗的活塞,使水缓慢滴下,将生成的乙炔气通入酸性KMnO4溶液中观察现象:片刻后,酸性KMnO4溶液的紫色逐渐褪去。
由此可以得到什么结论?
乙炔气体易被酸性KMnO4溶液氧化。
前边的学习中提到由电石制得的乙炔气体中往往会含有硫化氢、磷化氢等杂质,这些杂质也易被酸性KMnO4溶液氧化,实验中如何避免杂质气体的干扰?
可以将乙炔气先通过装有NaOH溶液(或CuSO4溶液)的洗气瓶而将杂质除去。
b.易被酸性KMnO4溶液氧化
[演示实验5—9]打开分液漏斗的活塞,使水缓慢滴下,将生成的乙炔气体通入溴的四氯化碳溶液中,观察现象:溴的四氯化碳中溴的颜色逐渐褪去。
溴的四氯化碳溶液褪色,说明二者可以反应且生成无色物质,那么它们之间的反应属于什么类型的反应?(属于加成反应)
从时间上来看是乙烯与溴的四氯化碳溶液褪色迅速还是乙炔与之褪色迅速?
(回答)乙烯褪色比乙炔的迅速。
这说明了什么事实?乙炔的叁键比乙烯的双键稳定。
应注意乙炔和溴的加成反应是分步进行的,可表示如下:
(2)加成反应
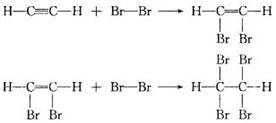
1,2—二溴乙烯
1,1,2,2—四溴乙烷
乙炔除了和溴可发生加成反应外,在一定条件下还可以与氢气、氯化氢等发生加成反应。
![]()
乙炔与乙烯类似,也可以与溴水中的溴发生加成反应而使溴水褪色,且加成也是分步进行的;乙炔与氢气加成时第一步加成产物为乙烯,第二步产物为乙烷,

参看教材前边的彩图——塑料管和教材相关内容,了解聚氯乙烯的用途及性能。
[学生活动]自学P128讨论了解聚氯乙烯产品的广泛用途及其优缺点,并总结乙炔的主要用途:重要的化工原料;气割、气焊等。
乙烷 |
乙烯 |
乙炔 |
||
化学 式 |
C2H6 |
C2H4 |
C2H2 |
|
电 子 式 |
|
|
|
|
结 构 式 |
|
|
|
|
结 构 特 点 |
C - C(单键), 碳原子的化合达 “饱和” |
C = C(双键), 碳原子的化合价未达“饱和” |
碳原子的化合价未达“饱和” |
|
化 学 活 动 性 |
稳 定 |
活 泼 |
较 活 泼 |
|
化 学 性 质 |
取 代 反 应 |
卤代 |
—— |
—— |
燃 烧 |
火焰不明亮 |
火焰明亮,带黑烟 |
火焰明亮,带浓黑烟 |
|
氧 化 反 应 |
KMnO4溶液不褪色 |
KMnO4溶液褪色 |
KMnO4溶液褪色 |
|
加 成 反 应 |
—— |
溴水褪色 |
溴水褪色 |
|
聚 合 反 应 |
—— |
能 聚 合 |
能 聚 合 |
|
鉴 别 |
KMnO4溶液不褪色或溴水不褪色 |
KMnO4溶液褪色或溴水褪色 |
KMnO4溶液褪色或溴水褪色 |
|
(引出有机物分子的共线、共面问题)
下列描述CH3 -CH═CH-C≡C-CH3 分子结构的叙述中,正确的是[ BC ]。
A.6个碳原子有可能都在一条直线上
B.6个碳原子不可能都在一条直线上
C.6个碳原子有可能都在同一平面上
D.6个碳原子不可能都在同一平面上
解析:由乙烯、乙炔分子的空间构型可推出该物质的分子构型为:

如果说乙烯是烯烃也就是含碳碳双键结构的烃的代表的话,那么乙炔也必然是含碳碳叁键的另一类不饱和烃的代表,像这类不饱和烃中也都含有碳碳叁键,我们称之为炔烃。
四、炔烃
1.炔烃的概念
分子里含有碳碳三键的一类链烃
2.炔烃的通式 CnH2n-2
烯烃在组成上比等碳原子数的饱和烷烃少两个氢,通式变为CnH2n,炔烃的碳碳叁键,使得分子内氢原子数比等碳原子数的烯烃又少了两个,故其通式应为CnH2n-2
3.炔烃的物理性质
自学、讨论、总结、归纳炔烃物理性质的变化规律:
①一系列无支链、叁键位于第一个碳原子和第二个碳原子之间的炔烃,随着分子里碳原子数的增加,也就是相对分子质量的增加,熔沸点逐渐升高,相对密度逐渐增大;
②炔烃中n≤4时,常温常压下为气态,其他的炔烃为液态或者固态;
③炔烃的相对密度小于水的密度;
④炔烃不溶于水,但易溶于有机溶剂。
4.炔烃的化学性质
由乙炔的化学性质可以推知炔烃有哪些化学性质呢?
由于炔烃中都含有相同的碳碳叁键,炔烃的化学性质就应与乙炔相似,如容易发生加成反应、氧化反应等,可使溴的四氯化碳溶液、溴的水溶液及酸性KMnO4溶液褪色等。也可以利用其能使上述几种有色溶液褪色来鉴别炔烃和烷烃,另外在足够的条件下,炔烃也能发生加聚反应生成高分子化合物,如有一种导电塑料就是将聚乙炔加工而成的。
本节小结:本节课我们重点学习了乙炔的主要化学性质如氧化反应、加成反应等,了解了乙炔的用途,并通过乙炔的有关性质分析和比较了炔烃的结构特征、通式及主要的性质,使我们清楚了结构决定性质这一辩证关系。
3.例题精讲
[例1] 由两种气态烃组成的混合气体20 mL,跟过量氧气混合后进行完全燃烧。当燃烧产物通过浓![]() 后体积减少30 mL,然后通过碱石灰体积又减少40mL(气体在相同条件下测得)。则这两种烃为( )
后体积减少30 mL,然后通过碱石灰体积又减少40mL(气体在相同条件下测得)。则这两种烃为( )
A. ![]() 与
与![]() B.
B. ![]() 与
与![]()
C. ![]() 与
与![]() D.
D. ![]() 与
与![]()
解析:由![]() 得
得![]() ,故混合烃的平均分子式为
,故混合烃的平均分子式为![]() 。
。
满足分子里碳原子数为2,氢原子数不可能为3,其中一种烃分子中氢原子数小于3,另一种烃分子中氢原子数大于3,所以![]() 与
与![]() 及
及![]() 与
与![]() 满足要求。
满足要求。
答案:B、C。
[例2] 将三种气态烃以任意比例混合,与足量的氧气在密闭容器里完全燃烧,在温度不变的条件下(![]() )其压强也不变,推断这三种烃的分子式________,由此可以总结出什么规律?
)其压强也不变,推断这三种烃的分子式________,由此可以总结出什么规律?
解析:因为1个碳原子转变为![]() 时需要1分子
时需要1分子![]() ,4个氢原子转变为2分子
,4个氢原子转变为2分子![]() 时也需要1分子
时也需要1分子![]() ,通过烃的分子式就可以确定需要的
,通过烃的分子式就可以确定需要的![]() 的量和生成的
的量和生成的![]() 与
与![]() 的量,再根据阿佛加德罗定律即可求解。
的量,再根据阿佛加德罗定律即可求解。![]() ,需
,需![]() ,生成
,生成![]() 、
、![]()
![]() ,容器内气体压强不变。
,容器内气体压强不变。
答案:![]() ,
,![]() ,
,![]() ;凡分子里氢原子个数为4的气态烃,完全燃烧前后气体总物质的量不变,若温度高于
;凡分子里氢原子个数为4的气态烃,完全燃烧前后气体总物质的量不变,若温度高于![]() 的密闭容器中,定温时,其压强不变。
的密闭容器中,定温时,其压强不变。
[例3] 某同学设计了如图1所示的实验装置来粗略地测定电石中碳化钙的质量分数。

图1
(1)烧瓶中发生反应的化学方程式为_______;装置B、C的作用是_______;烧瓶要干燥,放入电石后应塞紧橡皮塞,这是为了_______。
(2)所用电石质量不能太大,否则________;也不能太小,否则________;若容器B的容积为250 mL,则所用电石的质量应在________g左右(从后面数据中选填:0.03,0.60,1.00,1.50,2.00)。
(3)分液漏斗往烧瓶里滴加水的操作方法是________。
(4)实验中测得排入量筒中水的体积为V L、电石的质量为W g。则电石中碳化钙的质量分数是________%(不计算导管中残留的水,气体中饱和的水蒸气等也忽略不计)。
解析:本题必须弄清测定电石中碳化钙质量分数的原理:它是利用测量量筒中水的体积来测量乙炔气体之体积,再由乙炔气体体积来计算碳化钙的质量分数。因此在量筒前的装置都必须密闭,产生乙炔的量不能超过B瓶中水的体积,也不能使流入量筒的水太小,否则会导致实验失败。
答案:
(1)![]() ;B贮水,以使烧瓶A中产生的
;B贮水,以使烧瓶A中产生的![]() 进入B时,排出与它等体积的水进入量筒。C测定乙炔的体积;防止电石与残留的水或水汽作用产生的乙炔逸散到大气中。
进入B时,排出与它等体积的水进入量筒。C测定乙炔的体积;防止电石与残留的水或水汽作用产生的乙炔逸散到大气中。
(2)产生![]() 太多,超过B的容积而无法测定
太多,超过B的容积而无法测定![]() 的体积;生成
的体积;生成![]() 太少,测出的
太少,测出的![]() 体积值太小,误差太大;0.60。
体积值太小,误差太大;0.60。
(3)轻轻旋开活塞,使水缓慢地滴下,直到不再产生气体时关闭活塞。
(4)286V/W。
4.实战演练
一、选择题
1.(2001年高考理综题)具有单双键交替长链(如:…—CH==CH—CH==CH—CH==CH—…)的高分子有可能成为导电塑料。2000年诺贝尔(Nobel)化学奖即授予开辟此领域的3位科学家。下列高分子中可能成为导电塑料的是
A.聚乙烯 B.聚丁二烯
C.聚苯乙烯 D.聚乙炔
2.燃烧某混合气体,所产生的CO2的质量一定大于燃烧相同质量的丙烯所产生的CO2的质量,该混合气体是
A.丁烯、丙烷 B.乙炔、乙烯
C.乙炔、丙烷 D.乙烷、环丙烷
3.实验室制取下列气体的方法正确的是
A.氨:将消石灰和氯化铵加热,并用向下排空气法收集
B.乙炔:将电石和水在启普发生器中反应,并用向上排空气法收集
C.乙烯:将乙醇加热至170℃,并用排水集气法收集
D.硫化氢:用硫化亚铁与稀盐酸反应,并用向下排空气法收集
4.科学家于1995年合成了一种化学式为C200H200含有多个C≡C (碳碳叁键)的链状烃,其分子中含有C≡C最多是
A.49个 B.50个
C.51个 D.无法确定
5.分子式为C7H12的某烃在一定条件下充分加氢后的生成碳链骨架为

则此烃不可能具有的名称是
A.4—甲基—1—己炔
B.3—甲基—2—己炔
C.3—甲基—1—己炔
D.4—甲基—3—己炔
6.甲烷分子中的四个氢原子都可以被取代。若四个氢原子均被苯基取代,得到的分子结构如下图,对该分子的描述,不正确的是

A.化学式为C25H20
B.所有碳原子都在同一平面上
C.此分子属非极性分子
D.此物质属芳香烃类物质
7.描述CH3—CH==CH—C≡CF3分子结构的下列叙述中正确的是
A.6个C原子有可能都在一条直线上
B.6个C原子不可能都在一条直线上
C.6个C原子有可能都在同一平面上
D.6个C原子不可能都在同一平面上
8.某温度和压强下,由3种炔烃(分子中只含有一个C≡C)组成的混合气体4 g与足量的H2充分加成后生成4.4 g 3种对应的烷烃,则所得烷烃中一定有
A.异丁烷 B.乙烷
C.丙烷 D.丁烷
9.某烃CnHm在一定条件下与H2反应,取不同体积比的CnHm与H2作以上实验(总体积为V),右图中横轴表示CnHm与H2占投料总体积的百分率,据图分析,m、n的关系为

A.m=2n-6
B.m=2n-2
C.m=2n
D.m=2n+2
二、非选择题(共55分)
10.(9分)已知烯烃、炔烃,经臭氧作用发生反应:

CH3COOH+HOOC—CH2—COOH+HCOOH,
某烃分子式为C10H10,在臭氧作用下发生反应:C10H10 ![]() CH3COOH+3HOOC—CHO+CH3CHO。
CH3COOH+3HOOC—CHO+CH3CHO。
试回答:
①C10H10分子中含 个双键, 个叁键;
②C10H10的结构简式为 。
11.(14分)已知下列反应:

用石灰石、食盐、焦炭、水为主要原料,写出合成

的化学方程式。
12.(12分)下图为简易测定电石中CaC2质量分数的装置。在烧瓶中放入1.2 g电石,常温(20℃)常压下开启分液漏斗的活栓,慢慢滴水至不再产生气体为止,待到烧瓶内的温度恢复到常温,测量烧杯中水的体积为361毫升,试回答:

(1)电石中含CaC2的质量分数是多少?
(2)如未等恢复到20℃就测量其排出水的体积,对实验结果会产生什么影响?
13.(9分)(2000年上海市高考题)美籍埃及人泽维尔用激光闪烁照相机拍摄到化学反应中化学键断裂和形成的过程,因而获得1999年诺贝尔化学奖。激光有很多用途,例如波长为10.3 μm的红外激光能切断B(CH3)3分子中的一个B—C键,使之与HBr发生取代反应:
B(CH3)3+HBr![]() B(CH3)2Br+CH4
B(CH3)2Br+CH4
而利用9.6 μm的红外激光能切断两个B—C键,并与HBr发生二元取代反应。
(1)试写出二元取代的化学方程式。
(2)现用5.6 g B(CH3)3和9.72 g HBr正好完全反应,则生成物中除了甲烷外,其他两种产物的物质的量之比为多少?
14.(11分)某链烃CnHm属烷烃或烯烃、炔烃中的一种,使若干克该烃在足量O2中完全燃烧,生成x L CO2及1 L水蒸气(120℃、101.3 kPa)。试讨论根据x的不同取值范围来确定该烃所属类型及其分子内所含碳原子数n值(用含烃的表达式或实际数值表示)。
附参考答案
一、1.D 2.B 3.A 4.B 5.BD 6.B 7.BC 8.B 9.B
二、10.①2 2
②CH3C≡C—CH==CH+—C≡C—CH==CH—CH3
11.2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑
2NaOH+H2↑+Cl2↑
H2+Cl2![]() 2HCl
2HCl
CaCO3![]() CaO+CO2↑
CaO+CO2↑
CaO+3C![]() CaC2+CO↑
CaC2+CO↑
CaC2+2H2O===Ca(OH)2+C2H2↑
2CH≡CH  CH2==CH—C≡CH
CH2==CH—C≡CH
CH2==CH—C≡CH+HCl![]() CH2==CH—CCl==CH2
CH2==CH—CCl==CH2

12.(1)CaC2的质量分数为86%
(2)使测定结果偏大
13.(1)B(CH3)3+2HBr![]() B(CH3)Br2+2CH4;
B(CH3)Br2+2CH4;
(2)4∶1
14.依据各类链烃的燃烧通式,结合生成的CO2、H2O的体积,可分以下情况讨论:
(1)若为烷烃,有![]()
明显地,有![]() ≤x<1,n=
≤x<1,n=![]()
(2)若为烯烃,有![]() ,则x=1,n≥2。
,则x=1,n≥2。
(3)若为炔烃,![]()
则1<x≤2,n=![]()