铁和铁的化合物
1.复习重点
1.铁单质的化学性质
2.铁的重要化合物的氧化还原性;
3.Fe(Ⅱ)、Fe(Ⅲ)的相互转化是高考的热点。
2.难点聚焦
一、铁的结构和性质
1. 铁是26号元素,位于第四周期第Ⅷ族,属于过渡元素。
原子结构示意图:

主要化合价:+2,+3
2.铁在金属的分类中属于黑色金属,重金属,常见金属。纯净的铁是光亮的银白色金属,密度为7.86g/㎝3,熔沸点高,有较好的导电、传热性,能被磁铁吸引,也能被磁化。还原铁粉为黑色粉末。
3.铁是较活泼的金属元素,在金属活动性顺序表中排在氢的前面。
①跟非金属反应: 点燃 点燃 △
3Fe+2O2 == Fe3O4 2Fe+3Cl2 ==2FeCl3 Fe+S= FeS
Fe+I2= FeI2
②跟水反应: 3Fe+4H2O= Fe3O4+4H2↑
③跟酸作用:Fe+2H+=Fe2++H2↑(遇冷浓硝酸、浓硫酸钝化;与氧化性酸反应不产生H2,且氧化性酸过量时生成Fe3+)
④与部分盐溶液反应:Fe+Cu2+=Fe2++Cu Fe+2Fe3+=3Fe2+
3.生铁与钢的比较
铁的合金 |
生铁 |
钢 |
含碳量 |
2%~4.3% |
0.03%~2% |
其它杂质 |
含硅、锰、硫、磷较多 |
含硅、锰少量,硫和磷几乎没有 |
机械性能 |
硬而脆、无韧性 |
硬而韧、有弹性 |
机械加工 |
可铸不可锻 |
可铸、可锻、可压延 |
4.炼铁和炼钢的比较
炼铁 |
炼钢 |
|
原料 |
铁矿石、焦炭、石灰石、空气 |
生铁、空气(或纯氧、氧化铁)、生石灰、脱氧剂 |
化学原理 |
在高温下用还原剂从铁矿石里还原出来 |
在高温下用氧化剂把生铁里过多的碳和其它氧化为气体或炉清除去 |
主 要 反 应 |
①还原剂的生成 C+O2 CO2+C ②铁的还原 Fe2O3+3CO ③炉渣的生成 CaCO3 CaO+SiO2 |
①氧化:2Fe+O2 FeO氧化铁水里的Si、Mn、C等。如C+FeO
②造渣:生成的硅锰氧化物得铁水里的硫、磷跟造渣材料反应形成炉渣排出。 ③脱氧,并调整Mn、Si含量 2FeO+Si |
主要设备 |
高炉 |
转炉 |
1.过渡元素位于周期表中中部从ⅢB~ⅡB族十个纵行,分属于第四周期至第七周期。过渡元素都是金属,又叫过渡金属。
过渡金属的密度一般比较大,熔沸点较高,有较高的硬度、较好的延展性和机械加工性能,较好的导电、导热性能和耐腐蚀性能。
过渡元素的原子最外层电子数不超过两个,在化学反应中,最外层和次外层都容易失去电子,因此过渡元素有可变化合价。所以当Fe与弱氧化剂反应时,只失去最外层上的2个电子,形成Fe2+;当Fe与强氧化剂反应时,还能进一步失去次外层上的一个电子,形成Fe3+。这就是铁在其化合物中通常显+2价或+3价的原因。则Fe发生化学反应能得到+2价还是+3价,需看参加反应的氧化剂的强弱,有时还要看反应物的量之间的关系。
例如:①铁在O2中燃烧的,一定要在集气瓶低留有少量的水或一层沙子,防止瓶子被炸裂;②Fe与S反应中Fe只能失去其最外层的2个电子而变成+2价,反应开始后撤去酒精灯,反应可以继续进行,说明反应放热;③Fe在Cl2中燃烧时不但能失去最外层的2个电子,而且还可失去次外层的1个电子后成+3价,说明氧化性Cl2>S;④在高温时能与C、P、Si等化合。
2.铁的合金
一般地说,含碳量在2%~4.3%的铁的合金叫做生铁。生铁里除含碳外,还含有硅、锰以及少量的硫、磷等,它可铸不可煅。根据碳的存在形式可分为炼钢生铁、铸造生铁和球墨铸铁等几种。
一般地说,含碳量在0.03%~2%的铁的合金叫做钢。钢坚硬有韧性、弹性,可以锻打、
压延,也可以铸造。
钢的分类方法很多,如果按化学成分分类,钢可以分为碳素钢和合金钢两大类。碳素钢就是普通的钢。合金钢也叫特种钢,是在碳素钢是适当地加入一种或几种,如锰、铬、镍、钨、铜等合金元素而制成的。合金元素使合金钢具有各种不同的特殊性能。
3.炼铁
(1)反应原理:利用氧化——还原反应,在高温下,用还原剂(主要是CO)把铁从铁矿石里还原出来。
(2)原料:铁矿石、焦炭、石灰石和空气
(3)设备:高炉
(4)生产过程
①还原剂的生成
C+O2![]() CO2 CO2+C
CO2 CO2+C ![]() 2CO
2CO
②铁矿石还原成铁
Fe2O3+3CO ![]() 2Fe+3CO2↑
2Fe+3CO2↑
③除脉石、炉渣的形成
CaCO3![]() CaO+CO2↑
CaO+CO2↑
SiO2+CaO![]() CaSiO3
CaSiO3
4.炼钢
(1)设备:氧气顶吹转炉
(2)主要原料:炼钢生铁、生石灰、氧气。
(3)反应原理:利用氧化还原反应,在高温下,用氧化剂把生铁中过多的碳和其它杂质氧化为气体或炉渣除去。
(4)炼钢时的主要反应:
①氧化剂的生成,热能的来源 2Fe+O2![]() 2FeO
2FeO
②降低碳的含量 C+FeO![]() CO+Fe
CO+Fe
③除去S、P等杂质
④加硅铁、锰铁、铝除剩余FeO——脱氧
2FeO+Si![]() 2Fe+SiO2
2Fe+SiO2
二、铁的氧化物和氢氧化物
1.铁的氧化物的比较
铁的氧 化物 |
FeO |
Fe2O3 |
Fe3O4 |
|
俗称 |
铁红 |
磁性氧化铁 |
||
色、态 |
黑色粉末 |
黑色晶体 |
红棕色粉末 |
|
铁的价态 |
+2 |
+3 |
+2、+3 |
|
水溶性 |
难溶于水 |
|||
稳定性 |
不稳定性 6FeO+O2=2Fe3O4 |
稳定 |
稳定 |
|
与酸的反应 |
FeO+2H+=Fe2++H2O |
Fe2O3+6H+=2Fe3+ +3H2O |
Fe3O4+8H+=2Fe3++ Fe2++4H2O |
|
与CO的反应 |
FexOy+yCO=xFe+yCO2 |
|||
制取 |
高温熔融,过量的铁与氧气反应 2Fe+O2=2FeO |
Fe(OH)3的分解 2Fe(OH)3=Fe2O3 +3H2O |
铁在氧气中燃烧 3Fe+2O2=Fe3O4 |
|
2.铁的氢氧化物的比较
Fe(OH)2 |
Fe(OH)3 |
|
物理性质 |
白色,难溶于水的固体 |
红褐色,难溶于水的固体 |
化学性质 |
(1)与非氧化性强酸反应 Fe(OH)2+2H+=Fe2++2H2O (2)与氧化性酸反应 3Fe(OH)2+10HNO3=3Fe(NO3)3+NO↑+8H2O (3)空气中放置被氧化 4Fe(OH)2+2H2O+O2=4Fe(OH)3 |
(1)与酸反应 Fe(OH)3+3H+=Fe3++3H2O (2)受热分解 2Fe(OH)3=Fe2O3+3H2O |
制备 |
①煮沸蒸馏水,赶走溶解的氧气②煮沸NaOH溶液,赶走溶解的氧气③配制FeSO4溶液,加少量的还原铁粉④用长滴管将NaOH溶液送入FeSO4溶液液面以下 Fe2++2OH-=Fe(OH)2↓ |
将NaOH溶液滴入Fe2(SO4)3溶液中 Fe3++3OH-=Fe(OH)3↓ |
1. Fe3O4是复杂的化合物,经研究证明,在Fe3O4晶体中有1/3的Fe是+2价,有2/3的Fe是+3价,可看成FeO·Fe2O3,实际应写成Fe(FeO2)2,即铁酸亚铁盐,不是一般的氧化物。
2.Fe(OH)2和Fe(OH)3从溶液中析出的现象不同,前者是白色絮状沉淀,后者是红褐色沉淀。而Fe(OH)2极不稳定,易被氧化成Fe(OH)3,反应现象是:白色→灰绿色→红褐色。
若要观察到白色的Fe(OH)2沉淀,需要创造以下条件:
(1)排除亚铁盐溶液里的Fe3+离子,以免Fe3+离子直接与OH-结合生成Fe(OH)3。
(2)尽量排除溶液中溶解的氧气(绝对排除是办不到的),以减慢生成的Fe(OH)2被氧化成Fe(OH)3的速度。
反应要用新制备的亚铁盐溶液,并放入少量的铁以防止Fe3+离子产生。亚铁盐溶液与碱溶液在混合前分别加热以排除溶有的空气,然后,把碱溶液沿着试管壁加入盛亚铁盐溶液的试管中,或把滴管尖嘴直接插入液面下再加入碱溶液,可观察到白色絮状沉淀。
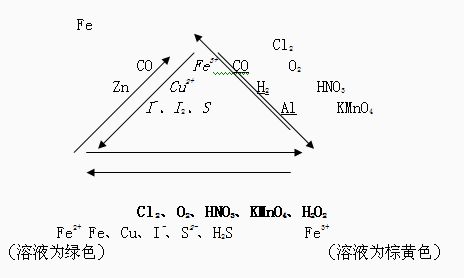
三、Fe、Fe2+和Fe3+之间相互转化及检验
从Fe、Fe2+和Fe3+的结构可知:Fe只有还原性,Fe3+通常只有氧化性,Fe2+既具有氧化性又具有还原性。上述微粒通过跟一定的氧化剂或还原剂发生氧化还原反应,才能实现不同价态的铁相互转化,如下图(常称为铁三角):
1.学习铁及其化合物的性质要注意:
(1)抓价态:从铁元素三种价态的相互转化(铁三角关系)去认识铁及其化合物间的氧化—还原反应规律.
(2)想属类:如铁是一种比较活泼的过渡金属,氧化亚铁、氧化铁为碱性氧化物,氢氧化亚铁、氢氧化铁为不溶性弱碱,氯化铁为强酸弱碱盐,由此去分析理解它们各自所具有的性质.
2.铁元素的原子在化学反应中,当遇弱氧化剂(如S、H+、Cu2+、I2等)时,铁只能失去最外层的两个电子,而生成+2价铁的化合物,当遇到强氧化剂(如Cl2、Br2、HNO3等)时,铁原子可以再失去次外层上的一个电子而生成+3价铁的化合物.
3.具体反应有:(1)Fe2+→Fe3+
①2Fe2++Cl2=2Fe3++2Cl-(在亚铁盐溶液中通入氯气,溶液由浅绿色变为棕黄色)。
②4Fe2++O2+4H+=4Fe3++2H2O(亚铁盐溶液在空气中容易变质,如绿矾露置于空气中则是:12FeSO4+3O2=4Fe2(SO4)3+2Fe2O3)
③3Fe2++NO3-+4H+=3Fe3++2H2O+NO↑
④5Fe2++MnO4-+8H+=5Fe3++4H2O+Mn2+
如在FeCl2溶液中滴加酸性KMnO4溶液,溶液由浅绿色变棕黄色,在酸性KMnO4溶液滴加FeCl2溶液,溶液由紫红变棕黄。
⑤2Fe2++H2O2+2H+=2Fe3++2H2O
(2)Fe3+→Fe2+
①2Fe3++S2+=2Fe2++S,如在FeCl3溶液中滴加适量的Na2S溶液,溶液变浑浊,滤去沉淀则滤液为浅绿色;如加入过量的Na2S溶液,,则又有黑色沉淀生成(FeS),向Fe3+溶液中通入H2S气体的离子方程式为:2Fe2++H2S=2Fe3++2H++S↓。
②2Fe3++SO32-+2H2O=2Fe2++SO42-+2H+
③2Fe3++Fe=3Fe2+,在FeSO3溶液中往往要加铁的原因是可以防止Fe2+被氧化为Fe3+。
④2Fe3++Cu=2Fe2++Cu2+,电路板的制作是利用FeCl3溶液与裸露的铜反应。
⑤2Fe3++2I-=2Fe2++I2
4.Fe2+和Fe3+的检验
(1)Fe2+的检验:
方法一:滴加KSCN溶液,无明显现象,再滴加新制氯水,溶液立即变红色。
方法二:滴加NaOH溶液,生成白色絮状沉淀,该沉淀迅速变为灰绿色,最后变为红褐色。
(2)Fe3+的检验:
方法一:滴加KSCN溶液或NH4SCN溶液,溶液立即变为血红色。
方法二:滴加NaOH溶液,出现红褐色沉淀。
1.Fe2+和Fe3+的相互转化
Fe2+有还原性,高锰酸钾、重铬酸钾、过氧化氢等氧化剂能把它氧化成Fe3+:
MnO-4+5Fe2++8H+=Mn2++5Fe3++4H2O
![]() +6Fe2++14H+=2Cr3++6Fe3++7H2O
+6Fe2++14H+=2Cr3++6Fe3++7H2O
H2O2+2Fe2++2H+=2F3++2H2O
在酸性溶液中,空气中的氧也能把Fe2+氧化:
4Fe2++O2+4H+=4Fe3++2H2O
在碱性溶液中,Fe2+的还原性更强,它能把NO-3和NO-2还原成NH3,能把Cu2+还原成金属铜.Fe3+具有氧化性,它能把I-氧化成I2:
2Fe3++2I-=2Fe2++I2
在无线电工业上,常利用FeCl3溶液来刻蚀铜,制造印刷线路,它们反应的化学方程式是:
2Fe3++Cu=2Fe2++Cu2+
因此,铜在氯化铁溶液中能作还原剂,而FeCl3是氧化剂.
Fe3+在酸性溶液中容易被H2S、SnCl2等还原成Fe2+:
2Fe3++H2S=2Fe2++S↓+2H+
2F3++Sn2+=2Fe2++Sn4+
Fe3+还能被金属铁还原:
2Fe3++Fe=3Fe2+
在亚铁盐溶液中加入铁钉可防止Fe2+被氧化为Fe3+.
2.Fe2+和Fe3+的颜色
Fe2+在水溶液中通常以水合离子[Fe(H2O)6]2+形式存在,呈淡绿色,并存在下列平衡:[Fe(H2O)6]2++H2O![]() [Fe(H2O)5OH]++H2O+
[Fe(H2O)5OH]++H2O+
这个平衡的pK=9.5,水解的程度很小,溶液近于中性.
Fe3+在酸性溶液中,通常以淡紫色的[Fe(H2O)6]3+形式存在.三氯化铁以及其他+3价铁盐溶于水后都发生显著的水解,实质是+3价水合铁离子的水解.只有在PH=0左右时,才有[Fe(H2O)6]3+存在(但由于有阴离子的存在,会生成其他的络离子,影响淡紫色的观察).当PH为2~3时,水解趋势很明显.它们的水解平衡如下:
[Fe(H2O)6]3++H2O![]() [Fe(H2O)5(OH)]2++H3O+
[Fe(H2O)5(OH)]2++H3O+
K=10-3.05
[Fe(H2O)5(OH)]2++H2O![]() [Fe(H2O)4(OH)2]++H3O+
[Fe(H2O)4(OH)2]++H3O+
K=10-3.26
生成的碱式离子呈黄色,它可聚合成二聚体:
2[Fe(H2O)6]3+![]() [Fe2(H2O)8(OH) 2]4++2H3O+
[Fe2(H2O)8(OH) 2]4++2H3O+
K=10-2.91
二聚体是借OH-为桥把2个Fe3+连结起来形成的多核络离子.溶液的PH越高,水解聚合的倾向越大,最后逐渐形成胶体,析出红综色水合氧化铁沉淀。
3.例题精讲
例1.把铜粉和过量的铁粉加入到热的浓硝酸中,充分反应后,溶液中大量存在的金属阳离子是( )
A.只有Fe2+ B.只有Fe3+
C.有Fe2+和Cu2+ D.有Fe3+和Cu2+
思路与解析:浓硝酸具有强氧化性,热的浓硝酸可将Fe和Cu分别氧化成Fe3+和Cu2+,过量的铁又与Fe2+和Cu2+反应生成Fe2+和Cu,所以充分后,溶液中大量存在的金属阳离子为Fe2+,故选A。
例2.将6g纯铁粉加入200mLFe2(SO4)3和CuSO4的混合溶液中充分反应后得到200mL0.5mol/L的FeSO4溶液和5.2g固体,求:
(1)反应后生成铜多少克?
(2)加入铁粉前Fe2(SO4)3物质的量浓度。
[思路]:在Fe2(SO4)3和CuSO4的混合溶液中投入铁粉后,Fe3+和Cu2+均可与铁发生反应,但由于氧化性Fe3+>Cu2+,所以Fe应首先还原Fe3+,即首先发生反应:Fe+2Fe3+=3Fe2+,但不可以只发生此反应,原因有二:第一是若只发生此反应则说明铁粉较少,已完全反应无剩余,则不可能有5.2g不溶物;第二,若只发生此反应可依此反应计算出生成的FeSO4为(6g÷56g/mol)×3=0.32mol>0.1mol。通过以上分析,可以看出,Fe在把全部的Fe3+还原后,不发生了还原Cu2+的反应,此时的Fe是否有剩余呢?也就是余5.2g固体中肯定有Cu,是否含Fe呢?这就是此题的关键所在,需通过计算推导确定。
[解析]:发生反应的化学方程式为:
①Fe+Fe2(SO4)3=3FeSO4 ②Fe+CuSO4=Cu+FeSO4
两个反应共生成FeSO4为:0.2L×0.5mol/L=0.1mol
观察两个反应不难发现,若生成同样的FeSO4,②式消耗的铁更多。假设0.1molFeSO4全部为②式产生,则此时消耗的铁将达最大量为a。
Fe ~ FeSO4
1mol 1mol
a 0.1mol
a=0.1mol,即铁为5.6g,则5.2g固体中含Cu也含剩余的Fe,设原溶液的Fe2(SO4)3和CuSO4的物质的量分别为x和y。
Fe+Fe2(SO4)3=3FeSO4 Fe+CuSO4=Cu+FeSO4
X x 3x y y y y
由题意得 3x+y=0.1mol
![]() 6g-56g/mol×(x+y)+64g/mol×y=5.2g
6g-56g/mol×(x+y)+64g/mol×y=5.2g
解得:x=0.02mol y=0.04mol
则生成铜:0.04mol×64g/mol=2.56g
原Fe2(SO4)3和物质的量浓度为0.02mol/0.2L=0.1mol/L
例3.mg 铁粉与一定量的HNO3在一定条件下充分反应,将生成的气体与标准状况nL氧气混合,恰好能被水完全吸收,m和n的关系是什么?
[思路]此题看起来,涉及的化学反应相当复杂,因HNO3的浓度和用量不同,生成Fe(NO3)3还是Fe(NO3)2不能确定,HNO3的还原产物是NO还是NO2也不能确定。所以消耗的氧气也无从下手求出.但是从始态和终态来看,HNO3的还原产物与氧气混合后,最终还是生成HNO3,这样消耗的氧气相当于把mg铁粉氧化成+2价或+3价化合物,用极端思考法很容易求出。
[解析]:假设HNO3为稀的,铁与HNO3反应后的价态是+2,
则有: 3 Fe +8 HNO3= 3 Fe(NO3)2 + 2 NO↑+ 4 H2O (1)
4NO +3O2 +2H2O=4HNO3 (2)
(1)×2 +(2)得:2Fe + O2 +4HNO3= 2Fe(NO3)2 +2H2O
可改写为 : 2Fe + O2 +4HNO3 = 2FeO + 4HNO3
即: 2Fe + O2 =2FeO
同理可得 : 4Fe +3O2=2Fe2O3 问题便得以解决
即 :当铁被氧化为+2价时,由电子得失守衡得:
m/56×2=n/22.4×4 n=O.2m
当铁被氧化为=+3价时,由电子得失守衡得:
m/56×3=n/22.4×4 n=O.3m
则m与n的关系是:O.2m≤n≤O.3m
[小结]此题在解题过程中,巧妙得使用了始态和终态,使复杂的问题简单化。氧化还原反应中,电子得失守衡的使用,避免了繁琐的计算,在应试中赢得了时间,思维训练方面堪称是一道好题。
例4.由FeO、Fe2O3和Fe3O4组成的混合物,测得其中铁元素与氧元素的质量比为21:8,,则这种混合物中FeO、Fe2O3和Fe3O4的物质的量之比是( )。
A.1:2:1 B. 2:1:1 C. 1:1:1 D. 1:1:3
[思路]:可用平均组成法来求解:
[解析]在混合物中Fe原子和氧原子物质的量之比为(21/56):(8/16)=3:4,则混合物的平均组成为Fe3O4,在三种组合中Fe3O4则不必多考虑,应注意FeO和Fe2O3混合后也应符合Fe3O4,所以在混合物中它们的物质的量之比必需是1:1.故答案应选C、D。
例5.某铁的“氧化物”样品,用5mol/L的盐酸140mL恰好完全溶解,所得溶液还能吸收标准状况下0.56L氯气,使其中Fe2+全部转化为Fe3+。该样品可能的化学式是 ( )
A. Fe2O3 B. Fe3O4 C. Fe4O5 D. Fe5O7
[思路]:利用正、负电荷相等列方程可快速解题。
[解析]设铁的氧化物中含O2-为xmol,则其化学式为FexOy,由O2-个数守恒有:
2yH++ FexOy = yH2O+ xFe+(2y/x)
2ymol ymol
0.7mol amol
2y:y=0.7:a a=0.35(mol)
设FexOy中含Fe2+bmol,则:
2Fe2++ Cl2 = Fe3++ 2Cl-
2mol 22.4L
bmol 0.56L
2:b=22.4:0.56 b=0.05(mol)
设样品FexOy中含Fe3+为cmol,则由电荷守恒可得:
(2×0.05mol)×3cmol=2×0.35mol
解之得c=0.2mol
故样品FexOy中:x:y=(0.05+0.02):0.35=5:7
即样品“氧化铁”化学式为:Fe5O7。
例6:试样x由氧化亚铁和氧化铜组成.取质量相等的两份试样,按下图所示进行实验.
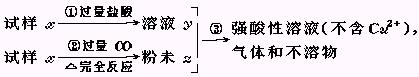
(1)请写出步骤③中所发生的全部反应的离子方程式.
(2)若全部的溶液y和全部的粉末Z充分反应后,生成的不溶物的质量是m,则每份试样x中氧化铜的质量为 (用m表示).
[思路]:本题第一问比较简单.发生的反应为:Fe+Cu2+=Fe2++Cu,Fe+2H+=Fe2++H2↑
第二问是考查思维的严密性和敏捷性.由题意,反应后溶液中不含Cu2+,所以两份试样中的铜元素全部转化为单质铜,而溶液是强酸性,则固体物中无Fe,所以m为铜的质量.故一份试样中氧化铜的质量为![]() ×MCuO=
×MCuO=![]() m=
m=![]() m.
m.
[解析]:(1)Fe+Cu2+=Fe2++Cu Fe+2H+=Fe2+H2↑
(2) ![]() m
m
例7.在下列所指的各溶液中,分别滴加NH4SCN溶液后,溶液不呈血红色的是 ( )。
A.加入足量镁粉的Fe2(SO4)3溶液
B.加入过量铁粉的稀硝酸溶液
C.铁丝在足量的氯气中燃烧后,所得产物的溶液
D.长期暴露在空气中的绿矾溶液
[思路]:实验室鉴定Fe3+的方法是利用KSCN溶液,它们相遇会呈血红色,若利用NH4SCN溶液,实质是一样的:
Fe3++SCN-=[Fe(SCN)]2+
Fe3+可以结合1~6个SCN-,产物皆为血红色。
A.足量的镁粉可以使Fe3+转化为Fe2+或Fe,因为反应后不再有Fe3+,所以加入SCN-后,不会出现血红色。
B.过量的铁与稀硝酸进行如下反应:Fe+4HNO3=Fe(NO3)3+NO↑+H2O 2Fe3++Fe=3Fe2+,因为反应后无Fe3+,所以加入SCN-后,也不会出现血红色。
C.Fe在Cl2中燃烧的产物是FeCl3,它的水溶液中存在着大量的Fe3+,所以加入SCN-后,会出现血红色。
D.FeSO4溶液中的Fe2+因暴露在空气中会被空气中的氧气氧化成Fe3+:4FeSO4+O2+2H2SO4=2Fe2(SO4)3+2H2O,所以加入SCN-后,会出现血红色。
[解析]:选A、B。
例8.将8gFe2O3投入150mL某浓度的稀硫酸中,再投入7g铁粉收集到1.68LH2(标准状况),同时,Fe和Fe2O3均无剩余,为了中和过量的硫酸,且使溶液中铁元素完全沉淀,共消耗4mol/L的NaOH溶液150mL。则原硫酸的物质的量浓度为 ( )。
A.1.5mol/L B.0.5mol/L
C.2mol/L D.1.2mol/L
[思路]:粗看题目,这是一利用关系式进行多步计算的题目,操作起来相当繁琐,但如能仔细阅读题目,挖掘出隐蔽条件,不难发现,反应后只有Na2SO4存在于溶液中,且反应过程中SO42-并无损耗,根据Na+守恒,非常易求得SO42-即原硫酸的物质的量浓度为:2mol/L,故选C。
例9.金属铜能被FeCl3的浓溶液腐蚀,其化学反应是:Cu+2FeCl3=2FeCl2+CuCl2。现将有铜的印刷线路板浸入120mLFeCl3的浓溶液中,有9.6gCu被腐蚀掉。取出印刷线路板,向溶液中加入8.4g铁粉,经充分反应,溶液中还存在4.8g不溶物。则:
(1)溶液中存在那些离子?
(2)离子的浓度各是多少?(设溶液体积不变)
[思路]:存在的不溶物有两种可能:一可能是铁、铜混合物,二可能只是铁。若为铁、铜混合物,则溶液中的Cu2+必然全部析出,即不溶物的质量大于9.6g,显然错误,故不溶物为Cu。
[解析]:(1)溶液中存在的离子为:Fe2+、Cu2+、Cl-。
(2)溶液中n(Cu2+)=(9.6g-4.8g)÷64g/mol=0.075mol
Cu2+的物质的量浓度为:0.075mol÷0.12L=0.625mol/L
设被还原的Fe3+的物质的量为x:
根据Fe3+得电子数与Fe、Cu失电子数相等,列式为:
x×1=(8.4g÷56g/mol)×2+0.075mol×2=0.45mol
溶液中n(Fe3+)=8.4g÷56g/mol+0.45mol=0.6mol
Fe2+的物质的量浓度为:0.6mol÷1.2L=5mol/L
Cl+的物质的量浓度为:0.625mol/L×2+5mol/L×2=11.25mol/L。
例10:氯化铜(CuCl2·2H2O)中含FeCl2杂质.为制得纯净氯化铜晶体,首先将其制成水溶液,然后按下面所示操作步骤进行提纯.
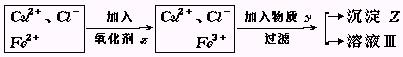
↓蒸发结晶
CuCl2·2H2O(纯)
(1)加入氧化剂X的目的是
(2)下列氧化剂中最适合本实验的是
A.H2O2 B.KMnO4 C.NaClO D.K2Cr2O7
(3)物质Y和沉淀Z的化学式分别是 和 .
(已知完全成氢氧化物所需PH值:Fe3+为3.7,Cu2+为6.4,Fe2+为9.6.)
[思路]:本题是对一个实验问题进行理论分析.
解答本题的关键是理解题中提供的一条中学未曾接触的信息的含意.由于Fe2+沉淀为Fe(OH)2的PH值与Cu2+沉淀为Cu(OH)2的PH较大,而与Fe3+沉淀为Fe(OH)3的PH相差较大,所以可以通过先将Fe2+氧化为Fe3+,再调节溶液的PH使铁以Fe(OH)3沉淀形式而被除去.为了使加入的氧化剂不带入新的杂质,显然用H2O2最好.出于同样的考虑,加入y调节溶液PH值时,应选用能与H+反应,而溶解度较小的物质如CuO为好,CuO稍多不会带入新杂质也不会使PH值升高太多而使Cu2+沉淀.
[解析]:(1)使溶液A中的Fe2+氧化成Fe3+; (2)A (3)Y:CuO或Cu(OH)2 Z:Fe(OH)3
例11:向含有0.8mol的稀硝酸溶液中慢慢加入22.4g的铁粉.假设反应分为两个阶段.第一阶段为:Fe+HNO3![]() Fe(NO3)3+NO↑+H2O
Fe(NO3)3+NO↑+H2O
(1)写出这两个阶段反应的离子方程式.
(2)求这两个阶段反应中,加入铁粉的物质的量和溶液中铁元素存在的形式.
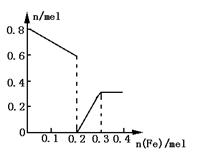
(3)在图中画出溶液中Fe2+、![]() 离子的物质的量随加入铁粉的物质的量变化的关系图像(纵坐标是溶液中离子的物质的量).
离子的物质的量随加入铁粉的物质的量变化的关系图像(纵坐标是溶液中离子的物质的量).
分析:铁与稀硝酸反应规律
①Fe+4HNO3![]() Fe(NO3)3+NO↑+2H2O
Fe(NO3)3+NO↑+2H2O
②3Fe+8HNO3![]() 3Fe(NO3)2+2NO↑+4H2O
3Fe(NO3)2+2NO↑+4H2O
(1)当![]() ≤
≤![]() 时,按反应①进行;
时,按反应①进行;
当![]() ≥
≥![]() 时,按反应②进行.
时,按反应②进行.
当![]() ≤
≤![]() ≤
≤![]() 时,则①②两反应都发生,且Fe、HNO3均反应完全.
时,则①②两反应都发生,且Fe、HNO3均反应完全.
(2)上述反应可以认为先发生反应①,若Fe有剩余则发生2Fe(NO3)3+Fe![]() 3Fe(NO3)2.
3Fe(NO3)2.
答案为:
(1)Fe+4H++![]()
![]() Fe3++NO↑+2H2O
Fe3++NO↑+2H2O
2Fe3++Fe![]() 3Fe2+.
3Fe2+.
(2)①加入Fe粉为0~0.2mol时,存在形式为Fe3+.
②加入铁粉为0.2~0.3mol时,存在形式为Fe2+和Fe3+
③加Fe粉为n(Fe)≥0.3mol时,存在形式为Fe2+.
(3)如下图.
4.实战演练
一、选择题
1.(2002年全国高考题)铁屑溶于过量的稀硫酸,过滤后向滤液中加入适量硝酸,再加入过量的氨水,有红褐色沉淀生成。过滤,加热沉淀物至质量不再发生变化,得到红棕色的残渣。上述沉淀和残渣分别为
A.Fe(OH)3;Fe2O3 B.Fe(OH)2;FeO
C.Fe(OH)2、Fe(OH)3;Fe3O4 D.Fe2O3;Fe(OH)3
2.要证明某溶液中不含Fe3+而可能含有Fe2+进行如下实验操作时最佳顺序为
①加入足量氯水 ②加入足量KMnO4溶液 ③加入少量NH4SCN溶液
A.①③ B.③②
C.③① D.①②③
3.在氯化铁、氯化铜和盐酸混合液中加入铁粉,待反应结束,所剩余的固体滤出后能被磁铁吸引,则反应后溶液中存在较多的阳离子是
A.Cu2+ B.Fe3+
C.Fe2+ D.H+
4.在FeCl3,CuCl2,FeCl2的混合溶液中,Fe3+,Cu2+和Fe2+的物质的量之比为3∶2∶1,现加入适量铁粉,使溶液中三种离子物质的量浓度之比变化为1∶2∶4,则参加反应的铁粉与原溶液Fe3+的物质的量之比为
A.2∶1 B.1∶2
C.1∶3 D.1∶4
5.在浓度均为3 mol·L-1的盐酸和硫酸各100 mL中,分别加入等质量的铁粉,反应完毕后生成气体的质量比为3∶4,则加入铁粉的质量为
A.5.6 g B.8.4 g
C.11.2 g D.1.8 g
6.把a g铁铝合金粉末溶于足量盐酸中,加入过量NaOH溶液。过滤出沉淀,经洗涤、干燥、灼烧,得到的红色粉末的质量仍为a g,则原合金中铁的质量分数为
A.70% B.52.4%
C.47.6% D.30%
7.制印刷电路时常用氯化铁溶液作为“腐蚀液”,发生的反应为2FeCl3+Cu===2FeCl2+CuCl2。向盛有氯化铁溶液的烧杯中同时加入铁粉和铜粉,反应结束后,下列结果不可能出现的是
A.烧杯中有铜无铁 B.烧杯中有铁无铜
C.烧杯中铁、铜都有 D.烧杯中铁、铜都无
8.某溶液中含有大量的Fe2+、Fe3+、Mg2+和NH![]() ,其c(H+)=10-2 mol·L-1,在该溶液中可以大量存在的阴离子是
,其c(H+)=10-2 mol·L-1,在该溶液中可以大量存在的阴离子是
A.SO![]() B.NO
B.NO![]()
C.SCN- D.CO![]()
9.某强酸性溶液中可能存在NO![]() 、Cl-、I-、Fe3+中的一种或几种。向该溶液中加入溴水,单质溴被还原,由此推断溶液中
、Cl-、I-、Fe3+中的一种或几种。向该溶液中加入溴水,单质溴被还原,由此推断溶液中
A.不含NO![]() 、也不含Fe3+
、也不含Fe3+
B.含有NO![]() 、I-、Cl-
、I-、Cl-
C.含I-,但不能确定是否含Cl-
D.含有Fe3+
10.用足量的稀硫酸溶解FeS和Fe(OH)3的混合物28.3 g,最终得到沉淀1.6 g,则原混合物中FeS的质量可能是
A.4.4 g B.7.8 g
C.13.5 g D.17.6 g
二、非选择题(共50分)
11.(6分)在烧制砖瓦时,用粘土做成的坯经过烘烧后,铁的化合物转化成 而制得红色砖瓦。若烘烧后期从窑顶向下慢慢浇水,窑内会产生大量的 气体,它们把该红色物质还原成的黑色化合物是 ,同时还有未烧的碳颗粒,而制得了青色砖瓦。
12.(6分)有关物质间有下图所示的转化关系。其中:A的浓溶液与单质B在加热时才发生反应①;A的稀溶液与足量B发生反应②。据此填写下列空白:
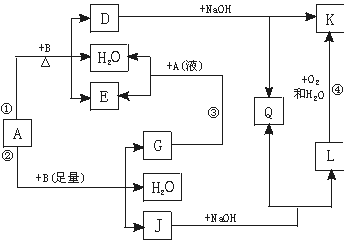
(1)反应④的现象是 。
(2)写出反应②的离子方程式 。
(3)根据题示信息判断,A的浓溶液和单质B加热时能否产生G,说明理由(写出化学方程式回答): 。
13.(6分)室温下,单质A、B、C分别为固体、黄绿色气体、无色气体,在合适反应条件下,它们可以按下图进行反应。又知E溶液是无色的,请回答:
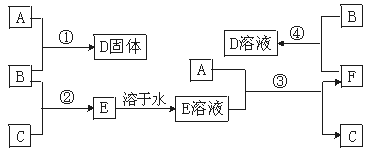
反应流程
(1)A是 ,B是 ,C是 。(请填化学式)
(2)反应①的化学方程式为: 。
(3)反应③的化学方程式为: 。
(4)反应④的化学方程式为: 。
14.(10分)A、B、C、D、E分别是铁的单质或铁的化合物。其相互反应关系如下图所示:
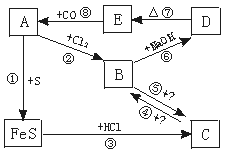
根据上图所示变化,要求回答:
(1)推断A、B、C、D、E各是什么物质
A 、B 、C 、D 、E ;
(2)写出各步反应的化学方程式:
① ;
② ;
③ ;
④ ;
⑤ ;
⑥ ;
⑦ ;
⑧ 。
15.(10分)将一生锈的铁片置于稀HNO3中充分反应后,共收集到11.2 L(标准状况)NO气体,溶液中还剩余5 g固体残渣,在过滤后的滤液中通入35.5 g氯气,恰好使溶液中的Fe2+全部氧化。求原带锈铁片的质量和铁锈的质量分数(铁锈成分以Fe2O3计)。
16.(12分)(2001年全国高考卷)已知Fe2O3在高炉中有下列反应:
Fe2O3+CO![]() 2FeO+CO2
2FeO+CO2
反应形成的固体混合物(含Fe2O3和FeO)中,元素铁和氧的质量比用m(Fe)∶m(O)表示。
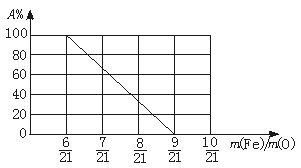
(1)上述固体混合物中,m(Fe)∶m(O)不可能是 (选填a、b、c多选扣1分)。
a.21∶9 b.21∶7.5 c.21∶6
(2)若m(Fe)∶m(O)=21∶8,计算Fe2O3被CO还原的百分率。
(3)设Fe2O3被CO还原的百分率为A%,则A%和混合物中m(Fe)∶m(O)的关系式为[用含m(Fe)、m(O)的代数式表示]A%= 。
请在下图中画出A%和m(Fe)∶m(O)关系的图形。
(4)如果Fe2O3和CO的反应分两步进行:3Fe2O3+CO![]() 2Fe3O4+CO2 Fe3O4+CO
2Fe3O4+CO2 Fe3O4+CO![]() 3FeO+CO2,试分析反应形成的固体混合物可能的组成及相应的m(Fe)∶m(O)[令m(Fe)∶m(O)=21∶a,写出a的取值范围]。将结果填入下表。
3FeO+CO2,试分析反应形成的固体混合物可能的组成及相应的m(Fe)∶m(O)[令m(Fe)∶m(O)=21∶a,写出a的取值范围]。将结果填入下表。
混合物组成(用化学式表示) |
a的取值范围 |
附参考答案
一、1.解析:Fe![]() Fe2+
Fe2+![]() Fe3+
Fe3+![]() Fe(OH)3
Fe(OH)3![]() Fe2O3。
Fe2O3。
答案:A
2.B 3.C
4.解析:根据2Fe3++Fe===3Fe2+知,消耗1 mol Fe生成3 mol Fe2+,还消耗2 mol Fe3+。
答案:C
5.C 6.A 7.B 8.A 9.C 10.AD
二、11.Fe2O3 CO和H2 Fe3O4、FeO
12.(1)白色沉淀![]() 灰绿色
灰绿色![]() 红褐色沉淀
红褐色沉淀
(2)3Fe+2NO![]() +8H+===3Fe2++2NO↑+4H2O
+8H+===3Fe2++2NO↑+4H2O
(3)由反应2HNO3+NO===3NO2+H2O知,在浓HNO3中不可能生成NO
13.(1)Fe Cl2 H2
(2)2Fe+3Cl2![]() 2FeCl3
2FeCl3
(3)2HCl+Fe===FeCl2+H2↑
(4)2FeCl2+Cl2===2FeCl3
14.(1)Fe FeCl3 FeCl2 Fe(OH)3 Fe2O3 (2)略
15.65 g 20.5%
16.(1)ac
(2)设Fe2O3原有n0 mol,还原百分率为A%,则有
![]()
A%=![]() ≈33.3%
≈33.3%
(3)3-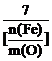
(4)Fe2O3、Fe3O4 8<a<9
Fe3O4、FeO 6<a<8
Fe2O3、Fe3O4、FeO 6<a<9