
金属的冶炼
1.复习重点
1.金属冶炼的化学原理和金属冶炼的基本方法;
2.金属回收及资源保护的重要作用,
3.重点是考查金属冶炼的基本方法。
2.难点聚焦
一、 金属在自然界中的存在形式:
1. 游离态
化学性质不活泼的金属,在自然界中能以游离态的形式存在,如:Au Ag Pt Cu
2. 化合态
化学性质比较活泼的金属,在自然界中能以化合态的形式存在,如: Al Na
说明: 少数金属在自然界中能以游离态的形式存在; 而大多数的金属在自然界中能以化合态的形式存在.
二、 金属的冶炼:
1. 金属冶炼的实质
用还原的方法,使金属化合物中的金属阳离子得电子变成金属原子.
Mn+ + ne-→M
2. 金属冶炼的主要步骤:
① 矿石的富集
目的:除去杂质,提高矿石右的有用成分的含量;
② 冶炼
目的:得到金属单质.
原理:利用氧化还原反应原理,在一定条件下,用还原剂把金属矿石中的金属离子还原成金属单质.
③ 精炼
目的:提高金属的纯度.
3. 金属冶炼的一般方法:
根据金属的活泼性.
(1)热分解法:适用范围:不活泼金属 Ag----Au
如: 2Ag2O==4Ag + O2↑2HgO==2Hg + O2↑
(2)还原法:适用范围:较活泼的金属 Zn----Cu
如: Fe2O3 + 3CO ==2Fe + 3CO2Cr2O3+2Al ==2Cr +Al2O3
常用的还原剂:C 、CO、 H2 和活泼金属如铝等.
说明铝热反应也属于热还原法.
[思考]对于极活泼金属的冶炼,能否用热还原法?如不能则应使用什么方法?
3.电解法:
适用范围:活泼的金属 K----- Al
如: 2Al2O3 ==== 4Al + 3O2↑ 2NaCl===2Na +Cl2↑ 比较: 2NaCl+2H2O===2NaOH +H2↑+Cl2↑2CuSO4+2H2O===2Cu+2H2SO4+O2↑
电解法也常用于某些不活泼的金属的精炼.
[说明]电解法的缺点是要消耗大量的电能,成本较高.
三、 金属的回收与环境、资源保护
1. 金属回收的意义
(1)节约矿物资源;(2)节约能源;(3)减少环境污染.
2. 回收废金属的利用.
大部分可以重新制成金属及化合物再用.
实例:
废铁屑可以铁盐或亚铁盐,如绿矾,废旧钢铁可以炼钢.
从电解精炼铜的阳极泥中可以回收金银等贵重金属
从定影液中可以回收金属银.
小结:金属的活动性顺序与金属的冶炼方法.
3.例题精讲
例1 不太活泼的金属元素硝酸盐在受热分解时金属元素将转变为其氧化物或单质。在通风橱中给盛有少量硝酸汞固体的试管加热,最后试管中( )
A、留下银白色的液体
B、留下少量白色硝酸汞固体
C、留下红色氧化汞固体
D、无剩余物
例2 冶炼金属一般有下列四种方法:①焦炭法;②水煤气(或氢气,或一氧化碳)法;③活泼金属置换法;④电解法。四种方法在工业上均有应用。古代有(Ⅰ)火烧孔雀石炼铜;(Ⅱ)湿法炼铜;(Ⅲ)铝热法炼铬;(Ⅳ)从光卤石中炼镁,对它们的冶炼方法的分析不正确的是( )
A.(Ⅰ)用① B.Ⅱ用② C.Ⅲ用③ D.Ⅳ用④
解析:金属冶炼的方法与金属在自然界中存在的状态、金属活动性有关。一般电解法适合冶炼金属性强的金属(金属活动顺序表Al以前);而水煤气(H2、CO)法、焦炭法、活泼金属置换法等用还原剂还原金属法,适合于金属活动性介于Zn~Cu之间的大多数金属的冶炼。

对于(Ⅱ) Fe + CuSO4 = FeSO4 + Cu 符合③

故本题答案为B
例3用氧化铝、二氧化锰作为原料,如何制取金属锰?写出反应的化学方程式。
2Al2O3====4Al+3O2↑
3MnO2+ 4Al == 3Mn+2Al2O3
例4根据下图所示实验室用一氧化碳还原氧化铁的实验装置,回答以下问题:
①反应过程中发生的现象是: 玻璃管里粉末由红棕色逐渐变黑,B中溶液出现浑浊。
②塑料袋的作用是 收集未反应完的CO,以防中毒。

4.实战演练
一、选择题
1.冶炼金属一般有下列4种方法:①焦炭法;②水煤气法(或氢气、或一氧化碳)法;③活泼金属置换法;④电解法。4种方法在工业上均有应用。古代有(Ⅰ)火烧孔雀石炼铜;(Ⅱ)湿法炼铜。现代有(Ⅲ)铝热法炼铬;(Ⅳ)从光卤石中炼镁。对它们的冶炼方法的分析不正确的是
A.(Ⅰ)用① B.(Ⅱ)用②
C.(Ⅲ)用③ D.(Ⅳ)用④
2.下列物质的反应,不能置换出Fe的是
A.FeO+C B.Fe2O3+CO
C.Al+Fe3O4 D.Cu+FeCl3
3.在高温下,用CO还原m g Fe2O3,得n g Fe,已知氧的相对原子质量为16,则Fe的相对原子质量为
A.![]() B.
B.![]()
C.![]() D.
D.![]()
4.有0.4 g铁的氧化物,用足量的CO在高温下将其还原,把生成的全部CO2通入足量澄清石灰水中,得到0.75 g固体沉淀物。这种铁的氧化物的化学式为
A.FeO B.Fe2O3
C.Fe3O4 D.FeO、Fe2O3
5.在炼铁、炼钢过程中都有碳参加反应,下列有关碳参加反应的叙述错误的是
A.两个过程中碳原子都是被氧化,都只起着提供热源的作用
B.炼铁过程中碳被氧化,既起产生热量的作用,又起产生CO的作用
C.炼钢过程中碳被氧化,从而达到降低含碳量的目的
D.炼铁过程中碳参加反应,只起着产生CO的作用
6.下列反应中,氧化剂与还原剂之比是1∶3的是
A.FeO+Si![]() Fe+SiO2 B.Fe2O3+CO
Fe+SiO2 B.Fe2O3+CO![]() Fe+CO2
Fe+CO2
C.Fe3++Fe![]() Fe2+ D.Cu+H2SO4(浓)
Fe2+ D.Cu+H2SO4(浓)![]() CuSO4+SO2↑+H2O
CuSO4+SO2↑+H2O
7.合金具有许多特点,如Na-K合金为液体,而Na和K的单质均为固体。据此,试推测:生铁、纯铁、碳3种物质中,熔点最低的是
A.纯铁 B.生铁
C.碳 D.无法确定
8.我国的稀土矿含量丰富,稀土元素可用RE表示。在提纯过程中可以向稀土元素的硫酸盐溶液中加入粉状Na2SO4,使稀土元素转化为沉淀,反应为:
RE2(SO4)3+Na2SO4+xH2O![]() RE2(SO4)3·Na2SO4·xH2O(x=1,2)下列有关叙述正确的是
RE2(SO4)3·Na2SO4·xH2O(x=1,2)下列有关叙述正确的是
A.该反应一定在强碱溶液中进行
B.产生沉淀的反应为复分解反应
C.反应生成的沉淀属于复盐
D.产生沉淀的变化属于化学变化
9.下列叙述正确的是
A.含金属元素的离子不一定是阳离子
B.在氧化还原反应中,非金属单质一定是氧化剂
C.某元素从化合态变为游离态时,该元素一定被还原
D.金属阳离子被还原不一定得到金属单质
10.质量相等的CaO2和CaO两份样品,前者与后者所含氯元素的质量比是
A.2∶1 B.7∶9
C.14∶9 D.9∶7
二、非选择题(50分)
11.(8分)制FeO常用下法:
FeC2O4![]() FeO+CO↑+CO2↑
FeO+CO↑+CO2↑
试说明不采用FeCO3加热分解制FeO而用此法制FeO的原因。
12.(12分)(1996年全国高考题)在一定条件下用普通铁粉和水蒸气反应,可以得到铁的氧化物。该氧化物又可以经过此反应的逆反应,生成颗粒很细的铁粉。这种铁粉具有很高的反应活性,在空气中受撞击或受热时会燃烧,所以俗称“引火铁”。请分别用图中示意的两套仪器装置,制取上述铁的氧化物和“引火铁”。实验中必须使用普通铁粉和6 mol·L-1盐酸,其他试剂自选(装置中必要的铁架台、铁夹、铁圈、石棉网、加热设备等在图中均已略去)。
填写下列空白:
(1)实验进行时试管A中应加入的试剂是 ;
烧瓶B的作用是 ;
烧瓶C的作用是 ;
在试管D中收集得到的是 。
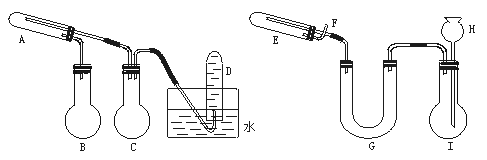
(2)实验时,U型管G中应加入的试剂是 ;长颈漏斗H中应加入 。
(3)两套装置中,在实验时需要加热的仪器是(填该仪器对应的字母) 。
(4)烧瓶Ⅰ中发生的反应有时要加入少量硫酸铜溶液,其目的是 。
(5)试管E中发生反应的化学方程式是 。
(6)为了安全,在E管中的反应发生前,在F出口处必须 ;E管中的反应开始后,在F出口处应 。
13.(12分)下图是一个实验示意图,方框表示有关的仪器,箭头表示液体或气体的流向
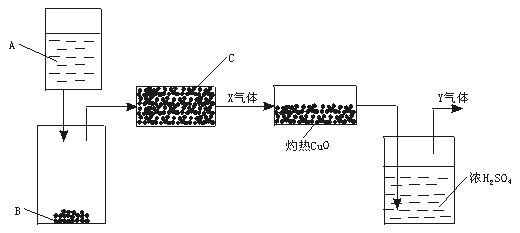
图中A是液体,B、C是固体。A与B反应后产生的气体经过C,得到纯气体X。X通过灼热CuO,CuO转化为Cu。气体再通过浓H2SO4,最后得到纯气体Y,Y是对环境没有污染的气体,大量排放也没有危险。为进行以上实验,请从下列试剂范围内选择合适的A、B和C:浓硫酸、稀硫酸、浓硝酸、稀硝酸、浓盐酸、稀盐酸、锌粒、浓NaOH溶液、大理石、碱石灰、NH4Cl固体。
(1)A是 ,B是 ,C是 ,X是 。
(2)写出A和B,X和CuO反应的化学方程式 。
14.(8分)为测定一种复合氧化物型的磁性粉末材料的组成,称取12.52 g样品,将其全部溶于过量稀硝酸后,配成100 mL溶液。取其一半,加入过量K2SO4溶液,生成白色沉淀,经过滤、洗涤、烘干后得4.66 g固体。在余下的50 mL溶液中加入少许KSCN溶液,显红色;如果加入过量NaOH溶液,则生成红褐色沉淀,将沉淀过滤、洗涤、灼烧后得3.20 g固体。
(1)计算磁性粉末材料中氧元素的质量分数。
(2)确定该材料的化学式。
15.(10分)有CuO和木炭粉的混合物4.24 g,在高温条件下充分反应后,剩余固体混合物呈红色,质量为3.36 g;若反应产生的气体能全部被过量的澄清石灰水吸收,得沉淀2 g,试通过计算指出所得固体产物的组成及质量分数。
附参考答案
一、1.B 2.D 3.D
4.解析:FexOy+yCO![]() xFe+yCO2
xFe+yCO2
(56x+16y) g y mol
0.4 g ![]() mol
mol
得:x∶y=2∶3
答案:B
5.AD 6.B 7.B 8.CD
9.解析:A.如AlO![]() B.如C+FeO
B.如C+FeO![]() CO↑+Fe C.如Br-
CO↑+Fe C.如Br-![]() Br2 D.如Fe3+
Br2 D.如Fe3+![]() Fe2+
Fe2+
答案:AD
10.C
二、11.FeCO3在空气中加热,因+2价铁被空气氧化而得不到FeO;而FeC2O4分解,产生的CO可作保护气,防止FeO氧化。
12.(1)普通铁粉(或铁粉) 作为水蒸气发生器(或用来产生水蒸气) 防止水倒吸(或用作安全瓶) 氢气
(2)固体NaOH(或碱石灰、CaO等碱性固体干燥剂) 6摩/升HCl
注:G中如填写酸性干燥剂或液体干燥剂,则此空不给分。
(3)ABE (必须全对给一分,错、漏一个即不给分)
(4)加快氢气产生的速度
(5)Fe3O4+4H2![]() 3Fe+4H2O
3Fe+4H2O
(6)检验氢气的纯度 点燃氢气
13.(1)A.浓NaOH溶液 B.NH4Cl固体 C.碱石灰 X:NH3
(2)NaOH+NH4Cl![]() NaCl+NH3↑+H2O 2NH3+3CuO
NaCl+NH3↑+H2O 2NH3+3CuO![]() 3Cu+N2↑+3H2O
3Cu+N2↑+3H2O
14.(1)20.4% (2)BaO·Fe2O3
15.Cu2O和Cu w(Cu2O)=42.9% w(Cu)=57.1%