碱金属元素
1. 复习重点
碱金属元素的原子结构及物理性质比较,碱金属的化学性质,焰色反应实验的操作步骤;
原子的核外电子排布碱金属元素相似性递变性
2.难点聚焦
(1)碱金属元素单质的化学性质:
1)相似性:碱金属元素在结构上的相似性,决定了锂、钠、钾、铷、铯在性质上的相似性,碱金属都是强还原剂,性质活泼。具体表现在都能与![]() 、
、![]() 、水、稀酸溶液反应,生成含
、水、稀酸溶液反应,生成含![]() (
(![]() 为碱金属)的离子化合物;他们的氧化物对应水化物均是强碱;
为碱金属)的离子化合物;他们的氧化物对应水化物均是强碱;
2)递变性:随着原子序数的增加,电子层数递增,原子半径渐大,失电子渐易,还原性渐强,又决定了他们在性质上的递变性。具体表现为:①与![]() 反应越来越剧烈,产物越来越复杂,②与
反应越来越剧烈,产物越来越复杂,②与![]() 反应越来越剧烈,③随着核电荷数的增强,其最高价氧化物对应的水化物的碱性增强:
反应越来越剧烈,③随着核电荷数的增强,其最高价氧化物对应的水化物的碱性增强:![]() ;
;
(2)实验是如何保存锂、钠、钾:均是活泼的金属,极易氧化变质甚至引起燃烧,它们又都能与水、水溶液、醇溶液等发生反应产生氢气,是易燃易爆物质,存放它们要保证不与空气、水分接触;又因为它们的密度小,所以锂只能保存在液体石蜡或封存在固体石蜡中,而将钠、钾保存在煤油中;
(3)碱金属的制取:金属![]() 和
和![]() 主要是用电解熔融氯化物的方法制取;金属
主要是用电解熔融氯化物的方法制取;金属![]() 因为易溶于盐不易分离,且电解时有副反应发生,故一般采用热还原法用
因为易溶于盐不易分离,且电解时有副反应发生,故一般采用热还原法用![]() 从熔融
从熔融![]() 中把
中把![]() 置换出来(不是普通的置换,而是采用置换加抽取的方法,属于反应平衡);铷和铯一般也采用活泼金属还原法制取。
置换出来(不是普通的置换,而是采用置换加抽取的方法,属于反应平衡);铷和铯一般也采用活泼金属还原法制取。
(4).焰色反应操作的注意事项有哪些?
(1)所用火焰本身的颜色要浅,以免干扰观察.
(2)蘸取待测物的金属丝本身在火焰上灼烧时应无颜色,同时熔点要高,不易被氧化.用铂丝效果最好,也可用铁丝、镍丝、钨丝等来代替铂丝.但不能用铜丝,因为它在灼烧时有绿色火焰产生.
(3)金属丝在使用前要用稀盐酸将其表面的氧化物洗净,然后在火焰上灼烧至无色,以除去能起焰色反应的少量杂质.
(4)观察钾的焰色时,要透过蓝色的钴玻璃片,因为钾中常混有钠的化合物杂质,蓝色钴玻璃可以滤去黄色火焰,以看清钾的紫色火焰.
3. 例题精讲
例1 已知相对原子质量:![]() 6.9,
6.9,![]() 23,
23,![]() 39,
39,![]() 85。今有某碱金属M及其氧化物
85。今有某碱金属M及其氧化物![]() 组成的混合物10.8 g,加足量水充分反应后,溶液经蒸发和干燥得固体16 g,据此可确定碱金属M是[
]
组成的混合物10.8 g,加足量水充分反应后,溶液经蒸发和干燥得固体16 g,据此可确定碱金属M是[
]
A、![]() B、
B、![]() C、
C、![]() D、
D、![]()
解析 设M的相对原子质量为A,当设混合物全是碱金属或全是碱金属氧化物时有如下关系:
![]()
![]()
10.8 g→10.8×[(A+17)/A]g 10.8 g→10.8×[2(A+17)/(2A+16)]g
但实际上该混合物中碱金属及其氧化物都存在,则可建立不等式:![]() 。
。
解得:35.3>A>10.7,从碱金属的相对原子质量可知该碱金属只能是钠。
答案 B
例2 为了测定某种碱金属的相对原子质量,有人设计了如图所示的实验装置。该装置(包括足量的水)的总质量为![]() 。将质量为
。将质量为![]() 的某碱金属单质放入水中,立即塞紧瓶塞,完全反应后再称量此装置的总质量为
的某碱金属单质放入水中,立即塞紧瓶塞,完全反应后再称量此装置的总质量为![]() 。
。
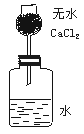
(1)列出计算该碱金属相对原子质量的数学表达式;
(2)无水氯化钙的作用是什么?如果不用![]() ,测定的碱金属相对原子质量比实际值偏大还是偏小?说明理由。
,测定的碱金属相对原子质量比实际值偏大还是偏小?说明理由。
解析 本题测定未知碱金属的相对原子质量,所依据的化学反应原理是:![]() ,只要通过实验,取得一定质量(题设
,只要通过实验,取得一定质量(题设![]() )的碱金属和足量的水反应产生的
)的碱金属和足量的水反应产生的![]() 的质量,即可根据化学方程式的计算求得碱金属的相对原子质量。
的质量,即可根据化学方程式的计算求得碱金属的相对原子质量。
(1)依题设实验数据,![]() 碱金属与足量水反应产生
碱金属与足量水反应产生![]() 的质量为
的质量为![]() 。设所求碱金属的相对原子质量为
。设所求碱金属的相对原子质量为![]() ,有
,有![]() ,解得
,解得![]() 。
。
(2)无水氯化钙吸收水蒸气。若不用![]() ,则使测定值较实际值偏小。讨论上述表达式,不难知道,若装置内的水蒸气外逸(反应放热,更容易使产生的水蒸气被
,则使测定值较实际值偏小。讨论上述表达式,不难知道,若装置内的水蒸气外逸(反应放热,更容易使产生的水蒸气被![]() 带走),则
带走),则![]() 值减少,
值减少,![]() 值增大,分式的分母增大,分数值即减小。
值增大,分式的分母增大,分数值即减小。
小结 还可以另想其他方法进行测定实验。譬如,若获得一定质量的碱金属与水反应所得![]() 的质量,本题亦可完成。
的质量,本题亦可完成。
例3 在120℃时,将气体A 3.88 g通过足量的![]() ,放出
,放出![]() ,充分反应后固体的质量增加2.28 g,试通过计算判断气体 A的组成及各成分的质量。
,充分反应后固体的质量增加2.28 g,试通过计算判断气体 A的组成及各成分的质量。
解析 120℃能和![]() 反应放出
反应放出![]() 的气体有可能是
的气体有可能是![]() 和
和![]() ,因此首先判断A是什么物质?可采用极端假设法。
,因此首先判断A是什么物质?可采用极端假设法。
解 如果A都是![]() ,设其质量为
,设其质量为![]() ,
,
![]()
![]()
![]() 32 4
32 4
![]() 2.28g
2.28g
![]() ,故假设不成立。
,故假设不成立。
如果A都是![]() ,设其质量为
,设其质量为![]() :
:
![]()
![]()
88 32 56
![]() 2.28g
2.28g
![]() ,故假设不成立。
,故假设不成立。
所以A应为![]() 和
和![]() 的混合物
的混合物
设![]() 的质量为
的质量为![]() g,
g,![]() 的质量为
的质量为![]() g,则
g,则![]() ,
,![]() 。
。
例4 碱金属(如锂、钠、钾、铷等)溶于汞中形成良好的还原剂“汞齐”。取某种碱金属的汞齐7g,与足量水作用得到0.2g氢气,并得到密度为![]() 的溶液1
的溶液1![]() ,则溶液中溶质的质量分数可能是[ ]
,则溶液中溶质的质量分数可能是[ ]
A、![]() B、
B、![]() C、
C、![]() D、
D、![]()
解析 汞不能与水反应,碱金属(M)与水反应的化学方程式为:![]() 。
。
设M质量为![]() ,相对原子质量为
,相对原子质量为![]() ,则
,则![]() ,故
,故![]() 。相对原子质量小于35的碱金属只有
。相对原子质量小于35的碱金属只有![]() 和
和![]() ,所以本题中碱金属可能为
,所以本题中碱金属可能为![]() 和
和![]() 。
。
答案 A、B
例5 (1993年全国)将70 g过氧化钠和氧化钠的混合物跟98 g水充分反应后,所得氢氧化钠溶液中溶质的质量分数为50%。试分别写出过氧化钠和氧化钠跟水反应的化学方程式,并计算原混合物中过氧化钠和氧化钠的质量各多少克。
解析 发生的反应有:
Na2O+H2O=2NaOH
2Na2O2+2H2O=4NaOH+O2↑
设混合物中Na2O2、Na2O的质量分别为x、y,由化学方程式分别解出生成的NaOH的质量和放出的O2质量。
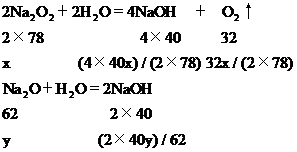
溶液的总质量为:70 g+98 g-[32x(2×78)]
由上述关系量可列二元一次方程组为
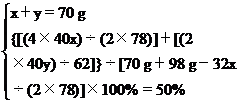
解得:x=39 g y=31 g
本题也可从下列角度入手列关系:由于NaOH溶液中溶质的质量分数为50%,因此在溶液中NaOH的质量等于H2O的质量
4.实战演练
1.用纯净的铂丝蘸取某无色溶液在无色火焰上灼烧,火焰呈黄色,说明该溶液中金属离子
A.只有Na+
B.可能有Na+、也可能有K+
C.一定有K+
D.一定有Na+、也可能有K+
2.电子工业制造光电管时,需要一种经强光照射就失电子而接通电路的材料,制造这种材料的物质应属于
A.放射性元素 B.ⅦA族元素
C.卤化银 D.ⅠA族元素
3.某温度下,w g某物质在足量氧气中充分燃烧,其燃烧产物立即与过量的Na2O2反应,固体质量增加w g。在①H2②CO ③CO和H2的混合气 ④HCHO ⑤CH3COOH
⑥HO—CH2—CH2—OH中,符合题意的是
A.均不符合 B.只有①②③
C.只有④⑤ D.全部符合
4.已知锂及其化合物的许多性质与碱金属差异较大,却与镁相似。下面有关锂及其化合物性质的叙述不正确的是
A.锂在过量氧气中燃烧主要产物是氧化锂而不是过氧化锂
B.碳酸锂受强热很难分解
C.碳酸锂的溶解度比碳酸氢锂的大
D.锂可以与氮气化合生成氮化锂(Li3N)
5.已知钡的活泼性介于钠和钾之间,下列说法中正确的是
A.钡可以从氯化钠溶液中置换出钠
B.钡可以从氯化铜溶液中置换出铜
C.钡可以从冷水中置换出氢而得到氢气
D.在水溶液中,钡离子可以氧化金属钠
6.Na3N与NaH均为离子化合物,都能与水反应放出气体。下列有关叙述正确的是
A.二者中Na+半径都比阴离子大
B.与水反应时,水都作氧化剂
C.与水反应所产生的气体都能使湿润的红色石蕊试纸变蓝
D.二者与盐酸反应,前者可产生两种盐,后者只有一种盐生成。
7.将2.3 g钠与另一种金属元素组成的合金放入足量盐酸中,完全反应时收集到1.13 L H2(标准状况),则另一种金属可能是
①K ②Mg ③Al ④Li ⑤Rb ⑥Fe
A.①⑤⑥ B.①⑤
C.②③④ D.①②③④
8.钾与氧组成的某种离子晶体,含钾的质量分数是![]() ,其阴离子只有过氧离子O
,其阴离子只有过氧离子O![]() 和超氧离子O
和超氧离子O![]() 两种,则此晶体中,O
两种,则此晶体中,O![]() 与O
与O![]() 的物质的量之比为
的物质的量之比为
A.2∶1 B.1∶1 C.1∶2 D.1∶3
二、非选择题(共60分)
9.(8分)在三个密闭容器内分别装有:A.Na2O2和NaHCO3,B.Na2O2和NH4HCO3,C.Na2O2和Ca(HCO3)2,其中每种物质均为1 mol。将它们加热至300℃,经充分反应后排出气体,写出各容器内残留的固体物质名称及其物质的量。A ,B ,C ,如分别加入相同浓度的足量稀H2SO4与残留物完全反应,则消耗硫酸的体积从大到小的顺序依次为 。
10.(10分)呼吸面具中Na2O2可吸收CO2放出O2,若用超氧化钾(KO2)代替Na2O2也可起同样的作用。
(1)写出KO2与CO2反应的化学方程式 。
(2)1 kg Na2O2和1 kg KO2 分别跟CO2反应,生成的O2的质量比为 。
(3)等质量的CO2分别与足量的Na2O2、KO2反应,生成的O2的质量比为 。
(4)你认为选用 作补氧剂更合适,理由是 。
11.(10分)为了制取纯净干燥的气体A,可用下图所示装置,生成A的速度可通过滴入液体B的速度控制。已知A是一种无色、无味、不能使酸碱指示剂变色,也不会在空气中燃烧的气体。

(1)A是 。
(2)若C是一种淡黄色固体,则烧瓶中发生反应的化学方程式为 。
(3)若C是一种黑色粉末,则B物质是 ,C物质的作用是 。
(4)洗气瓶中的试剂是 ,其作用是 。
12.(8分)已知氧化物有:普通氧化物,如Na2O;过氧化物,如Na2O2;超氧化物,如KO2;臭氧化物,如RbO3。其中后三种均能与水或CO2反应产生O2,试分别写出KO2、RbO3与CO2反应的化学方程式:
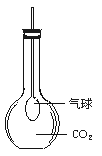
现已用平底烧瓶收集得到CO2,在瓶内有一只紧扎在玻璃管末端的气球,如上图所示。打开塞子迅速往瓶里加入下列物质中的 (填序号),立即塞紧塞子,一段时间后,气球就会自动膨胀起来。
A.Na2O B.Na2O2 C.KO2 D.RbO3
13.(12分)由NaOH和NaHCO3组成的固体混合物A mol 置于密闭容器中加热至200℃,充分反应后排出气体,得残余固体y mol。若以x表示原混合物中NaOH的物质的量分数,试回答:
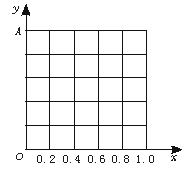
(1)当x=25%时,y的值;
(2)当x=75%时,y的值;
(3)若以x为横坐标,y为纵坐标,在图中画出x、y的关系曲线,并求出y=f(x)的关系式。
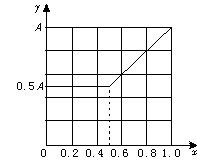
14.(12分)用NaOH、H2O、大理石和盐酸制取33 g纯NaHCO3,请参照物质的溶解度回答下列问题:
25℃ |
溶解度/g |
NaOH |
100 |
NaHCO3 |
9 |
Na2CO3 |
30 |
(1)写出制取过程中反应的化学方程式。
(2)若提供100 g水,则需NaOH的物质的量为多少?
(3)简述实验的操作过程。
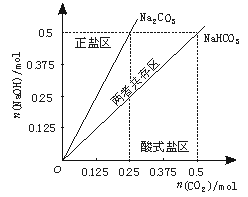
(4)在上图反映上述实验过程的图象中,标出A点[即当n(CO2)/n(NaOH)=1/3,且n(CO2)=0.125 mol]的位置,并判断此时所得盐的组成及其物质的量。
参考答案
一、1.解析:钠的焰色反应为黄色,钾的焰色反应为淡紫色,在观察钾的焰色时必须排除黄光的干扰。
答案:D
2.D
3.解析:组成要符合(CO)n(H2)m的形式
答案:D
4.BC 5.C 6.D 7.C 8.C
二、9.解析:在A中:1 mol NaHCO3分解生成0.5 mol CO2和0.5 mol H2O和0.5 mol Na2CO3,若先考虑0.5 mol CO2与Na2O2反应则有2CO2+2Na2O2===2Na2CO3+O2,故消耗0.5 mol Na2O2,生成0.5 mol Na2CO3,然后0.5 mol H2O和0.5 mol Na2O2刚好完全反应生成1 mol NaOH,故因为Na2CO3和NaOH不反应,结果相同,但应注意,若CO2过量,则CO2可和生成NaOH反应,而转化为H2O过量,因此通常在定量条件下先考虑CO2和Na2O2的反应情况。
答案:A.1 mol Na2CO3、1 mol NaOH B.1 mol Na2CO3 C.1 mol CaCO3、 1 mol Na2CO3 C>A>B
10.(1)4KO2+2CO2===2K2CO3+3O2↑
(2)0.61∶1 (3)1∶3
(4)KO2 因等质量的KO2与CO2反应时放出的O2的量更多
11.(1)O2(2)2Na2O2+2H2O===4NaOH+O2↑
(3)H2O2 催化剂 (4)浓H2SO4 干燥氧气
12.4KO2+2CO2===2K2CO3+3O24RbO3+2CO2===2Rb2CO3+5O2 AB
13.(1)0.5A (2)0.75A
(3)0<x<0.5时,y=0.5A;0.5≤x<1时,y=xA
14.(1)2HCl+CaCO3===CaCl2+H2O+CO2↑ CO2+NaOH===NaHCO3
(2)0.5 mol NaOH
(3)称取20 g NaOH放入烧杯中,加100 g H2O,不断搅拌,使之溶解,等冷却后,通入过量CO2气体。过滤,用滤纸将滤渣表面的水吸干。
(4)A点标注略 0.125 mol 正盐