二氧化硫
1.复习重点
1.二氧化硫的物理性质、化学性质。
2.重点是二氧化硫的氧化性、还原性、漂白性。
2.难点聚焦
一、二氧化硫的物理性质
无色、有刺激性气味的有毒气体;
密度比空气大;
易溶于水(1∶40);(可用于进行喷泉实验,如SO2、HCl、NH3)
易液化(-10℃)
二、二氧化硫的化学性质
1、酸性氧化物
能和碱反应生成盐和水:SO2+2NaOH===Na2SO3+H2O
能与水反应生成相应的酸:SO2+H2O===H2SO3
(二氧化硫的水溶液使紫色石蕊试液变红)
二氧化硫溶于水形成的亚硫酸只能存在于溶液中,它很不稳定,容易分解成水和二氧化硫,故二氧化硫溶于水的反应是可逆反应。
SO2+H2O![]() H2SO3
H2SO3
SO2与CO2性质的比较
名称 |
CO2 |
SO2 |
与H2O反应 |
CO2+H2O |
SO2+H2O |
与碱反应 |
CO2+2NaOH===Na2CO3+H2O CO2+NaOH===NaHCO3 CO2+Ca(OH)2===CaCO3↓+H2O |
SO2+2NaOH===Na2SO3+H2O SO2+NaOH===NaHSO3 SO2+Ca(OH)2===CaSO3↓+H2O |
与盐反应 |
CO2+CaCO3+H2O===Ca(HCO3)2 |
CaSO3+SO2+H2O===Ca(HSO3)2 |
2、氧化性:
SO2气体通过氢硫酸,溶液变浑浊,有淡黄色不溶物出现。
SO2+2H 2S===3S↓+2H 2O
3、还原性:SO2使溴水和高锰酸钾溶液褪色
SO2+Br2+2H 2O=== H2SO4+2HBr
5SO2+2KMnO4+2H2O===K2SO4+2MnSO4+2H2SO4
2SO2+O2 ![]() 2 SO3
2 SO3
(SO3+H2O===H2SO4,SO3是无色固体SO3是一种无色固体,熔点是16.80C,沸点也只有44.8℃,易溶于水,溶于水时放出大量的热。)
4、漂白性:SO2使品红溶液褪色,SO2能使某些有色物质褪色,是由于二氧化硫可跟某些有色物质化合成无色物质,而化合成的无色物质却是不稳定的,易分解而恢复原来有色物质的颜色。
漂白性的比较
具有漂白性的物质 |
|||
物质 |
HClO、O3、H2O2 、Na2O2 |
SO2 |
木炭 |
原理 |
将有色物质氧化分解 |
与有色物质结合生成无色物质 |
将有色物质的分子吸附在其表面 |
实质 |
氧化还原反应 |
非氧化还原反应 |
物理吸附 |
效果 |
永久性 |
暂时性 |
暂时性 |
范围 |
可漂白大多数有色物质,能使紫色石蕊褪色 |
可漂白某些有色物质,不能使石蕊试液褪色 |
可吸附某些有色物质的分子 |
把Cl2和SO2混合用于漂白,能否增强漂白效果?为什么?
〖答案〗不能,SO2+Cl2+2H2O=== H2SO4+2HCl
SO2与CO2的相互鉴别
鉴别SO2气体的常用方法是用品红溶液,看能否使其褪色,有时还需再加热看能否再复原。
鉴别CO2气体的常用方法是用澄清石灰水,看能否使其变浑浊,足量时再变澄清。
当混有CO2时,不会影响SO2的鉴别;
当混有SO2时会干扰CO2的鉴别,应先除去SO2后再用澄清石灰水鉴别CO2气体。
除去CO2中的SO2,常用方法是使混合气体先通过足量溴水或酸性KMnO4溶液或饱和NaHCO3溶液(吸收SO2),再通过品红溶液(检验SO2是否被除尽)。
〖新授〗
三、用途
(1)制硫酸;
(2)漂白纸浆、毛、丝、草帽等;
(3)杀菌消毒。
四、制法
1.工业制法
a,硫磺燃烧法 S+O2![]() SO2
SO2
b,煅烧硫铁矿法4FeS2+11O2![]() 2Fe2O3+8SO2
2Fe2O3+8SO2
2.实验室制法
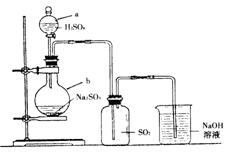
Na2SO3(s)+H2SO4(浓)===Na2SO4+SO2↑+H2O,实验中常使用溶质的质量分数为60%左右的硫酸,也可用浓硫酸。不能用很稀的硫酸,因为SO2在水中的溶解度较大,常温常压下1体积水能溶解40体积的SO2
五、二氧化硫的污染
请大家看课本P128进行总结。
1、pH小于5.6的雨水,称之为酸雨。
2、一般认为,酸雨是由于人为排放的SO2和氮氧化物等酸性气体进入大气,当这些气体达到一定浓度后,在水凝结过程中溶于水形成硫酸和硝酸,使雨水酸性变大,pH变小。其转化可简单表示如下:
2SO2+2H2O+O2![]() 2H2SO4
2H2SO4
NOx![]() HNO3
HNO3
3、酸雨的危害
(1)对人体健康造成危害。
(2)破坏森林、草原和农作物。
(3)使土壤酸性增强、湖泊酸化、生态环境受损。
(4)破坏建筑物。
3.例题精讲
例1、(2000·全国·1)导致下列现象的主要原因,与排放SO2有关的是
A.酸雨 B.光化学烟雾
C.臭氧空洞 D.温室效应
1、解析酸雨的形成,主要与SO2的排放有关;光化学烟雾的形成,主要与烃类及氮氧化物有关;温室效应主要与烃类和CO2等有关。
答案:A
例2、(2000•上海•3)下列物质不属于“城市空气质量日报”报道内容的是
A.二氧化硫 B.氮氧化物 C.二氧化碳 D.悬浮颗粒
2、解析城市空气质量日报的内容是二氧化硫、氮氧化物和悬浮颗粒,而二氧化碳不属于此报道内容。
答案:C
例3、(2002·苏豫·22)高温下硫酸亚铁发生如下反应:
2FeSO4![]() Fe2O3+SO2↑+SO3↑,若将生成的气体通入氯化钡溶液中,得到的沉淀物是
Fe2O3+SO2↑+SO3↑,若将生成的气体通入氯化钡溶液中,得到的沉淀物是
A.BaSO3和BaSO4 B.BaS
C.BaSO3 D.BaSO4
3、解析SO2通入BaCl2溶液不会生成沉淀,而SO3通入BaCl2中会有BaSO4沉淀产生。
答案:D
例4、(2000·全国·23)某学生课外活动小组利用下图所示装置分别做如下实验:
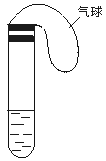
(1)在试管中注入某红色溶液,加热试管,溶液颜色逐渐变浅,冷却后恢复红色,则原溶液可能是 溶液;加热时溶液由红色逐渐变浅的原因是 。
(2)在试管中注入某无色溶液,加热试管,溶液变为红色,冷却后恢复无色,则此溶液可能是 溶液;加热时溶液由无色变为红色的原因是 。
解析 本题考查学生由实验现象判断实验原理的直觉和逆向思维能力。首先要审清实验的装置为一封闭体系,受热时,有气体从溶液中逸出进入气球,导致溶液的颜色的变化;冷却后,逸出的气体又溶解在溶液中,得到原来溶液,恢复到原来溶液的颜色。在中学阶段,因为气体的溶入和逸出而导致溶液颜色互变的最常见的是SO2与品红溶液之间以及NH3与酚酞溶液之间,然后根据题中现象进行分析、验证并解答即可。
答案:(1)稀氨水和酚酞 稀氨水中的NH3气体逸出,所以溶液的颜色变浅 (2)溶有SO2气体的品红 SO2气体逸出,品红溶液恢复红色
4.实战演练
一、选择题(每小题5分,共50分)
1.若要从CO2气体中除去少量SO2,最好使混合气体通过
A.盛NaOH溶液的洗气瓶
B.盛KMnO4酸性溶液的洗气瓶
C.盛品红溶液的洗气瓶
D.盛饱和NaHCO3溶液的洗气瓶
2.SO2是常见的大气污染物之一,我国规定空气中SO2含量不得超过0.02 mg·L-1。下列措施中不能够减少SO2排放量的是
A.用天然气代替煤炭做民用燃料
B.开发新型燃器提高热能利用率
C.硫酸厂采取措施提高尾气的吸收率
D.燃煤中加入生石灰后使用
3.SO2和Cl2都具有漂白性。若将等物质的量的这两种气体同时作用于潮湿的有色物质,可观察到有色物质
A.立刻褪色 B.慢慢褪色
C.先褪色,后复原 D.颜色不褪
4.向FeCl3和BaCl2的酸性混合液中通入SO2气体,有白色沉淀生成,此沉淀是
A.BaSO4 B.FeS
C.BaSO3 D.S
5.常温下,向20 L真空容器内通入a mol硫化氢和b mol二氧化硫(a和b都是正整数,且a≤5,b≤5),反应完全后,容器内气体可能达到的最大密度约是
A.24.5 g·L-1 B.14.4 g·L-1
C.8 g·L-1 D.5.1 g·L-1
6.在常温下将a L SO2和b L H2S混合,当反应后气体体积为反应前气体体积的1/4时,则a与b之比为
A.1∶1 B.1∶2
C.1∶3 D.2∶1
7.下列关于SO2的叙述,不正确的是
A.SO2既可以是含硫物质的氧化产物,又可以是含硫物质的还原产物
B.SO2是亚硫酸的酸酐
C.大气中SO2的主要来源是含硫物质的燃烧
D.SO2具有氧化性,因而可以使品红溶液褪色
8.下列反应发生后,溶液中H+浓度显著增大的是
A.将SO2通入溴水中
B.将SO2通入品红溶液中
C.将H2S通入CuSO4溶液中
D.将Cl2通入KI溶液
9.为了除去混入CO2中的SO2和O2,下列试剂的使用顺序正确的是
①饱和Na2SO4溶液;②饱和NaHCO3;③浓硫酸;④灼热的铜网;⑤碱石灰。
A.①③④ B.②③④
C.②④③ D.③④⑤
10.一定物质的量的SO2与NaOH溶液反应,所得产物中含Na2SO3和NaHSO3物质的量之比为3∶5,则参加反应的SO2与NaOH物质的量之比为
A.1∶2 B.3∶5
C.8∶11 D.18∶8
二、非选择题(共50分)
11.(10分)将SO2通入下列溶液中:
①氢硫酸,②溴水,③品红溶液,④澄清石灰水,⑤酸性高锰酸钾,⑥氯化钙溶液,
⑦用硝酸酸化的硝酸钡溶液,⑧硝酸钡
(1)使溶液颜色褪去的有 。
(2)先生成沉淀而后能溶解的有 。
(3)有沉淀产生不能溶解的有 。
(4)SO2作还原剂的有 。
(5)SO2作氧化剂的有 。
(6)无明显现象的有 。
12.(8分)A和B在常温下都是气体,A和B在空气中都不能被点燃,A的式量比B大。现分步实验如下:在A溶液中通入适量B气体,溶液酸性显著增强;继续加硝酸钡溶液反应,得到一种不溶于稀硝酸的白色沉淀;过滤,滤液无色;再向滤液中加入硝酸银溶液,析出另一种不溶于稀硝酸的白色沉淀。回答下列问题:
(1)写出A、B两种气体的名称:A ,B 。
(2)写出上述各步实验中的化学方程式,属离子反应的写离子方程式: 。
13.(12分)实验室制取SO2的反应原理为:Na2SO3+H2SO4(浓)===Na2SO4+SO2↑+H2O。请用下列装置设计一个实验,以测定SO2转化为SO3的转化率:
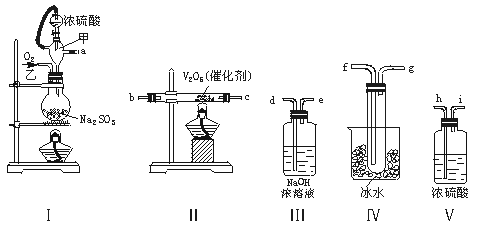
(1)这些装置的连接顺序(按气体左右的方向)是 → → → → → → → (填各接口的编号)。
(2)实验时甲仪器的作用与原理是 。
(3)从乙处均匀通入O2,为使SO2有较高的转化率,实验时Ⅰ处滴入浓硫酸与Ⅱ处加热催化剂的先后顺序是 。
(4)Ⅳ处观察到的现象是 。
(5)在Ⅰ处用大火加热烧瓶时,SO2的转化率会 (填“增大”“不变”或“减小”)。
(6)用n mol Na2SO3粉末与足量浓硫酸进行此实验,当反应结束时,继续通入O2一段时间后,称得Ⅲ处增重m g,则本实验中SO2的转化率为 。
14.(6分)Na2SO3在空气中极易被氧化,现有a g样品,将其溶解后,
加入足量BaCl2溶液,可得干燥的沉淀b g。
(1)若Na2SO3未被氧化,b= a。
(2)若Na2SO3全部被氧化,b= a。
(3)若Na2SO3部分被氧化,b与a的关系式为 。
15.(6分)室温时,V L真空容器内通入n mol SO2和m mol H2S。
(1)若n=2,则当m等于多少时,反应后容器内气体的密度最小?
(2)若2n>m,则反应后氧化产物与还原产物的质量差为多少克?
(3)若5n=m,且反应后氧化产物与还原产物的质量和为48 g,则n+m的值是多少?
16.(8分)(吉林省调研题)已知273℃,1.01×105 Pa时,1 mol气体所占的体积为
44.8 L。现将此条件下V1 L SO2和O2的混合气体通过装有催化剂的反应器,充分反应后(假设反应完全)气体的体积为V2 L。所得气体用含a mol的NaOH溶液吸收,恰好完全反应。当产物分别为下列三种情况时,计算并推导a的表达式(用V1,V2表示)。
(1)Na2SO4
(2)Na2SO4和Na2SO3
(3)Na2SO4和NaHSO3
附参考答案
一、1.BD 2.B 3.D 4.A 5.B 6.AC 7.D 8.AC 9.B
10.解析:SO2 + 2NaOH===Na2SO3+H2O
3 mol 6 mol 3 mol
SO2 + NaOH===NaHSO3
5 mol 5 mol 5 mol
故n(SO2)∶n(NaOH)=(3+5)mol∶(6+5)mol=8∶11。
答案:C
二、11.(1)②③⑤
(2)④
(3)①⑦⑧
(4)②⑤⑦⑧
(5)①
(6)⑥
12.(1)氯气 二氧化硫
(2)Cl2+2H2O+SO2===4H++2Cl-+SO![]()
Ag++Cl-===AgCl↓ Ba2++SO![]() ===BaSO4↓
===BaSO4↓
13.(1)a h i b c f g d
(2)作用是使浓硫酸能顺利地滴入烧瓶中;原理是维持烧瓶内压强与分液漏斗内压强相等
(3)先加热V2O5,后缓缓滴入浓硫酸
(4)有无色(或白色)晶体(或固体)生成
(5)减小
(6)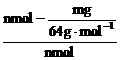 ×100%或
×100%或![]() ×100%
×100%
14.(1)![]() (2)
(2)![]() (3)
(3)![]() <b<
<b<![]()
15.(1)4 (2)16 m (3)3
16.(1)a=![]() (2)a=
(2)a=![]() (3)
(3)![]()