几种典型晶体结构的特点分析
徐寿坤
有关晶体结构的知识是高中化学中的一个难点,它能很好地考查同学们的观察能力和三维想像能力,而且又很容易与数学、物理特别是立体几何知识相结合,是近年高考的热点之一。熟练掌握NaCl、CsCl、CO2、SiO2、金刚石、石墨、C60等晶体结构特点,理解和掌握一些重要的分析方法与原则,就能顺利地解答此类问题。
通常采用均摊法来分析这些晶体的结构特点。均摊法的根本原则是:晶胞任意位置上的原子如果是被n个晶胞所共有,则每个晶胞只能分得这个原子的1/n。
1. 氯化钠晶体
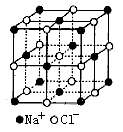
由下图氯化钠晶体结构模型可得:每个Na+紧邻6个![]() ,每个
,每个![]() 紧邻6个
紧邻6个![]() (上、下、左、右、前、后),这6个离子构成一个正八面体。设紧邻的Na+与Cl-间的距离为a,每个Na+与12个Na+等距离紧邻(同层4个、上层4个、下层4个),距离为
(上、下、左、右、前、后),这6个离子构成一个正八面体。设紧邻的Na+与Cl-间的距离为a,每个Na+与12个Na+等距离紧邻(同层4个、上层4个、下层4个),距离为![]() 。由均摊法可得:该晶胞中所拥有的Na+数为
。由均摊法可得:该晶胞中所拥有的Na+数为![]() ,
,![]() 数为
数为![]() ,晶体中Na+数与Cl-数之比为1:1,则此晶胞中含有4个NaCl结构单元。
,晶体中Na+数与Cl-数之比为1:1,则此晶胞中含有4个NaCl结构单元。
2. 氯化铯晶体
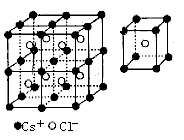
每个Cs+紧邻8个Cl-,每个Cl-紧邻8个Cs+,这8个离子构成一个正立方体。设紧邻的Cs+与Cs+间的距离为![]() ,则每个Cs+与6个Cs+等距离紧邻(上、下、左、右、前、后)。在如下图的晶胞中Cs+数为
,则每个Cs+与6个Cs+等距离紧邻(上、下、左、右、前、后)。在如下图的晶胞中Cs+数为![]() ,
,![]() 在晶胞内其数目为8,晶体中的
在晶胞内其数目为8,晶体中的![]() 数与
数与![]() 数之比为1:1,则此晶胞中含有8个CsCl结构单元。
数之比为1:1,则此晶胞中含有8个CsCl结构单元。
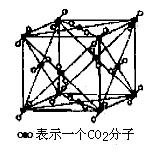
3. 干冰
每个CO2分子紧邻12个CO2分子(同层4个、上层4个、下层4个),则此晶胞中的CO2分子数为![]() 。
。
4. 金刚石晶体
每个C原子与4个C原子紧邻成键,由5个C原子形成正四面体结构单元,C-C键的夹角为![]() 。晶体中的最小环为六元环,每个C原子被12个六元环共有,每个C-C键被6个六元环共有,每个环所拥有的C原子数为
。晶体中的最小环为六元环,每个C原子被12个六元环共有,每个C-C键被6个六元环共有,每个环所拥有的C原子数为![]() ,拥有的C-C键数为
,拥有的C-C键数为![]() ,则C原子数与C-C键数之比为
,则C原子数与C-C键数之比为![]() 。
。
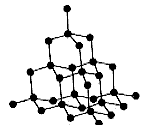
5. 二氧化硅晶体
每个Si原子与4个O原子紧邻成键,每个O原子与2个Si原子紧邻成键。晶体中的最小环为十二元环,其中有6个Si原子和6个O原子,含有12个Si-O键;每个Si原子被12个十二元环共有,每个O原子被6个十二元环共有,每个Si-O键被6个十二元环共有;每个十二元环所拥有的Si原子数为![]() ,拥有的O原子数为
,拥有的O原子数为![]() ,拥有的Si-O键数为
,拥有的Si-O键数为![]() ,则Si原子数与O原子数之比为1:2。
,则Si原子数与O原子数之比为1:2。
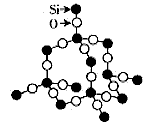
6. 石墨晶体
在石墨晶体中,层与层之间是以分子间作用力结合,同层之间是C原子与C原子以共价键结合成的平面网状结构,故石墨为混合型晶体或过渡型晶体。在同层结构中,每个C原子与3个C原子紧邻成C-C键,键角为![]() ,其中最小的环为六元环,每个C原子被3个六元环共有,每个C-C键被2个六元环共有;每个六元环拥有的C原子数为
,其中最小的环为六元环,每个C原子被3个六元环共有,每个C-C键被2个六元环共有;每个六元环拥有的C原子数为![]() ,拥有的C-C键数为
,拥有的C-C键数为![]() ,则C原子数与C-C键数之比为2:3。
,则C原子数与C-C键数之比为2:3。
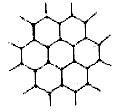
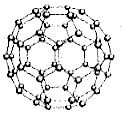
7. C60分子
C60是由60个C原子组成的类似于足球的分子,由欧拉定律可推知该分子中有12个正五边形和20个正六边形。每个C原子与其他3个C原子紧邻成键,形成的总键数为![]() 由于每个C原子可形成4个键,所以3个键中肯定有一个是双键,则其中的双键数为
由于每个C原子可形成4个键,所以3个键中肯定有一个是双键,则其中的双键数为![]() ,单键数为
,单键数为![]() 。
。