解析几例溶解度曲线的中考题
江苏 朱世
利用溶解度曲线,可以查出物质在不同温度时的溶解度,也可以比较出同一温度时,不同物质溶解度的大小。溶解度曲线还能反映出不同物质溶解度受温度变化影响的大小。溶解度曲线题信息量大,涉及的知识多,是中考化学的热点。
例1. 图1为三种固体物质的溶解度曲线,根据该图信息可知:b的溶解度受温度变化影响不大。
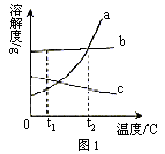
此外你还能获得的信息有:
(1) ;
(2) ;
(3) 。
解析:仔细阅读图1,从中可获得许多信息,现部分举例如下:(1)a的溶解度受温度变化影响较大;(2)c的溶解度随温度升高而减小;(3)t1℃时,各物质的溶解度大小顺序为:![]() ;(4)t2℃时,各物质的溶解度大小顺序为:
;(4)t2℃时,各物质的溶解度大小顺序为:![]() ;(5)可采用降温的方法使a的不饱和溶液变为饱和溶液;(6)可采用升温的方法使c的不饱和溶液变为饱和溶液;(7)可采用蒸发溶剂的方法使b的不饱和溶液变为饱和溶液;(8)可采用冷却热饱和溶液的方法使a从溶液中析出;(9)等质量的a、b饱和溶液分别从t2℃降温到t1℃时,析出的固体a比b多;(10)若a中混有少量b时,可采用降温结晶的方法提纯a。
;(5)可采用降温的方法使a的不饱和溶液变为饱和溶液;(6)可采用升温的方法使c的不饱和溶液变为饱和溶液;(7)可采用蒸发溶剂的方法使b的不饱和溶液变为饱和溶液;(8)可采用冷却热饱和溶液的方法使a从溶液中析出;(9)等质量的a、b饱和溶液分别从t2℃降温到t1℃时,析出的固体a比b多;(10)若a中混有少量b时,可采用降温结晶的方法提纯a。
例2. 图2是硝酸钾和氯化钠的溶液度曲线,下列叙述中不正确的是( )
A. t1℃时,120gKNO3饱和溶液中含有20gKNO3
B. t2℃时,KNO3和NaCl的饱和溶液中溶质的质量分数相同
C. KNO3的溶解度大于NaCl的溶解度
D. 当KNO3中含有少量的NaCl时,可以用结晶方法提纯KNO3
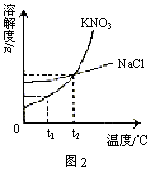
解析:抓住“四要素”理解溶解度的概念是解决本题的关键,在比较固体物质溶解度的大小时一定要指明具体的温度,若温度不同,则不好比较。从图2可知:t2℃时,KNO3和NaCl的溶解度相等,温度低于t2℃时,KNO3的溶解度小于NaCl的溶解度,只有当温度高于t2℃时,KNO3的溶解度才大于NaCl的溶解度,所以选项C是错误的。t1℃时,KNO3的溶解度为20g,即t1℃时,100g水中达到饱和状态时所溶解的KNO3的质量为20g,此时饱和溶液质量为120g。由于t2℃时,KNO3和NaCl的溶解度相等,所以t2℃时,KNO3和NaCl的饱和溶液中溶质的质量分数相同。图2显示KNO3的溶解度受温度变化的影响较大,NaCl的溶解度受温度变化的影响不大,因而可用降温结晶的方法提纯KNO3。本题选C。
例3. 图3是A、B、C三种物质的溶解度曲线。请回答:
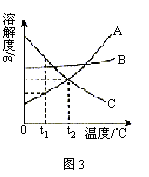
(1)t1℃时,A、B、C三种物质的溶解度由大到小的顺序是 。
(2)当A中混有少量B时,可用 方法提纯A;
(3)在t1℃时,将25gA物质加入到盛有50g水的烧杯中,充分搅拌,再升温到t2℃(不考虑溶剂的挥发)。在升温过程中,A溶液中溶质的质量分数的变化情况是 。
解析:利用溶解度曲线,可以比较出同一温度时不同物质溶解度的大小,t1℃时,A、B、C三种物质的溶解度由大到小的顺序为:![]() 。由于A物质的溶解度受温度变化的影响较大,因此可用降温结晶的方法使A物质从溶液中析出。t1℃时,A物质的溶解度是40g,所以t1℃时,50g水中最多只能溶解20gA,另有5gA剩余,温度升高,A物质的溶解度增大,剩余的5gA物质将继续溶解,溶液中溶质的质量分数逐渐增大,当温度升高到一定时,5gA物质将完全溶解,此时尽管温度继续升高,但溶质的质量分数不变,所以温度由t1℃升高到t2℃时,A溶液中溶质的质量分数是选逐渐增大,后保持不变。
。由于A物质的溶解度受温度变化的影响较大,因此可用降温结晶的方法使A物质从溶液中析出。t1℃时,A物质的溶解度是40g,所以t1℃时,50g水中最多只能溶解20gA,另有5gA剩余,温度升高,A物质的溶解度增大,剩余的5gA物质将继续溶解,溶液中溶质的质量分数逐渐增大,当温度升高到一定时,5gA物质将完全溶解,此时尽管温度继续升高,但溶质的质量分数不变,所以温度由t1℃升高到t2℃时,A溶液中溶质的质量分数是选逐渐增大,后保持不变。
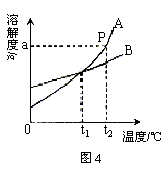
练习:小刚同学绘制了图4所示A、B两种固体物质的溶解度曲线。
1. A物质在温度为t2℃时的溶解度是 ;温度为t1℃时,A物质与B物质的溶解度 (填“相等”或“不相等”或“不能比较”)。
2. 我国有许多盐碱湖,湖中溶有大量的NaCl和Na2CO3,那里的人们冬天捞碱,夏天晒盐。据此你认为图4中(填字母) 曲线与纯碱的溶解度曲线相似。
答案:1. ag;相等 2. A