pH知识考点透视
溶液的酸碱性及其强弱是溶液的重要性质,并且对生产、生活、科研有很大的影响。pH不仅能表示溶液的酸碱性,而且还能表示其强弱即酸碱度。因此pH知识成为各地中考命题的热点,归纳起来主要表现在以下方面。
一、考查物质的酸碱性与pH大小的相互判断
例1 一些常见食物的近似pH范围如下表:
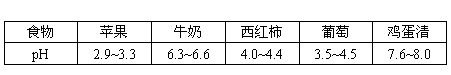
下列说法正确的是( )
A. 苹果的酸性比葡萄的酸性强
B. 西红柿能使无色酚酞试液变红
C. 牛奶的碱性比鸡蛋清的碱性强
D. 胃酸过多的病人应该多吃苹果
分析 溶液的酸碱性根据pH的大小可分为三类:当pH小于7时,溶液呈酸性,且pH越小,酸性越强;当pH等于7时,溶液显中性;当pH大于7时,溶液显碱性,且pH越大,碱性越强。由表中信息可知,苹果的pH比葡萄的pH小,所以苹果的酸性比葡萄的酸性强,A正确;西红柿的pH小于7,不能使无色酚酞试液变红,B错误;牛奶的pH小于7,显酸性,鸡蛋清的pH大于7,显碱性,C错误;由于苹果显酸性,所以胃酸过多的病人不宜多吃,D错误。答案为A。
考题检验下图是生活中一些常见物质的pH,参照图示判断,下列说法正确的是( )

A. 酱油呈碱性
B.
葡萄汁能使无色酚酞试液变红
C. 胃酸过多的人可多喝玉米粥 D.
西瓜汁的酸性要比苹果汁的酸性强
参考答案 C
二、考查反应过程中pH的变化情况
例2 下表是某指示剂在一定的pH范围内所显示的颜色。

向滴有少量该指示剂的氢氧化钠溶液中,逐滴加入稀盐酸,出现的颜色变化是( )
A.
由蓝到绿 B.
由绿到蓝 C.
由橙到绿 D.
由红到紫
分析 氢氧化钠溶液显碱性,使该指示剂显紫色或蓝色,加入盐酸后,根据酸碱中和原理,溶液的碱性逐渐减弱,直至中性甚至酸性,从而使指示剂显绿色、橙色或红色。对照各选项,即可得出结论。答案为A。
考题检验已知A、B分别是盐酸溶液和氢氧化钠溶液中的一种,下图表示向A中滴加B时,溶液pH变化的曲线。请写出你从曲线图中收获的信息:
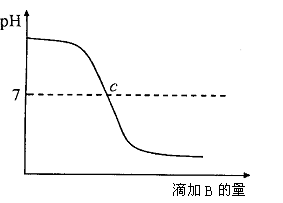
(1)A是______________________________________。
(2)B是______________________________________。
(3)______________________________________。
参考答案 (1)NaOH溶液 (2)盐酸
(3)c点表示两种溶液正好中和(两种溶液正好中和,附近溶液的pH变化较快)
三、考查pH的测定方法及误差分析
例3 将pH试纸用水润湿后测定某溶液的酸碱度,所测得该溶液的pH与实际情况相比,其结果是( )
A. 相等 B.
偏大 C.
偏小 D.
三种结果均有可能
分析 测定溶液pH的方法是用玻璃棒蘸取待测溶液滴到pH试纸上,如果将pH试纸用水润湿会出现误差。当所测溶液显酸性时,pH试纸用水润湿后,使溶液的酸性减弱,pH偏大;当所测溶液显碱性时,pH试纸用水润湿后,使溶液的碱性减弱,pH偏小;当溶液显中性时,pH试纸用水润湿后,溶液仍显中性,pH不变。故答案为D。
考题检验已知溶液中氢离子浓度越大,溶液的酸性越强,溶液的pH越小。有一位同学在实验室中是这样测某溶液pH的:他先用蒸馏水润湿pH试纸,然后用___________(填仪器)蘸取试样进行检测,该同学测得的pH是否一定会有误差?
________________________________________________。
参考答案 玻璃棒 不一定会有误差