《物质的量》复习指南
物质的量及其相关知识是高中化学计算的基础,同学们该如何突破物质的量学习中的难点,将抽象、陌生的基本概念理解透彻,减少在考试中的失误呢?本文将从以下几个方面进行分析。
一、掌握一张关系图,熟悉物理量间的转化
同学们要全面认识以物质的量为中心的各种概念之间的相互关系,其网络图如下:
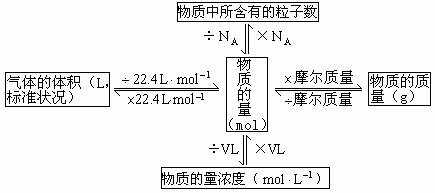
二、紧抓两个高考热点,理解知识内涵
阿伏加德罗常数和阿伏加德罗定律是《物质的量》一章中的两个重要知识点,也是高考的热点,其覆盖面广,能更好地考查同学们对知识内涵的全面理解,所以同学们在复习中一定要认真挖掘这两个知识点。
1. 阿伏加德罗常数
1mo1任何粒子的粒子数叫做阿伏加德罗常数(符号为NA)。
准确理解此概念要注意以下几点。
(1)阿伏加德罗常数是有单位的,其单位是![]() 。
。
(2)不要认为![]() ,而是
,而是![]() 。
。
2. 阿伏加德罗定律
同温同压下,相同体积的任何气体含有相同数目的分子,这就是阿伏加德罗定律。阿伏加德罗定律忽略了气体分子本身的大小;它主要应用于不同气体之间的比较。
阿伏加德罗定律的推论如下:
推论1 同温同压下,气体的体积之比等于其物质的量之比。即T、p相同时,![]() 。
。
推论2 同温同体积下,气体的压强之比等于其物质的量之比。即T、V相同时,![]() 。
。
推论3 同温同压同体积下,气体的质量之比等于其摩尔质量之比。即T、p、V相同时,![]() 。
。
三、弄清三种溶液组成的表示方式,比较概念间的异同
对于溶液的组成,一般可以用质量分数、物质的量浓度来表示,有时也可以用溶解度来表示。三者的异同列表如下:
|
|
质量分数 |
物质的量浓度 |
溶解度 |
|
定义 |
溶液中溶质的质量与溶液的质量之比 |
以单位体积溶液里所含溶质的物质的量表示溶液组成的物理量 |
在一定温度下,达到饱和状态时100g溶剂中所能溶解的溶质的质量 |
|
单位 |
1 |
|
|
|
符号 |
|
|
S |
|
相同点 |
都能从量上反映溶液的组成 |
||
|
转化关系 |
|
||
四、透析三个物理量,强化概念的理解
物质的量、气体摩尔体积和物质的量浓度是本章学习中的三个重要基本物理量,也是同学们需要加强理解的地方。
|
|
物质的量 |
气体摩尔体积 |
物质的量浓度 |
|
定义 |
表示含有一定数目粒子的物理量 |
单位物质的量的气体所占的体积 |
以单位体积溶液里所含溶质的物质的量表示溶液组成的物理量 |
|
符号 |
|
|
|
|
单位 |
|
|
|
|
公式 |
|
|
|
|
注意事项 |
物质的量是专有名词,只能以整体形式出现 |
1. 标准状况:0℃、101kPa 2. 标准状况下, |
公式中V是指溶液的体积,n是指溶质的物质的量 |
五、掌握一个实验
这个实验是指一定物质的量浓度溶液的配制,要求:①理解实验原理;②掌握实验操作的方法及操作过程中的注意事项;③根据每个步骤考虑实验所需的仪器以及掌握仪器的使用方法;④会进行误差分析(根据n或V的变化情况进行分析)。