第四节《沉淀溶解平衡》
一、选择题
1. 在一定温度下,一定量的水中,石灰乳悬浊液存在下列平衡:Ca(OH)2(s)![]() Ca(OH)2(aq)
Ca(OH)2(aq) ![]() Ca2+(aq)+2OH-(aq),当向此悬浊液中加入少量生石灰时,下列说法正确的是
Ca2+(aq)+2OH-(aq),当向此悬浊液中加入少量生石灰时,下列说法正确的是
A.n(Ca2+)增大 B.c(Ca2+)不变 C.n(OH-)增大 D.c(OH-)减小
 2. 向5mL
NaCl溶液中滴入一滴AgNO3溶液,出现白色沉淀,继续滴加一滴KI溶液并振荡,沉淀变为黄色,再滴入一滴Na2S溶液并振荡,沉淀又变成黑色。根据上述变化过程,分析此三种沉淀物的溶解度关系为.
2. 向5mL
NaCl溶液中滴入一滴AgNO3溶液,出现白色沉淀,继续滴加一滴KI溶液并振荡,沉淀变为黄色,再滴入一滴Na2S溶液并振荡,沉淀又变成黑色。根据上述变化过程,分析此三种沉淀物的溶解度关系为.
A.AgCl=AgI=Ag2S B.AgCl<AgI< Ag2S
C.AgCl>AgI> Ag2S D.AgI>AgCI> Ag2S
3. 工业废水中常含有Cu2+、Cd2+、Pb2+等重金属离子,可通过加入过量的难溶电解质FeS、MnS,使这些金属离子形成硫化物沉淀除去。根据以上事实,可推知FeS、MnS具有的相关性质是
A.在水中的溶解能力大于 CuS、CdS、PbS
B.在水中的溶解能力小于CuS、CdS、PbS
C.在水中的溶解能力与CuS、CdS、PbS相同
D.二者均具有较强的吸附性
4. 非结合胆红素(VCB)分子中有羟基,被氧化后(生成羧基)与钙离子结合形成胆红素钙的反应,就是一个沉淀生成的离子反应,从动态平衡的角度分析能预防胆结石的方法是.
A.大量食用纯碱可使钙离子沉淀完全.,防止胆结石生成
B.不食用含钙的食品
C.适量服用低维生素E、低维生素C等抗氧化自由基可防治胆结石
D.常喝水稀释钙离子,溶解沉淀
5. CaCO3在下列液体中溶解度最大的是
A.H2O B.Na2CO3溶液 C.CaCl2溶液 D.乙醇
6. 向含有AgCl(s)的饱和AgCl溶液中加水,下列叙述正确的是
A.AgCl的溶解度增大
B.AgCl的溶解度、Ksp均不变
C.Ksp(AgCl)增大
D.AgCl的溶解度、Ksp均增大
7. 已知
A.
B.Ksp(CaF2)随温度和浓度的变化而变化
C.该体系中,Ksp(CaF2)=![]()
D.该体系中有CaF2沉淀产生
8. 已知Ksp(AgCl )=1.8×10-10,Ksp(AgI)=1.0×10-16。下列关于不溶物之间转化的说法中错误的是
A.AgCl不溶于水,不能转化为AgI
B.两种不溶物的Ksp相差越大,不溶物就越容易转化为更难溶的不溶物
C.AgI比AgCl更难溶于水,所以,AgCl可以转化为AgI
D.常温下,AgCl若要在NaI溶液中开始转化为AgI,则NaI的浓度必须不低于×10-11
mol·L-1
9. 在已知AgCl和Ag2CrO4的溶度积分别为1.8×10-10mol-2和2.0×10-12mol3·L-3。若用难溶盐在溶液中的浓度来表示其溶解度,则下列叙述正确的是 .
A.AgCl和Ag2CrO4的溶解度相等
B.AgCl的溶解度大于Ag2CrO4
C.两者类型不同,不能直接由Ksp的大小来判断其溶解能力的大小
D.都是难溶盐,溶解度无意义
10. 当固体AgCl放在较浓的KI溶液中振荡时,部分AgCl转化为AgI,其原因是.
A.AgI比AgCl稳定
B.氯的非金属性比碘强
C.I-的还原性比Cl-强
D.AgI的溶解度比AgCl小
11. ![]() 现向
现向
A.
C.该体系中没有沉淀产生
D.该体系中HF与CaCl2反应产生沉淀
12. 在2mL物质的量浓度相等的NaCl和NaI溶液中滴入几滴AgNO3溶液,发生的反应为.
A.只有AgCl沉淀生成
B.只有AgI沉淀生成
C.生成等物质的量的AgCl和AgI沉淀 D.两种沉淀都有,但以AgI为主
13. 铝和镓的性质相似,如M(OH)3都是难溶的两性氢氧化物。在自然界镓常以极少量分散于铝矿,如Al2O3中。用NaOH溶液处理铝矿(Al2O3)时,生成NaAlO2、NaGaO2;而后通入适量CO2,得Al(OH)3沉淀,而NaGaO2留在溶液中(循环多次后成为提取镓的原料)。发生后一步反应是因为
A.镓酸酸性强于铝酸
B.铝酸酸性强于镓酸
C.镓浓度小,所以不沉淀
D.Al(OH)3是难溶物
14. 下列有关离子反尖的叙述不正确的是
A.溶液中有难溶于水的沉淀生成是离子反应的发生条件之一
B.离子反应发生的方向总是向着溶液中离子浓度降低的方向进行
C.离子反应生成的沉淀的溶解度为零
D.生成沉淀的离子反应之所以能发生,在于生成物的溶解度小
15. 在产生了AgCl沉淀的试管中,加入KI溶液,白色沉淀变为黄色.下列说法正确的是
A.该实验说明I-还原性比Cl-强
B. 该实验说明I-还原性比Cl-弱
C.该实验说明AgI溶解度比AgCl小
D. KI的加入对AgCl的溶解平衡没有影响
16. 已知
A.c
(K+)>c
(NO3—) >c (Cl—) >c (Ag+)>c (I—)
B.c
(K+)>c
(NO3—) >c (Ag+) >c (Cl—)>c (I—)
C.c
(NO3—)>c (K+)>c (Ag+) >c (Cl—)>c (I—)
D.c
(K+)>c
(NO3—) >c (Ag+) = c (Cl—) + c (I—)
17. 常温下,AgCl、AgBr、AgI的溶度积常数(Ksp)依次为1.8×10-10mol2·L-2、5.0×10-13mol2·L-2、8.3×10-17mol2·L-2。下列有关说法错误的是
A.常温下在水中溶解能力AgCl>AgBr>AgI
B.在AgCl饱和液中加入足量浓NaBr溶液有AgBr沉淀生成
C.在AgBr饱和溶液中加入足量浓NaCl溶液不可能有AgCl沉淀生成
D.在AgI饱和液中加入NaI固体有AgI沉淀析出
18. 下表是五种银盐的溶度积常数Ksp(
|
化学式 |
AgCl |
Ag2SO4 |
Ag2S |
AgBr |
AgI |
|
溶度积 |
1.4×10-10 |
1.4×10-5 |
6.3×10-50 |
7.7×10-13 |
8.51×10-16 |
下列说法不正确的是
A.五种物质在
B.在氯化银的悬浊液中加入Na2S溶液则可以生成黑色的Ag2S
C.
D.沉淀溶解平衡的建立是有条件的,外界条件改变时,平衡也会发生移动
19.某温度时,AgCl (s)![]() Ag+(aq)+Cl-(aq)在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是
Ag+(aq)+Cl-(aq)在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是

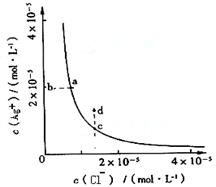
A.加入AgNO3可以使溶液由c点变到d点
B.加入固体NaCl则AgCl的溶解度减小,Ksp也减小
C.c点对应的Ksp小于a点对应的Ksp
D. d点有AgCl沉淀生成
20. 已知
![]() A.
A.
![]() B. KSP(CaF2)随温度和浓度的变化而变化
B. KSP(CaF2)随温度和浓度的变化而变化
![]() C.该体系中有CaF2沉淀产生
C.该体系中有CaF2沉淀产生
![]() D.以上说法均不正确
D.以上说法均不正确
二、填空题
21.已知Ksp(Ag2S)=1.6×10—49,Ksp(CuS)=6.3×10—36,Ksp(PbS)=8×10—28,则推断可以实现的沉淀转化关系为
。
22.将足量BaCO3分别加入:①
30mL 水 ②10mL 0.2mol/LNa2CO3溶液 ③50mL 0.01mol/L 氯化钡溶液 ④100mL 0.01mol/L盐酸中溶解至溶液饱和。请确定各溶液中Ba2+的浓度由大到小的顺序为: _____
三、计算题( 小题,每小题
分)
23.一定温度下,难溶电解质在饱和溶液中各离子浓度幂的乘积是一个常数,这个常数称为该难溶电解质的溶度积,用符号Ksp表示。
即:AmBn(s)![]() mAn+(aq)+nBm-(aq) [An+]m·[Bm-]n=Ksp
mAn+(aq)+nBm-(aq) [An+]m·[Bm-]n=Ksp
已知:某温度时,Ksp(AgCl)=[Ag+][Cl-] =1.8×10-10
Ksp(Ag2CrO4)=[Ag+]2[CrO2-
4] =1.1×10-12
试求:
(1)此温度下AgCl饱和溶液和Ag2CrO4饱和溶液的物质的量浓度,并比较两者的大小。
(2)此温度下,在0.010mo1·L-1的AgNO3溶液中,AgCl与Ag2CrO4分别能达到的最大物质的量浓度,并比较两者的大小。
答案
一、选择题
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
B |
C |
A |
C |
A |
B |
D |
A |
C |
D |
|
11 |
12 |
13 |
14 |
15 |
16 |
17 |
18 |
19 |
20 |
|
D |
D |
A |
C |
C |
A |
C |
C |
D |
C |
二、填空题
 21.PbS→CuS→Ag2S
21.PbS→CuS→Ag2S
22.③④①②
三、计算题
23.①AgCl(s)![]() Ag+(aq)+Cl-(aq)
Ag+(aq)+Cl-(aq)
![]()
Ag2CrO4(s) ![]() 2Ag+(aq)+CrO42-(aq)
2Ag+(aq)+CrO42-(aq)
2x x
(2x)2·x=Ksp
![]()
∴ c(AgCl)<c(Ag2CrO4)
②在0.010
mol·L-1 AgNO3溶液中,c(Ag+)=0.010
mol·L-1
AgCl(s) ![]() Ag+(aq) + Cl-(aq)
Ag+(aq) + Cl-(aq)
溶解平衡时: 0.010+x x
(0.010+x)·x=1.8×10-10 ∵ x很小,∴ 0.010+x ≈0.010
x=1.8×10-8(mol·L-1)
c(AgCl)=
1.8×10-8(mol·L-1)
Ag2CrO4(s) ![]() 2Ag+(aq) + CrO2-4(aq)
2Ag+(aq) + CrO2-4(aq)
溶解平衡时: 0.010+x x
(0.010+2x)2·x=1.1×10-12 ∵ x很小,∴ 0.010+2x≈0.010
 x=1.1×10-8(mol·L-1) ∴ c(Ag2CrO4)=1.1×10-8
(mol·L-1)
x=1.1×10-8(mol·L-1) ∴ c(Ag2CrO4)=1.1×10-8
(mol·L-1)
∴ c(AgCl)>c(Ag2CrO4)