![]()
【本讲教育信息】
一. 教学内容:
生活中常见的有机物——乙酸
[教学目标]
1. 知识与技能目标
(1)初步掌握乙酸的分子结构和主要用途。
(2)掌握乙酸的酸性和酯化反应等化学性质,理解酯化反应的概念。
2. 过程与方法目标
(1)通过实验培养学生设计实验及观察、描述、解释实验现象的能力。
(2)培养学生对知识的分析归纳、总结的思维能力与表达能力。
(3)培养学生解决实际问题的能力。
3. 情感、态度与价值观
(1)辨证认识乙酸的弱酸性,进一步理解“结构决定性质”的含义。
(2)通过设计实验、动手实验,激发学习兴趣,培养求实、创新、合作的优良品质。
(3)通过洗水垢,让学生进一步理解“化学是一门实用性很强的学科”。
二. 重点、难点:
教学重点:乙酸的酸性和酯化反应
教学难点:乙酸的分子结构和酯化反应
[教学方法]
讨论+探究+实验
[教学过程]
一、乙酸的物理性质
乙酸俗称醋酸,食醋的主要成分就是乙酸;
无色刺激性气味液体,熔点16.6℃,低于16.6℃时就凝结成冰状晶体,所以无水乙酸又称冰醋酸。乙酸易溶于水和酒精。
二、乙酸的结构
分子式:C2H4O2
结构式: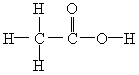
结构简式:CH3COOH
官能团是羧基:—COOH
三、化学性质
1. 乙酸的酸性
乙酸是一元弱酸,酸性比碳酸强,具有酸的通性。
(1)使紫色石蕊试液变红
(2)与活泼金属反应
Mg + 2CH3COOH ![]() (CH3COO)2Mg + H2↑
(CH3COO)2Mg + H2↑
(3)与金属氧化物反应
Na2O+2CH3COOH![]() 2CH3COONa+H2O
2CH3COONa+H2O
(4)与碱反应
NaOH+CH3COOH![]() CH3COONa+H2O
CH3COONa+H2O
Cu(OH)2+2CH3COOH ![]() (CH3COO)2Cu+2H2O
(CH3COO)2Cu+2H2O
(5)与部分盐反应(利用乙酸的酸性,可以用乙酸来除去水垢(主要成分是CaCO3)):
2CH3COOH+CaCO3![]() (CH3COO)2Ca+H2O+CO2
(CH3COO)2Ca+H2O+CO2
启发:由于乙酸为弱酸但酸性比碳酸强,所以乙酸钠的性质为碱性,乙酸可以制得碳酸
|
|
羟基上氢原子的活动性比较 |
||
|
名称 |
乙 醇 |
水 |
乙 酸 |
|
结构简式 |
C2H5OH |
H—OH |
CH3COOH |
|
性质对比 |
能与钠反应,但不 能与氢氧化钠反应 |
能与钠反应,且反应剧烈 |
能与钠反应,也能 与氢氧化钠反应 |
|
没有酸性 |
没有酸性 |
有弱酸性,比碳 酸酸性强,能使 指示剂变色 |
|
|
结论 |
羟基上氢原子的活动性依次增大 |
||
结论:羟基氢原子活泼性顺序为:乙酸>碳酸>水>乙醇。
2. 酯化反应
(1)概念:醇和酸起作用,生成酯和水的反应叫做酯化反应。
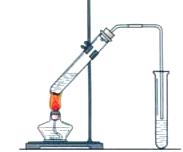
装置特点及实验现象:
A、受热的试管与桌面成45°角。导气管比一般的导气管要长一些,且导气管口位于饱和碳酸钠溶液的液面上方。
B、加热后,在受热的试管中产生了蒸气,有一部分冷凝回流了下来,一部分从导气管导出,从导气管滴出的无色液体位于饱和碳酸钠溶液的上方。
C、实验结束,先撤导管,后撤酒精灯。
D、收集到的产物是无色液体,经过振荡后,酚酞的红色变浅,液面上仍有一薄层无色透明的油状液体,并可闻到一种香味。
(2)反应原理:

乙酸与乙醇反应的主要产物乙酸乙酯是一种无色、有香味、密度比水小、不溶于水的油状液体。
(3)酯化反应的特点:
A、酯化反应在常温下进行得很慢,为使反应加快,使用了催化剂和加热的条件。
B、酯化反应是可逆反应,因此可以通过减少产物的浓度来促使反应向正方向进行。
C、酯化反应也是取代反应,反应的实质是乙醇的羟基脱氢,乙酸脱羟基。
(4)实验注意事项:
A、向试管内加入化学试剂的顺序:乙醇![]() 浓硫酸
浓硫酸![]() 乙酸,注意不能先加浓硫酸,防止液体飞溅。
乙酸,注意不能先加浓硫酸,防止液体飞溅。
B、浓硫酸的作用:催化剂:提高反应速率;吸水性:该反应是可逆反应,加浓硫酸可促进反应向生成乙酸乙酯的反应方向进行。
C、加热的目的:提高反应速率;使生成的乙酸乙酯挥发,有利收集及提高乙醇、乙酸的转化率。
D、饱和碳酸钠溶液的作用:
中和挥发出来的乙酸,生成醋酸钠(便于闻乙酸乙酯的气味);溶解挥发出来的乙醇;抑制乙酸乙酯在水中的溶解度,使乙酸乙酯与碳酸钠溶液分层,便于得到反应生成的酯。
E、导管的作用是导气、冷凝;不能将导管插到液面以下,目的是防止发生倒吸。
3. 水解反应
(1)在酸中的反应方程式:
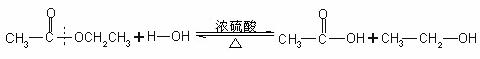
(2)在碱中的反应方程式:
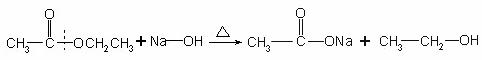
四、乙酸的用途
醋是日常生活中饮食烹调的常用调味品,从医学保健角度来看,食醋还是保持身体健康的灵丹妙药。在工业上醋酸更是一种重要的有机化工原料,用途极为广泛。
【典型例题】
例1. 下列物质中可用来鉴别乙酸、乙醇、苯的是( )
A. 金属钠 B. 溴水 C. 碳酸钠溶液 D. 紫色石蕊试液
答案:C
解析:碳酸钠能与乙酸反应,故将碳酸钠溶液加入到乙酸中,有气泡产生;乙醇能与水以任意比混溶,将碳酸钠溶液加入乙醇中,不会出现分层;苯极难溶于水,将碳酸钠溶液加入苯中,出现液体分层现象。
例2. 将等质量的铜片在酒精灯上加热后,分别插入下列溶液中,放置片刻,铜片质量增加的是( )
A. 硝酸 B.
无水乙醇 C.
石灰水 D.
盐酸
答案:C
解析:铜片灼热后生成氧化铜,硝酸、盐酸能使氧化铜溶解,铜片的质量减少;乙醇可实现氧化铜到铜的转变:C2H5OH+CuO![]() CH3CHO+Cu+H2O,铜片的质量不变;石灰水不与氧化铜反应,铜片质量增加。
CH3CHO+Cu+H2O,铜片的质量不变;石灰水不与氧化铜反应,铜片质量增加。
例3. 某有机物分子式是C3H4O2,它的水溶液显酸性,即能跟碳酸钠溶液反应,能使溴水褪色。写出这种有机物的结构简式。
答案:CH2=CHCOOH
解析:分子中含有两个氧原子,水溶液呈酸性,能跟碳酸钠溶液反应,应属于羧酸。从分子中氢原子数看,烃基不饱和,使溴水褪色发生的是加成反应。可判断分子中含有不饱和碳碳键和羧基。
例4. 实验室合成乙酸乙酯的步骤如下:在圆底烧瓶内加入乙醇、浓硫酸和乙酸,瓶口竖直安装通有冷却水的冷凝管(使反应混合物的蒸气冷凝为液体流回烧瓶内),加热回流一段时间后换成蒸馏装置进行蒸馏,得到含有乙醇、乙酸和水的乙酸乙酯粗产品。请回答下列问题:
(1)在烧瓶中除了加入乙醇、浓硫酸和乙酸外,还应放入________ ,目的是__________。
(2)反应中加入过量的乙醇,目的是______________。
(3)如果将上述实验步骤改为在蒸馏烧瓶内先加入乙醇和浓硫酸,然后通过分液漏斗边滴加醋酸,边加热蒸馏。这样操作可以提高酯的产率,其原因是_______________________。
(4)现拟分离含乙酸、乙醇和水的乙酸乙酯粗产品,下图是分离操作步骤流程图。请在图中圆括号内填入适当的试剂,在方括号内填入适当的分离方法。
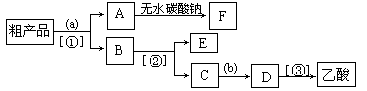
试剂a是___________,试剂b是___________;分离方法①是_____________,分离方法②是______________,分离方法③是_______________。
(5)在得到的A中加入无水碳酸钠粉末,振荡,目的是________________________。
答案:(1)碎瓷片,防止爆沸。
(2)提高乙酸的转化率。
(3)及时地蒸出生成物,有利于酯化反应向生成酯的方向进行。
(4)饱和碳酸钠溶液,硫酸;分液,蒸馏,蒸馏。
(5)除去乙酸乙酯中的水份。
【模拟试题】
一. 选择题。
1. 下列物质能导电的是( )
A. 冰醋酸 B. 乙醇 C. 乙酸溶液 D. 乙酸乙酯
2. 区分酒精和醋酸的方法是( )
A. 品尝一下味道 B. 观察它们的颜色
C. 用紫色石蕊试液 D. 测试溶于水的情况
3. 下列物质在水中不出现分层的是( )
A. 溴苯 B. 乙酸 C. 乙醇 D. 四氯化碳
4. 下列是有关生活中对醋酸的应用,其中主要利用了醋酸酸性的是( )
A. 醋酸溶液可一定程度上治疗手足癣
B. 熏醋可一定程度上防止流行性感冒
C. 醋可以除去水壶上的水垢
D. 用醋烹饪鱼,除去鱼的腥味
5. 可以说明CH3COOH是弱酸的事实是( )
A. CH3COOH与水能以任意比互溶
B. CH3COOH能与Na2CO3溶液反应,产生CO2气体
C. 1mol/L的CH3COONa溶液的pH约为9
D. 1mol/L的CH3COOH水溶液能使紫色石蕊试液变红
6. 分离乙醇和乙酸的方法最好的是( )
A. 分液漏斗分液 B. 加入碳酸钠饱和溶液,通过分液分离
C. 加热蒸馏 D. 加入氢氧化钠后,蒸出乙醇,再加浓硫酸蒸出乙酸
7. 某中性有机物在酸性条件下可以水解生成分子量相同的A和B,A是中性物质,B可以和Na2CO3溶液反应放出气体,该有机物是( )
A. CH3COOC3H7 B. CH3COOC2H5 C. CH3COONa D. CH3CH2Br
8. 下列事实能说明碳酸的酸性比乙酸弱的是( )
A. 乙酸能发生酯化反应,而碳酸不能
B. 碳酸和乙酸都能与碱反应,产物都是弱碱性的盐
C. 乙酸能使紫色石蕊试液变红,而碳酸不能
D. 醋酸可用于清除水垢
9. 在酯化反应的实验中,为什么要加冰醋酸和无水乙醇( )
A. 这样就不需要加浓硫酸 B. 促使反应向生成酯的方向进行
C. 减少副产物 D. 提高乙酸和乙醇的转化率
10. 在乙酸和乙醇的酯化反应中,浓硫酸是( )
A. 催化剂 B. 氧化剂 C. 干燥剂 D. 催化剂和吸水剂
11. 将1mol有机物水解后得2mol C2H6O和1mol C2H2O4,该有机物是( )
A. CH3COOCH2CH2COOCH3 B. C2H5OOCCOOC2H5
C. CH3COOCH2COOC2H5 D. CH3COOCH2COOH
二. 填空题。
1. 写出下列反应的离子方程式:
①乙酸与NaOH溶液反应:
②乙酸与氨水反应:
③将锌粒投入到乙酸溶液中:
④用乙酸除去水垢:
2. 实验室用如图装置制取乙酸乙酯。
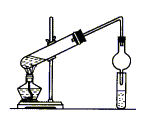
⑴在大试管中配制一定比例的乙醇、乙酸和浓H2SO4的混合液的方法是_________。
⑵加热前,大试管中加入几粒碎瓷片的作用是__________________,导气管不能插入Na2CO3溶液中是为了___________________。
⑶浓H2SO4的作用是:①_____________,②_____________。
⑷饱和Na2CO3溶液的作用是__________________________。
⑸实验室生成的乙酸乙酯,其密度比水_____(填“大”或“小”),有_________味。
![]()
【试题答案】
一. 选择题。
1. C 2.
C 3.
BC 4.
C 5.
C 6.
D
7. A 8.
CD 9.
BD 10.
D 11.
B
二. 填空题。
1. (1) OH-+ CH3COOH ![]() CH3COO- + H2O
CH3COO- + H2O
(2)
NH3·H2O + CH3COOH![]() CH3COO-
+ NH4+ +
H2O
CH3COO-
+ NH4+ +
H2O
(3) Zn + 2CH3COOH ![]() 2CH3COO- + Zn2+ + H2↑
2CH3COO- + Zn2+ + H2↑
(4) 2CH3COOH+CaCO3![]() 2CH3COO- +
Ca2+ + H2O+ CO2↑
2CH3COO- +
Ca2+ + H2O+ CO2↑
2.(1)乙醇![]() 浓硫酸
浓硫酸![]() 乙酸,注意不能先加浓硫酸,防止液体飞溅。
乙酸,注意不能先加浓硫酸,防止液体飞溅。
(2)防暴沸,防倒吸
(3)催化剂,吸水剂(脱水剂)
(4)中和挥发出来的乙酸,生成醋酸钠(便于闻乙酸乙酯的气味);溶解挥发出来的乙醇;抑制乙酸乙酯在水中的溶解度,使乙酸乙酯与碳酸钠溶液分层,便于得到反应生成的酯。
(5)小,香