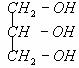![]()
【本讲教育信息】
一. 教学内容:
生活中常见的有机物——乙醇
[教学目标]
1. 知识与技能目标
(1)掌握乙醇的分子结构、化学性质;
(2)学会由事物的表象分析事物的本质、变化,进一步培养学生综合运用知识、解决问题的能力;
(3)通过人人动手实验,规范学生操作,全面培养、提高学生的实验能力、观察能力和对实验现象的分析能力。
2. 过程与方法目标
通过对乙醇性质的学习,使学生获得物质的结构、性质之间关系的科学观点。
3. 情感态度与价值观目标
学生自学发酵法制酒的发展历程以及对人类社会的重要作用,让学生体会人类伟大的创造力,体会化学化工为人类社会创造了美。另外,通过酒对人类社会的带来美的享受的同时,也带来了一定的危害,甚至导致严重的社会问题,使学生体会到美与丑的辩证关系。
二. 重点、难点:
1. 乙醇的结构
2. 乙醇的化学性质(与活泼金属的反应、催化氧化反应)
[教学方法]
讨论+探究+实验
[教学过程]
一. 烃的衍生物定义:烃分子里的氢原子被其他原子或原子团所取代,生成一系列新的有机物,从结构上说,都可以看作是由烃衍变而来的,叫做烃的衍生物。
例如:硝基苯、苯磺酸、溴乙烷等等,均属于烃的衍生物。
二. 官能团:决定化合物特性的原子或原子团称为官能团。
如:溴乙烷的官能团是-Br,硝基苯的官能团是-NO2,乙醇:-OH,乙醛:-CHO
三. 乙醇的结构和物理性质
1. 乙醇的物理性质
乙醇俗称酒精,是一种无色,透明而具有特殊香味的液体,比水轻,沸点78.5度,乙醇易挥发,能跟水以任意比混溶,能溶解多种有机物和无机物,是常用的有机溶剂。
应用:酒厂可以勾兑各种浓度的酒,可调配酒精溶液;可作有机溶剂,制作乙醇护肤品;可以提取中草药的有效成份。
启发:乙醇与水的混合物的分离用蒸馏而不用分液漏斗分离;乙醇不能用来萃取碘水中的碘。
2. 怎样检验酒精中是否含水以及怎样除水:
(1)用无水硫酸铜检验酒精中是否含水,如果白色粉末变蓝,说明酒精中含水。
(2)工业上,为使95.6%的乙醇变为100%的绝对乙醇,常常加入CaO加热回流一段时间后蒸馏,得到99.5%的无水乙醇,然后再加入金属Mg加热回流一段时间后蒸馏可得到绝对乙醇。
3. 乙醇的分子式:C2H6O
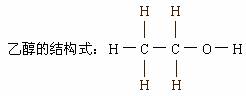
乙醇的结构简式:CH3CH2OH或C2H5OH
乙醇的官能团:羟基(-OH)
四. 乙醇的化学性质
1. 和金属钠的反应
![]()
注意:1. 比水和金属钠反应要缓和的多。
2. K、Na、Mg等活泼金属能把乙醇分子里羟基中的氢取代出来。
结论:水比乙醇活泼,因此产物乙醇钠(有机碱)的碱性比氢氧化钠强。
1mol乙醇跟足量钠反应,产生0.5mol氢气。
启发:把金属钠放入乙醇和水的混合物中,钠先和水反应,再和乙醇反应,据此可以除去乙醇中少量的水。
2. 乙醇的氧化
(1)乙醇的燃烧
![]()
应用:乙醇可作燃料,可制作成固体酒精;可调配乙醇汽油(10%乙醇和90%的汽油混合);因此,使用乙醇燃料时要注意安全,防止火灾。
(2)乙醇的催化氧化
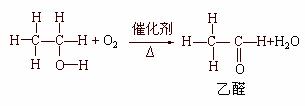
催化剂:Cu或Ag
反应历程:2Cu+O2=2CuO
CH3CH2OH+CuO→CH3CHO+Cu +H2O
现象:
结论:1. 弱氧化剂CuO、Ag2O等可以氧化乙醇成乙醛。
2. 有机的氧化反应:加氧去氢;还原反应:加氢去氧是还原。
3. 催化氧化的实质:和羟基相连的碳原子的氢和羟基的氢去掉。
(3)其他氧化剂氧化
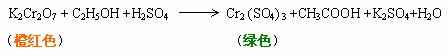
乙醇还能使酸性KMnO4褪色

3. 脱水反应
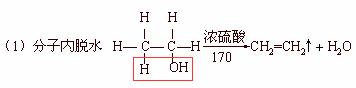
乙醇的分子内脱水可制得乙烯。
(2)分子间脱水
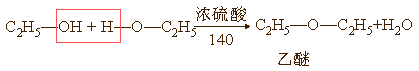
醚是两个烃基通过一个氧原子连接起来的化合物。
乙醚的性质一种无色易挥发的液体,有特殊气味,微溶于水,易溶于有机溶剂,可用作麻醉剂。
4. 跟氢卤酸反应(断C-O键)
反应方程式:CH3CH2-OH+H-Br→CH3CH2Br+H2O
反应类型:取代反应
注意:氢溴酸可以用氯化钠和硫酸的混合物代替。(通常采用1:1的硫酸,而不用很浓的硫酸。)
总结:断键方式:
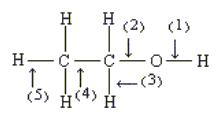
(1)断:与金属钠反应,放出氢气;(1)和(3)断,发生催化氧化反应(在Cu、Ag等催化下);(2)和(5)断,发生分子内的脱水反应(消去反应)
五. 乙醇的用途:
(1)做燃料,饮料和香精。
(2)制乙酸乙醚。
(3)做有机溶剂。
(4)做消毒剂(医用酒精百分之75)。
六. 乙醇的制备:
食用酒的酿造:

工业酒精的制造:
![]()
【模拟试题】
一. 不定项选择题:
( )1. 下列有关乙醇的物理性质的应用中不正确的是
A. 由于乙醇的密度比水小,所以乙醇中的水可以通过分液的方法除去
B. 由于乙醇能够溶解很多有机物和无机物,所以可用乙醇提取中草药的有效成分
C. 由于乙醇能够以任意比溶解于水,所以酒厂可以勾兑各种浓度的酒
D. 由于乙醇容易挥发,所以才有俗语“酒好不怕巷子深”的说法
( )2. 水是一种廉价而且非常有用的试剂,下列用水就能鉴别的一组物质是
A. 苯、己烷、四氯化碳 B. 苯、乙醇、四氯化碳
C. 硝基苯、乙醇、四氯化碳 D. 硝基苯、乙醇、醋酸
( )3. 下列物质中不能用来从碘水中提取碘单质的是
A. 乙醇
B. 苯
C. 四氯化碳 D.
NaOH溶液
( )4. 能够用来检验酒精中是否含有水的试剂是
A. 金属钠 B. 无水硫酸铜 C. 无水氯化钙 D.
浓硫酸
( )5. 工业上,为使95.6%的乙醇变为100%的绝对乙醇,常常加入一种物质加热回流一段时间后蒸馏,得到99.5%的无水乙醇,然后再加入另一种物质加热回流一段时间后蒸馏可得到绝对乙醇,这两种物质分别是
A. 无水硫酸铜,生石灰
B.
无水氯化钙,金属钠
C. 生石灰,金属镁 D. 浓硫酸,金属镁
( )6. 验证某有机物属于烃的含氧衍生物,应完成的实验内容是
A. 只有验证它完全燃烧后产物只有H2O和CO2
B. 只有测定其燃烧产物中H2O和CO2物质的量的比值
C. 测定完全燃烧时消耗有机物与生成的CO2、H2O的物质的量之比
D. 测定该试样的质量及其试样完全燃烧后生成CO2和H2O的质量
( )7. 一定量的乙醇在氧气不足的条件下燃烧生成CO、CO2和H2O。全部收集后测得其总质量为27.6g,其中水的质量为10.8g,则CO的质量为
A. 1.4g B.
2.2g C.
4.4g D.
2.2g和4.4g之间
( )8. 乙醇与钠反应后得到的产物乙醇钠用下列哪种物质检验
A. 紫色石蕊试液 B. 水 C. 酚酞试液 D. 无水硫酸铜
( )9. 1mol乙醇与一定量的钠刚好完全反应后,溶液质量增加了多少克
A.
11g
B. 17g
C. 44g
D. 22
( )10. A、B、C三种醇同足量的金属钠反应,在相同条件下产生相同体积的氢气,消耗这三种醇的物质的量之比为3:6:2,则A、B、C三种醇分子中羟基数之比是
A. 3:2:1 B. 2:6:3
C. 3:6:2 D. 2:1:3
( )11.
NaH是一种离子化合物,它跟水反应的方程式为:NaH+H2O→NaOH+H2↑,它能跟液氨、乙醇等发生类似的反应,并都产生氢气。下列有关NaH的叙述错误的是
A. 跟水反应时,水作氧化剂
B. NaH中H-半径比Li+半径小
C. 跟液氨反应时,有NaNH2生成
D. 足量NaH跟1mol乙醇反应时,生成0.5molH2
二. 计算题:
12. 某醇A蒸气的质量是相同条件下同体积下乙醇蒸气的2倍。1.38gA完全燃烧后,若将燃烧的产物通过碱石灰,碱石灰的质量会增加3.06g;若将燃烧产物通过浓硫酸,浓硫酸的质量增加1.08g;取4.6gA与足量钠反应,生成的气体在标准状况下的体积为1.682L。试通过计算确定A的分子式和结构简式。
![]()
【试题答案】
1. A 2.
B 3.
AD 4.
B 5.
C
6. D 7.
A 8.
AC 9.
D 10.
D
11. BD
12. C3H8O3