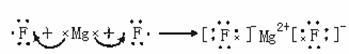![]()
【本讲教育信息】
一. 教学内容:
化学键之——离子键
二. 教学目标
1. 知识与技能目标
(1)掌握化学键、离子键的概念;掌握离子键的形成过程和形成条件,并能熟练地用电子式表示离子化合物的形成过程。
(2)通过对离子键形成过程的教学,培养学生抽象思维和综合概括能力。
2. 过程与方法目标
让学生学会由个别到一般的研究问题的方法。
3. 情感态度与价值观目标
培养学生用对立统一规律认识问题。
三. 教学重点、难点
离子键和用电子式表示离子化合物的形成过程。
四. 教学方法
实验+讨论+分析推理
[教学过程]
一. 引入
1. 由Na在氯气中燃烧的实验引入NaCl的形成和离子键的形成。
2. 重在分析离子键的形成,让学生充分理解离子键的实质是阴阳离子间的静电引力和斥力。
二、离子键(Ionic bond)
1. 概念
使阴、阳离子结合成化合物的静电作用(引力、 斥力)叫做离子键。
2. 成键粒子:
阴、阳离子
3. 成键条件:
活泼的金属元素(IA,IIA)与活泼的非金属元素(VIA,VIIA)
(1)活泼金属元素:Na、K、Ca、Mg……
活泼非金属元素:O、S、F、Cl……
(2)活泼的金属元素和酸根阴离子(SO42-,NO3-)及OH-
(3)铵根阳离子和酸根阴离子(或活泼非金属元素)
(4)很活泼的金属与氢气反应生成的氢化物
如
Na、K、Ca与H。
4. 成键的本质
阴阳离子间的静电作用(静电引力和斥力)
5. 成键的主要原因
活泼的原子通过得失电子,形成阴、阳离子,它们之间通过静电引力和斥力达到平衡,从而形成稳定的结构,使体系的能量降低。

6. 离子化合物
(1)概念:由阴、阳离子相互作用而构成的化合物(含离子键)。
(2)常见的离子化合物
强碱、大多数盐、活泼金属氧化物
特例:全由非金属元素组成的离子化合物:如NH4NO3
[练习]
1、下列说法正确的是:
D
A. 离子键就是使阴、阳离子结合成化合物的静电引力
B. 所有金属与所有非金属原子之间都能形成离子键
C. 在化合物CaCl2中,两个氯离子之间也存在离子键
D. 钠原子与氯原子结合成氯化钠后体系能量降低
2、下列各数值表示有关元素的原子序数,其所表示的各原子组中能以离子键相互结合成稳定化合物的是:
C
A. 10与12
B.8与17
C. 11与17
D.6与14
3. 离子化合物溶于水或熔化时离子键是否发生变化?
转化成自由移动的离子,离子键即被破坏。
4、下列说法中正确的是: C
A. 在离子化合物中一定只有离子键
B. 非金属元素之间不可能形成离子化合物
C. 两个非金属元素原子之间不可能形成离子键
D. 离子键就是阴阳离子间的静电引力
5、已知NaH是一种白色离子晶体,其中钠是+1价,NaH跟水反应放出氢气,下列叙述中正确的是 BC 。
A. NaH在水中显酸性
B. NaH中氢离子的电子层排布与氦原子相同
C. NaH中氢离子的半径比锂离子大
D. NaH中氢离子可被还原成氢气
6、已知氮化钠(Na3N)在熔融时能导电,与水作用能产生氨气。试回答下列问题:
(1)氮化钠属于 离子 化合物。
(2)比较离子半径: N3- > Na+ 。
(3)Na3N与水反应的方程式 Na3N +
3H2O = 3NaOH +
NH3↑
该反应属于 复分解 反应。
三、电子式
在元素符号周围用小圆点或小叉表示原子最外层电子的式子。
1、原子的电子式
(1)元素符号+最外层电子;
(2)排布时要在四面尽可能地分散,每面最多两个电子——四个方位两个满(He例外)
如:钠原子表示为 Na ·
镁原子表示为 · Mg ·
2、离子的电子式
金属阳离子的电子式就是其离子符号
非金属阴离子的电子式要标[ ]及“电荷数”
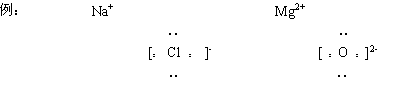
3、化学式的电子式
(1)离子数目少的微粒写在中间;
(2)离子数目多的微粒逐个写在左右,不得合并。

[练习]写出CaO、MgCl2的电子式
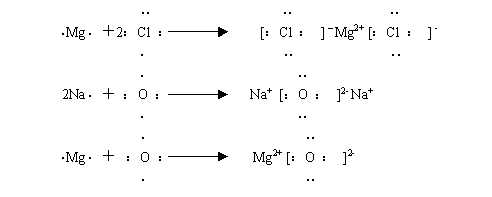
4、用电子式表示离子化合物的形成过程(三种类型)

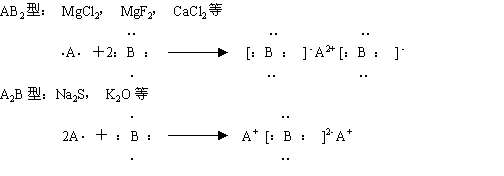
例:用电子式表示溴化钙的形成过程

注意:
箭号左方相同的微粒(原子)可以合并,
箭号右方相同的微粒(离子)不可以合并。
[练习]
⑴ 用电子式表示氧化镁的形成过程
⑵ 用电子式表示硫化钾的形成过程
小结:
用电子式表示化合物形成时应注意的问题
(1)原子的电子式只能标出最外层上的电子
(2)阳离子的电子式只写离子符号,阴离子的电子式要加方括号,并在右上角标上负电荷符号
(3)离子化合物的电子式,相同的离子不要合并
(4)转化过程用箭号表示,不用“=”
[练习]
1、短周期主族元素A和B可形成AB2型离子化合物,用电子式表示其形成过程。
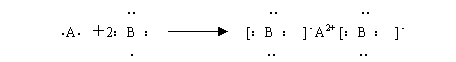
2、写出下列物质的离子键的形成过程。
(1)MgCl2 (2)Na2O (3)MgO
【模拟试题】
一、选择题:
1. 下列不是离子化合物的是
A. H2O B. CaI2 C. KOH D. NaNO3
2. 下列化合物电子式书写正确的是
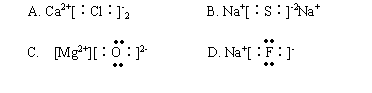
3. 下列物质中有氧离子存在的是
A.H2O B.
CaO C.
KClO D.
KOH
4. 某元素最高正价与负价绝对值之差为4,该元素离子跟与其核外电子排布相同的离子形成的离子化合物是
A. K2S B. MgO C. MgS D. NaF
5. 下列叙述错误的是
A. 钠、氯原子作用生成NaCl后,稳定性增强
B. 在NaCl中,除Cl―和Na+的静电吸引作用外,还存在电子之间、原子核之间的排斥作用
C. 任何离子键,在形成过程中,必须有电子得失
D. Na和Cl反应生成NaCl后,能量降低
6. 下列离子化合物中,离子组成与Ne和Ar的电子层结构分别相同的是
A. NaCl B. LiI C. NaF D. CsI
7. 已知NaH属于离子化合物,NaH跟水反应放出H2,下列叙述正确的是
A. NaH跟水反应,水溶液呈中性 B. NaH中氢离子可以被还原为H2
C. NaH在化学反应中是种强氧化剂 D. NaH中氢离子半径比锂离子大
8. .下列关于离子化合物的叙述正确的是
A. 离子化合物中都含有离子键
B. 离子化合物中的阳离子只能是金属离子
C. 离子化合物如能溶于水,其水溶液一定可以导电
D. 溶于水可以导电的化合物一定是离子化合物
9. 下列性质中,可以证明某化合物内一定存在离子键的是
A. 可溶于水 B. 具有较高的熔点
C. 水溶液能导电 D. 熔融状态能导电
二、填空:
10. 用电子式表示。
①铝原子___________________ ②硫离子___________________
③硫化钾的形成过程
11. X元素位于ⅡA族,原子核内有12个中子,它在最高价氧化物中的质量分数是60%,Y元素原子的原子核外有9个电子,X与Y能形成稳定化合物,该化合物的化学式是________,它是通过________键结合的,它形成过程的电子式为_____________。
![]()
【试题答案】
一、1. A 2. D 3. B 4. A 5. C 6. A 7. D 8. AC 9. D
二、10.
![]()
![]()
11. MgF2 离子