![]()
一、学习目标
1. 了解化学反应的分类,知道它们是依据什么来划分的。
2. 掌握四种基本反应类型的概念,学会找出化学反应所属类型。
3. 从化合价升降、电子转移角度理解氧化还原反应的概念。
4. 理解氧化剂、还原剂、氧化产物、还原产物的概念。
5. 理解四种基本反应类型与氧化还原反应的关系。
二、学习要点
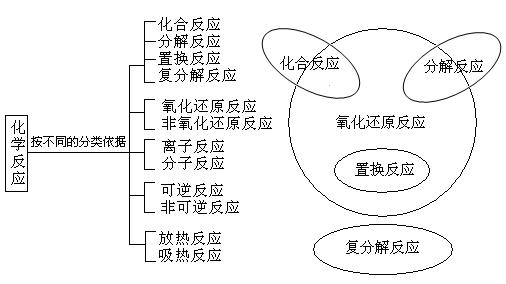
1. 化学反应的分类及依据
2、氧化还原反应:氧化还原反应、氧化剂、还原剂、氧化产物、还原产物的概念,氧化还原反应与四种基本反应类型的关系,几种常见的氧化还原反应。
三、课程精讲
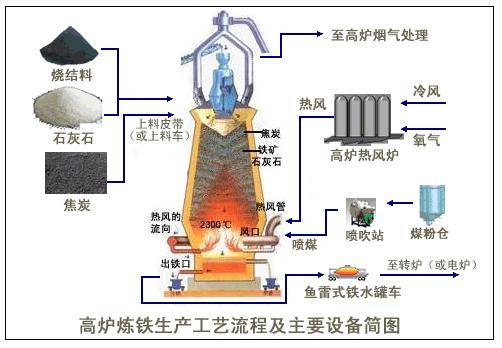
我们在初中学过高炉炼铁的原理:Fe2O3 + 3CO ![]() 2Fe + 3CO2,你知道该反应属于什么反应类型吗?你还知道在高炉中发生的其他反应吗?它们都属于什么类型的反应?
2Fe + 3CO2,你知道该反应属于什么反应类型吗?你还知道在高炉中发生的其他反应吗?它们都属于什么类型的反应?
知识点一:化学反应的分类及依据
1. 按照反应物与生成物的类别与种数的多少,化学反应可分为四种基本反应类型:化合反应、分解反应、置换反应、复分解反应。
|
类别 |
化合反应 |
分解反应 |
置换反应 |
复分解反应 |
|
定 义 |
由两种或两种以上物质生成一种物质的反应。 |
由一种物质生成两种或两种以上物质的反应。 |
由一种单质跟一种化合物反应生成另一种单质和另一种化合物的反应。 |
由两种化合物互相交换成分,生成另外两种化合物的反应。 |
|
表达式 |
|
|
|
|
|
举例 |
|
|
|
|
练习:指出下列化学反应各属于四种基本反应类型中的哪种类型。
(1)CuSO4
+ BaCl2=BaSO4↓+ CuCl2
(2)Fe + 2FeCl3=3FeCl2
(3)Zn + 2HCl=ZnCl2
+ H2↑
(4)Cl2 +
H2O=HCl + HClO
(5)CaCO3![]() CaO + CO2↑
CaO + CO2↑
(6)3Fe + 2O2![]() Fe3O4
Fe3O4
(7)CuO + H2SO4=CuSO4
+ H2O
(8)Fe + CuSO4=FeSO4 + Cu
(9)CaCO3 +
CO2 + H2O=Ca(HCO3)2
(10)Fe2O3
+ 3CO![]() 2Fe +
3CO2
2Fe +
3CO2
2. 按是否有电子转移划分:氧化还原反应、非氧化还原反应
3. 按是否有离子参加划分:离子反应(电解质在水溶液中进行的反应)、分子反应(非离子反应)
4. 按反应进行程度划分:可逆反应、非可逆反应
5. 按反应的热效应划分:放热反应、吸热反应
知识点二:氧化还原反应
用四种基本反应类型的分类方法分析:化学反应Fe2O3 + 3CO ![]() 2Fe + 3CO2属于哪种类型的反应?它不属于四种基本反应类型中的任何一种,四种基本反应类型并不能包括所有的化学反应。
2Fe + 3CO2属于哪种类型的反应?它不属于四种基本反应类型中的任何一种,四种基本反应类型并不能包括所有的化学反应。
1. 氧化还原反应的概念
人们常常根据化学反应过程中元素的化合价是否发生变化,将化学反应分为氧化还原反应和非氧化还原反应。例如,铁与硫酸铜溶液发生如下反应:Fe + CuSO4 = Cu + FeSO4,Fe转化为Fe2+,铁元素的化合价升高;Cu2+ 转化为Cu,铜元素的化合价降低。像这样有元素化合价发生变化的反应称为氧化还原反应,而元素化合价不发生变化的反应称为非氧化还原反应,如:CO2 + 2NaOH = Na2CO3 + H2O是非氧化还原反应。
在反应Fe + CuSO4 = Cu + FeSO4中,铁元素的化合价由0价变为+2价,化合价升高了,我们称铁发生了氧化反应;铜元素的化合价由+2价变为0价,化合价降低了,我们称铜发生了还原反应。我们把物质所含元素化合价升高的反应称为氧化反应,把物质所含元素化合价降低的反应称为还原反应。发生氧化反应的物质在反应过程中被氧化;发生还原反应的物质在反应过程中被还原。这两个截然相反的过程是在一个反应中同时发生的。也就是说,有一种物质被氧化,必然有一种物质被还原。例如,反应Fe + CuSO4 = Cu + FeSO4中,Fe发生了氧化反应,在反应过程中被氧化;CuSO4发生了还原反应,在反应过程中被还原。
讨论:指出下列反应哪些是氧化还原反应,哪些不是氧化还原反应,是氧化还原反应的指出是哪种物质发生了氧化反应,哪种物质发生了还原反应,哪种物质被氧化,哪种物质被还原。
(1)H2 + CuO ![]() Cu + H2O
Cu + H2O
(2)CaCO3
![]() CaO + CO2↑
CaO + CO2↑
(3)2Na + Cl2
![]() 2NaCl
2NaCl
我们知道,元素化合价的升降与电子的得失或偏移有密切关系。那么,氧化还原反应与电子的转移有关系吗?有什么关系呢?我们以反应2Na + Cl2![]() 2NaCl为例来分析。
2NaCl为例来分析。
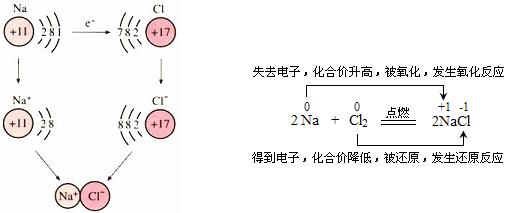
在氯气与氢气的反应中,由于生成的氯化氢是共价化合物,在电子转移过程中,两种元素的原子都没有完全失去或得到电子,它们之间只有共用电子对发生偏移,且共用电子对偏离氢原子而偏向氯原子。因此在HCl中,氢元素的化合价为+1价,氯元素的化合价为-1价。

综上所述,我们可以给氧化还原反应下一个更加本质的定义:有电子转移(得失或偏移)的反应都是氧化还原反应。
2. 氧化还原反应与四种基本反应类型的关系
为了帮助同学们理解和记忆,我们常常利用图表来描述一些知识间的关系。四种基本反应类型与氧化还原反应的关系如图:
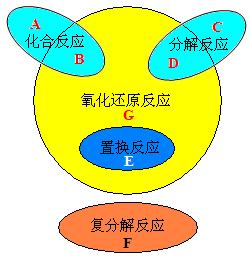
思考:你能列举出A、B、C、D、E、F、G中各部分的反应吗?
3. 氧化剂与还原剂的概念
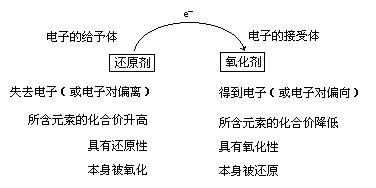
氧化剂和还原剂作为反应物共同参加氧化还原反应。在反应中,电子从还原剂转移到氧化剂。所以氧化剂是得到电子(或电子对偏向)的物质,在反应时所含元素化合价降低。氧化剂具有氧化性,发生还原反应,反应时本身被还原,其生成物为还原产物。还原剂是失去电子(或电子对偏离)的物质,在反应时所含元素化合价升高。还原剂具有还原性,发生氧化反应,反应时本身被氧化,其生成物为氧化产物。如:

氧化剂和还原剂是性质相反的物质,如图所示,它们作为反应物共同参加氧化还原反应。在反应中,还原剂把电子转移给氧化剂,即还原剂是电子的给予体,氧化剂是电子的接受体。
思考:对于反应Fe2O3
+ 3CO ![]() 2Fe + 3CO2,你能指出其中的氧化剂、还原剂、氧化产物、还原产物吗?
2Fe + 3CO2,你能指出其中的氧化剂、还原剂、氧化产物、还原产物吗?
在初中化学中,我们接触到的氧化剂有哪些?还原剂有哪些?
4. 几种常见的氧化还原反应
(1)金属活动性顺序表中,金属单质间的置换反应。
Fe + CuSO4 =
FeSO4 + Cu
(2)稀硫酸与活泼金属单质反应时,是氧化剂,起氧化作用的是+1价的H元素,反应后生成H2,如:Fe + H2SO4(稀)= FeSO4 + H2↑
而浓硫酸是强氧化剂,与还原剂反应时,起氧化作用的是+6价的S元素,反应后一般生成SO2,如:2H2SO4(浓)
+ C ![]() 2SO2↑ + CO2↑ + 2H2O
2SO2↑ + CO2↑ + 2H2O
(3)不论是稀硝酸还是浓硝酸,它们都是强氧化剂,几乎能与所有的金属或非金属发生氧化还原反应。反应时,主要是+5价的N元素得到电子,被还原成NO2、NO等。如;
4HNO3(浓)
+ C ![]() CO2↑ + 4NO2↑ + 2H2O
CO2↑ + 4NO2↑ + 2H2O
8HNO3(稀)
+ 3Cu = 3Cu(NO3)2 + 2NO↑ + 4H2O
氧化还原反应是一类重要的化学反应。在工农业生产、科学技术和日常生活中都有广泛的应用。食物在人体中的消化,离不开氧化还原反应;煤的燃烧、酿酒、电镀、金属的冶炼等也离不开氧化还原反应。又如,我们初中制取O2、H2等也涉及到氧化还原反应。
有些氧化还原反应也会给人类带来危害,如易燃物的自燃、食物的腐败、钢铁的锈蚀等。我们运用化学知识来防止这类氧化还原反应的发生或减慢其进程。例如,可采用在钢铁表面喷漆等方法来防止钢铁锈蚀(即氧化还原反应)的发生。
【典型例题】
例1.
下列反应中,既属于化合反应,又属于氧化还原反应的是( )
A. ![]()
![]() B.
B.
![]()
![]()
C. ![]()
![]() D.
D.
![]()
![]()
思路导航:这是考查化合反应和氧化还原反应概念的一道题目。从化合反应的定义和氧化还原反应的特征即有元素化合价升降的基础上不难解答。
解答:从化合反应的概念可看出只有D符合其定义;并且D中的Fe元素化合价升高, O2中的O元素化合价降低,所以D是氧化还原反应。答案为D。
仿练:下列反应属于氧化还原反应的是( )
A. ![]()
![]()
B. ![]()
![]()
C. ![]()
![]()
D. ![]()
![]()
答案:AB
点津:概念区分题考查的是对概念的理解和把握,我们在学习时一定要找出概念的关键词语,并且用对比记忆的方法加深对概念的理解。
例2. 下列变化既不需要加入氧化剂也不需要加入还原剂的是( )
A. H2O→ H2 B. CO→CO2
C. Fe→Fe3O4 D. P→P2O5
思路导航:在反应中,如果物质所含元素化合价升高,则它作还原剂,反应时需要加入氧化剂;如果物质所含元素化合价降低,则它作氧化剂,反应时需要加入还原剂。但有些物质本身可以分解,既作氧化剂,又作还原剂。
解答:根据以上规律,A中,H2O可电解生成H2和O2,所以A在反应中既是氧化剂又是还原剂;B中,CO中C元素由+2价变为+4价,化合价升高,而且CO不能分解生成CO2,所以需要加入氧化剂反应才能发生;同样C、D中的Fe、P发生反应时也需要加入氧化剂。答案为A
仿练:下列变化需要加入还原剂才能实现的是( )
A. CaCO3 →CO2 B. Fe2+ →Fe3+
C. H+ →H2 D. SO42- →BaSO4
答案:C
点津:元素化合价的升降是氧化还原反应的特征,也是判断反应是否为氧化还原反应的依据。我们一定要根据这一特征准确判断氧化还原反应、氧化剂、还原剂、氧化产物、还原产物。
四、知识提炼导图:
五、目标期望:
通过对本讲课程的学习,我们要做到:(1)学会判断某一反应是四种基本反应类型中的哪一种;(2)会用化合价升降的方法判断某反应是否为氧化还原反应;(3)会根据要求写出符合分类条件的氧化还原反应;(4)能够找出氧化还原反应中的氧化剂、还原剂、氧化产物、还原产物;(5)能够写出常见的氧化剂和还原剂典型的化学方程式。
六、下讲预告:
下一讲我们将要学习物质间的相互转化,学习酸碱盐等各类物质之间的相互转化关系以及相应的化学反应方程式,通过方程式体会复分解反应发生的条件,学习常见金属的活动性顺序以及它在化学中的应用。希望同学们提前做好预习。
【同步练习】(答题时间:40分钟)
1. 下列反应中,属于氧化还原反应的是( )
A. CaCO3 + 2HCl = CaCl2 + CO2↑+H2O
B. CaO + H2O = Ca(OH)2
C. 2KMnO4 ![]() K2MnO4 + MnO2
+ O2↑
K2MnO4 + MnO2
+ O2↑
D. CaCO3
![]() CaO + CO2↑
CaO + CO2↑
2. 下列说法中错误的是: ( )
A. 化合反应不一定是氧化还原反应
B. 分解反应不一定是氧化还原反应
C. 置换反应一定是氧化还原反应
D. 复分解反应一定是氧化还原反应
3. 农药波尔多液不能用铁制容器盛放,是因为铁能与该农药中的硫酸铜起反应。在该反应中,铁( )
A. 是氧化剂 B. 是还原剂 C. 被氧化 D. 被还原
4. 下列反应中,HCl作氧化剂的是( ),HCl作还原剂的是( )
A. NaOH + HCl = NaCl + H2O
B. Zn + 2HCl = ZnCl2 + H2↑
C. MnO2 + 4HCl ![]() MnCl2 + 2H2O + Cl2↑
MnCl2 + 2H2O + Cl2↑
D. CuO + 2HCl = CuCl2 + H2O
5. 对于化学反应![]() =
=![]() 的下列说法中,正确的是( )
的下列说法中,正确的是( )
A. 若C、D分别为单质和化合物,则该反应一定是置换反应
B. 若C、D分别为盐和水,则该反应一定是中和反应
C. 若A、B、C、D都是化合物,则该反应一定是复分解反应
D. 若A为碱溶液,B为盐溶液,则C和D可能是两种沉淀
6. 在化学反应中,如果反应前后元素化合价发生变化,就一定有______转移,这类反应就属于___________反应。元素化合价升高,表明这种物质________电子,发生________反应,这种物质是_________剂;元素化合价降低,表明这种物质________电子,发生________反应,这种物质是_________剂。
7. 在高温时,水蒸气与灼热的炭发生氧化还原反应的化学方程式是________________,其中,水是__________剂。硫在氧气中燃烧的化学方程式是_____________________,其中,硫是____________剂。
8. 氢氧化钾是我国古代纺织工业常用作漂洗的洗涤剂,古人将贝壳(主要成分是碳酸钙)灼烧后的固体(主要成分是氧化钙)与草木灰(主要成分是碳酸钾)在水中相互作用,就生成了氢氧化钾,请按要求用化学方程式表示上述反应:
(1)分解反应
。
(2)化合反应
。
(3)复分解反应
。
9. 用化学方程式表示在一定条件下下列物质间的转化关系。指出哪些是氧化还原反应,哪些是非氧化还原反应。对于氧化还原反应,指出氧化剂和还原剂。
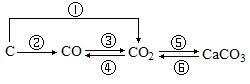
10. 按下列要求选择适宜的物质进行反应,写出反应的化学方程式。(各举一例)
(1)单质为还原剂。
(2)单质为氧化剂。
(3)氧化剂和还原剂为同一种物质。
(4)氧化产物和还原产物为同一种物质。
![]()
【试题答案】
1. C 2. D 3. BC 4. BC 5. D
6. 电子;氧化还原;失去;氧化;还原;得到;还原;氧化
7. C + H2O
![]() CO + H2 ;氧化;S + O2
CO + H2 ;氧化;S + O2 ![]() SO2 ;还原。
SO2 ;还原。
8. (1)CaCO3 ![]() CaO + CO2↑
CaO + CO2↑
(2)CaO + H2O = Ca(OH)2
(3)Ca(OH)2 + K2CO3 = CaCO3↓+ 2KOH
9. ① C + O2 ![]() CO2 氧化还原反应;O2是氧化剂,C是还原剂
CO2 氧化还原反应;O2是氧化剂,C是还原剂
② ![]() 2CO 氧化还原反应;O2是氧化剂,C是还原剂
2CO 氧化还原反应;O2是氧化剂,C是还原剂
③ 2CO + O2 ![]() 2CO2 氧化还原反应;O2是氧化剂,CO是还原剂
2CO2 氧化还原反应;O2是氧化剂,CO是还原剂
④ CO2 + C ![]() 2CO 氧化还原反应;CO2是氧化剂,C是还原剂
2CO 氧化还原反应;CO2是氧化剂,C是还原剂
⑤ CO2 + Ca(OH)2 = CaCO3↓+H2O 非氧化还原反应
⑥ CaCO3 + 2HCl = CaCl2 + CO2↑+ H2O 非氧化还原反应
10. (1)Zn +2HCl = ZnCl2 + H2↑
(2)2CO + O2 ![]() 2CO2
2CO2
(3)2H2O
![]() 2H2↑+ O2↑
2H2↑+ O2↑
(4)2Na + Cl2
![]() 2NaCl
2NaCl