![]()
一、学习目标
1、复习原子的构成,懂得质量数和![]() 的含义。
的含义。
2、掌握核外电子的排布规律,能熟练地画原子结构示意图。
3、从结构的角度来分析离子化合物和共价化合物。
4、学会使用电子式表示粒子及化合物的组成。
二、学习要点
1、原子结构
2、原子核外电子排布:排布规律、化合物的形成
3、电子式
三、课程精讲
1911年,英国物理学家卢瑟福用一束带正电荷的α粒子轰击金箔时,发现大多数α粒子能穿透金箔,而且不改变原来的前进方向,但也有一小部分α粒子改变了原来的运动路径,甚至有极少数α粒子好像碰到了坚硬不可穿透的质点而被弹了回来。

卢瑟福提出了“核式原子模型”,较好的解释了原子核与核外电子的关系,那么,原子核内部的结构是怎样的?核外电子又是如何运动的?
知识点一:原子的结构
在初中化学中我们学习了构成物质的基本微粒有原子、分子和离子。分子是构成物质的一种微粒,如氢气、水、二氧化碳气体等都是由分子构成的。分子是由原子结合而成的,如水分子是由氢原子氧原子结合而成的。原子不但可以结合成分子,还能直接构成物质,如铁、铜等金属和稀有气体氦、氖等都是由原子直接构成的。那么原子可不可以再分?

(1)核电荷数
= 质子数= 核外电子数
(2)质量数(A)= 质子数(Z)+ 中子数(N)
(3)原子组成的表示方法:![]()
(4)原子的全部质量几乎都集中在原子核上。所以数值上,原子的质量数近似等于它的相对原子质量。
相对原子质量:以一种碳原子的质量的1/12作为标准,其他原子的质量与这一标准相比较所得的数值,称为这种原子的相对原子质量。
(5)元素是具有相同核电荷数(即质子数)的一类原子的总称。同一种元素的原子具有相同的质子数,但中子数不一定相同。如氢元素存在氕(11H)、氘(12H)、氚(13H)三种原子,它们的原子核内都含有1个质子,中子数分别为0、1、2。我们把具有一定质子数和一定中子数的一种原子称为一种核素。把质子数相同、中子数(质量数)不同的核素互称为同位素。
【典型例题】
例1. 不同元素之间的本质区别在于( )
A. 相对原子质量不同 B.
核外电子数不同
C. 核电荷数不同 D.
核内中子数不同
思路导航:考查元素的定义,原子的组成等知识,对这部分要注意它们之间的关系。
解答:由元素的定义可知,元素是具有相同核电荷数的一类原子的总称,不同元素的本质区别是核电荷数不同。故选C
仿练:2004年温家宝总理批示:严查安徽“杀人奶粉”。经检测,“杀人奶粉”中蛋白质、钙、磷、锌、铁等的含量严重不足,营养价值比米汤还差。这里的“钙”“磷”“铁”“锌”是指( )
A. 分子 B.
原子 C.
离子 D.
元素
答案:D
点津:这部分是识记内容,一定要在理解的基础上记准确,特别是定义的关键词语,要多体会。
例2. 碘元素的一种核素12553I可用于治疗肿瘤。该核素的质子数为____,中子数为_____,质量数为_______,核外电子数为___________。
思路导航:考查质子数、中子数、电子数、质量数等概念的关系。
解答:从核素12553I的组成上看,质子数为53;中子数为质量数与质子数的差即125-53=72;质量数为125;原子的核外电子数与质子数相同,为53。
仿练:试用质子数、中子数、电子数、质量数和同位素填空:
(1)
(2)
(3)
(4)157N与147N互为_______。
答案:(1)中子数;(2)质子数、电子数;(3)质量数;(4)同位素
点津:了解原子的组成Z A
X的含义,掌握两个关系:(1)核电荷数
= 质子数= 核外电子数;(2)质量数(A)=
质子数(Z)+
中子数(N)
知识点二:原子核外电子的排布
原子核外的电子在核外空间做高速运动。含多个核外电子的原子中,电子运动的主要区域离核有远有近,在离核较近的区域运动的电子能量较低,在离核较远的区域运动的电子能量较高,即电子在原子核外是分层排布的。我们把核外电子运动的不同区域看成不同的电子层,由内向外依次为1、2、3、4、5、6、7……,分别称为K、L、M、N、O、P、Q……电子层。
写出下列元素的原子结构示意图。(N O
Na Al S )

核外电子排布遵循的规律:
(1)能量最低原则:核外电子总是先排布在能量最低的电子层里,然后再由里往外,依次排布在能量逐步升高的电子层里。
(2)排布规律:A、各电子层最多容纳的电子数为2n2;B、最外层电子数目不超过8个(K层为最外层则不超过2个);C、次外层电子数目不超过18个,倒数第三层电子数目不超过32个。
分别写出He、Ar、Na、Mg、F、Cl的原子结构示意图。

分析可以得出:He最外层电子数是2个、Ar最外层电子数是8个,达到饱和,它们的化学性质非常稳定,一般不和其他的物质发生化学反应。因此,若最外层达到饱和,这样的结构是最稳定的。而Na、Mg、F、Cl等元素的原子最外层没有达到饱和,化学性质不稳定,怎样才能达到稳定结构呢?
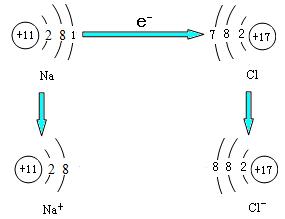
在化学反应中,金属元素的原子较容易失去最外层电子,达到8个电子的稳定结构;非金属元素的原子比较容易获得电子,使最外层通常达到8个电子的稳定结构。因此,元素的化学性质和它的最外层电子数目关系密切。
上图中,形成的Na+和Cl-带相反的电荷,它们之间会通过静电作用结合在一起。像这样带相反电荷的阴、阳离子结合的相互作用,称为离子键。阴阳离子之间通过离子键形成的化合物叫做离子化合物。
写出Mg2+、Al3+、S2-、F-的离子结构示意图:
我们知道,氯气、氯化氢等都是由分子构成的物质。两个氯原子可以结合成一个氯分子,一个氯原子和一个氢原子可以结合成一个氯化氢分子。它们的分子中的原子都达到稳定结构了吗?
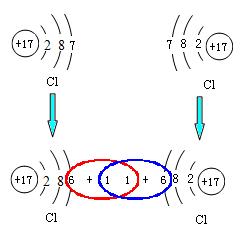
所以说,当两种非金属元素相互化合时,原子间共用最外层上的电子,形成共用电子对,以达到稳定的电子层结构,共用电子对同时受到两个原子核的吸引。像这样,原子间通过共用电子对所形成的强烈的相互作用称为共价键。原子间通过共价键形成的化合物叫共价化合物。
【典型例题】
例1. 下列原子结构示意图中,正确的是( )

思路导航:要正确画出原子结构示意图,必须了解核外电子的排布规律。
解答:核外电子排布规律要求每层容纳的电子数最多为2n2个,所以第一层不超过2个,第二层不超过8个;另外,最外层不超过8个(K层为最外层则不超过2个)。所以A、D错误;C中的原子核内质子数与核外电子数不相等,不是原子的结构,C错;所以B正确。
仿练:某元素原子的原子核外有三个电子层,最外层有4个电子,该原子核内的质子数为( )
A. 14 B.
答案:A
点津:对于核外电子的排布规律,要在理解的基础上记忆,并多用多体会。
例2. 下列各数值表示有关元素的质子数,其所表示的各原子组中能以离子键相互结合成稳定化合物的是( )
A. 10和9 B. 6和
思路导航:能否形成稳定化合物,是以什么方式形成的,这要根据原子的核外电子排布情况而定,所以要画出原子结构示意图。
解答:A中原子的核外电子的排布:一个是2,8;一个是2,7;由于2,8的排布已经是稳定结构,所以不可能以离子键结合。A错;同理,B中一个是2,4;一个是2,8,6;二者也不可能有电子的得失而形成离子键,B错;C中一个是2,8,1;一个是2,8,7;前面原子的最外层电子失去,而后面的原子得到电子,形成阴、阳离子,可以离子键结合,C正确。同B,D也不能进行电子的得失而以离子键结合。所以答案为C。
仿练:下列物质中,是通过离子键结合成稳定结构的是( )
A. NaCl B. HCl C.
H2 D.
H2O
答案:A
点津:离子键、共价键的形成要从原子的核外电子排布角度去理解,这样才会深刻,所以掌握原子的核外电子排布规律十分关键。
知识点三:电子式
在元素符号周围用“•”或“×”来表示原子的最外层电子,以简明地表示原子、离子的最外层的电子排布,这种式子称为电子式。用电子式还可以表示化合物的组成。
(1)原子的电子式:写出Na、Cl、Mg、F的电子式。
(2)阳离子的电子式:写出Mg2+、Al3+的电子式。
(3)阴离子的电子式:写出Cl- 、S2-的电子式。
(4)离子化合物的电子式:写出NaCl、Na2O的电子式。
(5)共价化合物的电子式:写出H2、H2S的电子式。
【典型例题】
例、下列粒子的电子式书写正确的是( )
![]()
思路导航:正确书写电子式,要理解离子键、共价键的形成过程。注意离子化合物和共价化合物的电子式的区别。
解答:NaCl是离子化合物,由阴阳离子组成,A错;Cl原子最外层有7个电子,而B没有正确表示,B错;HCl是共价化合物,原子是通过共价键结合在一起的,而不是离子键,C错;H原子最外层有一个电子,与另外一个氢原子共用一对电子,D正确。
仿练:X元素的1个原子失去1个电子,该电子转移到Y元素的1个原子中去,形成结构稳定的离子化合物,则它的电子式为___________。
答案:![]()
点津:根据电子式的定义,熟练掌握各种粒子的电子式的书写,特别是离子化合物和共价化合物的电子式,并体会离子化合物和共价化合物的形成过程。
四、知识提炼导图:

五、目标期望:
通过本讲的学习,我们要做到:(1)会根据原子的组成,说出ZA X中各部分的含义;(2)学会质量数、质子数、中子数之间的换算关系;(3)会根据核外电子的排布规律,画出原子结构示意图;(4)学会判断离子化合物和共价化合物;(5)学会使用电子式表示各种粒子;(6)学会使用电子式判断物质中的各原子是否达到稳定结构。
六、下讲预告:
我们在下讲将要学习物质的分类,了解众多物质是如何分类的及分类的依据;学习判断物质所属类别的方法;学习物理性质和化学性质的涵义及研究方法;学习几种重要物质的性质和用途,从而体会性质决定用途的思想。希望同学们做好课前预习!
【同步练习】(答题时间:35分钟)
1、据报道,一高校对某城市湖底淤泥的一项调查实验表明,底层沉积的淤泥中铅、镍、铬、锌等重金属含量,已经超过了城市的土壤的重金属含量。这里提到的铅、镍、铬、锌是指( )
A. 元素 B. 原子 C. 分子 D. 单质
2、1991年,我国著名化学家张青莲教授与另一位科学家合作,测定了铟(In)元素的相对原子质量的新值。铟元素的核电荷数为49,相对原子质量为115,铟原子的中子数为( )
A. 115 B.
3、原子是构成物质的一种粒子,下列关于原子结构的叙述错误的是( )
A. 原子核中的质子数决定元素种类
B. 原子核外的最外层电子与物质的化学性质密切相关
C. 在化学变化中,原子核外的电子没有发生改变
D. 原子核中的质子数和中子数之和可看成相对原子质量
4、构成原子核的不可缺少的微粒是( )
A. 质子 B.
中子 C.
质子和中子 D. 电子
5、已知一个碳-12原子的质量为n㎏,一个R原子的质量为m㎏,则R原子的相对原子质量为( )
A. m/n B.
n/m C.
m/12n D.
12m/n
6、R2+ 离子核外有10个电子,其核内质子数是( )
A. 10 B. 12
C. 20 D.
24
7、在H2O、H2、O2、H、O、H+、O2- 七种微粒中,属于分子的是________,属于原子的是_________ ,属于离子的是____________。H和H+两种微粒相同的是________,不同的是____________________________________(至少各说出一条)。
8、在63Li、147N、2311Na、2412Mg、73Li、146C中:
(1)______和______互为同位素;
(2)______和______的质量数相等,但不能互为同位素;
(3)______和______的中子数相等,但质子数不相等,所以不是同一种元素。
9、下列6种物质中:①H2;②NaCl;③KOH;④Cl2;⑤MgCl2;⑥H2O
(1)只含有离子键的是__________;
(2)只含有共价键的是__________;
(3)既含有离子键又含有共价键的是__________________。
10、有A、B、C三种粒子:已知A带1个单位负电荷,其核外电子排布与氩原子相同;B粒子的第一、第三两电子层的电子数相等;每个C粒子中有3个原子核,其质子数总和为10。
(1)写出A、B、C的符号:A ,B ,C 。
(2)B粒子的原子结构示意图是
,A粒子的核电荷数是 。
11、2H、2H+、H2、21H都可以表示氢,它们有什么区别?
12、比较氯分子、氮分子的电子式,两种分子中每个原子的最外电子层是否都具有8电子的稳定结构?
【试题答案】
1、A 2、C 3、C 4、A 5、D 6、B
7、H2O、H2、O2;H、O;H+、O2- ;质子数、核电荷数;核外电子数
8、(1)63Li、73Li;(2)147N、146C;(3)2311Na、2412Mg
9、(1)②⑤;(2)①④⑥;(3)③
10、(1) A为Cl- ,B为Mg,C为H2O。 (2) ,17
,17
11、2H表示2个氢原子;2H+表示2个氢离子;H2表示1个氢分子是由2个氢原子组成的;21H表示氢元素的一种核素,它的原子核中有1个质子和1个中子。
12、氯分子、氮分子的电子式分别为:![]() ,可以看出两种分子中每个原子的最外电子层都具有8电子的稳定结构。
,可以看出两种分子中每个原子的最外电子层都具有8电子的稳定结构。