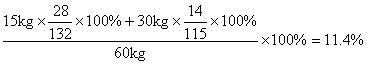![]()
【本讲教育信息】
一、教学内容:
中考第二轮复习——专题三:物质构成的奥秘
二、学习目标:
1. 认识物质的三态及其转化。认识化学物质种类多样及其原因。
2. 能从物质的组成、结构、性质的共同点对物质进行分类和辨别。
3. 认识物质的微粒性,明确构成物质的微粒间的联系、区别、共同特点。能用微粒的观点认识、思考和解释常见的宏观现象和变化。
4. 知道原子的构成,原子和分子、原子和离子的关系。初步认识电子在化学反应中的作用。
5. 了解元素的定义,知道元素的简单分类。记住常见元素的名称和符号。通过元素周期表,认识元素之间的内在联系。形成“化学变化中元素不变”的观念。
6. 说出几种常见元素的化合价。能用化学式表示某些常见物质的组成。能根据化学式进行物质组成的简单计算。能看懂某些商品标签上标示的物质成分及其含量。
三、全面突破
知识专题(一):化学物质的多样性
(一)物质的存在三态及其转化(以水为例)
在自然界中,水的存在状态有三种:水蒸气、水、冰,这三种状态的水在一定条件下可以相互转化。
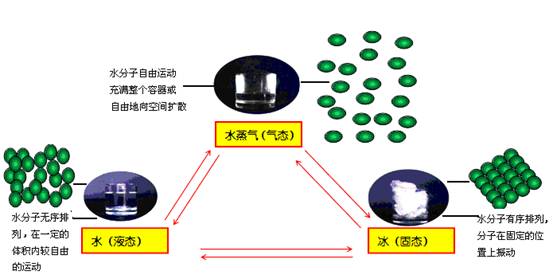
明确:微粒能量的变化,导致微粒运动速率的变化以及微粒之间间隔的变化,最终导致物质状态的变化。
(二)物质的分类
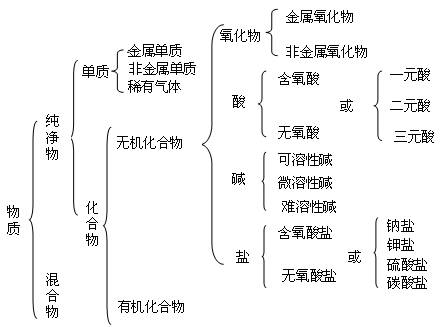
要求:明确分类依据
分类标准不同,物质的类别也不同,对物质分类可依据物理性质、化学性质、物质种类、组成元素的种类等不同标准进行。
(三)物质的多样性
元素种类不同、分子构成不同、原子的排列方式不同是形成物质种类多样的原因。
【典型例题】
例1. 生活中的下列现象,用分子的相关知识解释不正确的是 ( )
A. 湿衣服晾在太阳底下干得快,说明分子运动速率与温度有关
B. 成熟的菠萝会散发出浓浓的香味,说明分子在不断地运动
C. 水沸腾时,掀起壶盖,说明分子大小随温度升高而增大
D. 液化石油气须加压后贮存在钢瓶中,说明分子之间有间隙
解析:分子是不断运动的,温度越高,分子运动得越快,故A正确;我们能够闻到气味,也是由于分子运动的关系,故B正确;分子之间有空隙,气体的分子空隙最大,将气体进行压缩,就是使气体分子之间的空隙减小,故D正确;水沸腾是由液态变成气态,分子间距离增大,而分子本身大小并没改变,故C错误。
答案:C
例2. 下列各图中“○”和“●”分别表示两种质子数不同的原子,其中能表示由两种化合物组成的混合物的图是 ( )
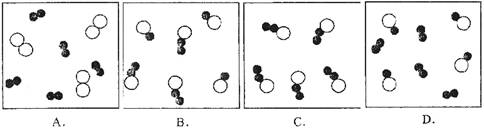
解析:以微观粒子图示法来考查物质的组成及分类,是中考常见题型。
答案:B
例3. 现有C、H、O、Na、Cu、S六种元素,从中选出相关元素组成下列类别物质的化学式:(每一类各写两例)
(1)单质_____________ (2)酸_____________ (3)碱_____________
(4)盐_____________ (5)氧化物_________ (6)有机物_____________
解析:上述六种元素的两种或几种元素可形成多种氧化物、酸、碱、盐、有机物、单质,书写时要正确把握各类物质的特征和概念,正确写出化学式。
答案:⑴O2、Cu;⑵H2SO4、H2CO3;⑶NaOH、Cu(OH)2;⑷Na2CO3、CuSO4;⑸H2O、Na2O;⑹CH4、C2H5OH
知识专题(二):微粒构成物质
(一)物质的微粒性
自然界的物质是由微粒构成的, 、 、 是构成物质的三种基本微粒。
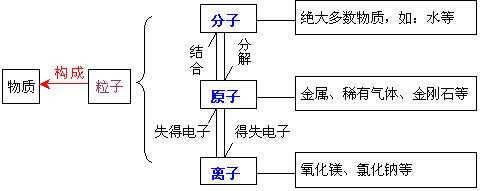
(二)原子
1. 原子的结构

原子中:核电荷数 = 数 = 数
相对原子质量≈质子数 + 中子数。
阳离子:核电荷数=质子数>核外电子数
阴离子:核电荷数=质子数<核外电子数
(三)分子、原子、离子的区别与联系
|
|
分 子 |
原 子 |
离 子 |
|
|
区 别 |
概 念 |
保持物质 性质的 微粒 |
是化学变化中的 微粒 |
带电的 或 |
|
化学变 化中是 否可分 |
在化学变化中 分,变化前后种类和数目可能发生变化。 |
在化学变化中 分,变化前后种类和数目不发生变化。 |
在化学变化中单原子离子一般不可分,但原子团构成的离子可能分割成其他离子、原子或分子。 |
|
|
是否独 立存在 |
能独立存在,构成物质并保持物质的化学性质不变。 |
有些能独立存在,并直接构成物质,且能保持物质的化学性质不变。 |
阴阳离子共同构成物质。 |
|
|
构 成 |
同种原子或不同种原子通过共用电子对形成,且纯净物中仅含有一种分子。 |
一般由 、 和核外电子三种微粒构成。 |
由原子得失电子形成,原子得到电子带 电荷成为 离子,原子失去电子带 电荷,成为 离子。 |
|
|
所显电 性情况 |
电性 |
电性 |
阴离子:带 电荷 阳离子:带 电荷 |
|
|
表 示 方 法 |
用 (分子式)表示 |
用 或原子结构示意图表示。 |
分别以阴、阳离子符号或离子结构示意图表示。 |
|
|
联 系 |
在化学 反应中 的表现 |
分子 |
||
|
表 达 方 法 |
均为微观粒子,既可讲个数,又可讲种类。 |
|||
|
基 本 属 性 |
体积 ,质量 ,都是在不断 的,微粒之间有 。同种微粒 相同,不同种微粒性质不同。 |
|||
【典型例题】
例4. 参考下列物质的微观结构图示,其中由阴、阳离子构成的物质是( )
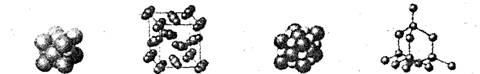
A. 铜 B. 干冰 C. 氯化钠 D. 金刚石
解析:铜属于金属,由原子构成;干冰是二氧化碳的固体,由分子构成;氯化钠属于离子化合物,由钠离子和氯离子构成;金刚石属于固态非金属,由原子构成。
答案:C
例5. 1911年著名物理学家卢瑟福为探索原子的内部结构进行了实验。在用一束带正电的、质量比电子大得多的高速运动的α粒子轰击金箔时发现:
(1)大多数α粒子能穿透金箔而不改变原来的运动方向;
(2)一小部分α粒子改变了原来的运动方向;
(3)有极少部分α粒子被弹了回来。
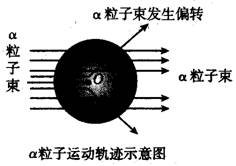
下列对原子结构的认识错误的是( )
A. 原子核体积很小 B. 原子核带正电
C. 原子内部有很大的空间 D. 原子是实心的球体
解析:大多数α粒子能穿过金箔而不改变原来的运动方向,说明原子核体积很小,核外有相对较大的空间;一小部分α粒子改变了运动方向,说明原子核带正电;极少数α粒子被弹了回来,说明原子核体积小但质量相对较大。该实验说明,原子是有一定的内部结构的,不是一个实心的球体,故D错。
答案:D
知识专题(三):认识化学元素
(一)元素
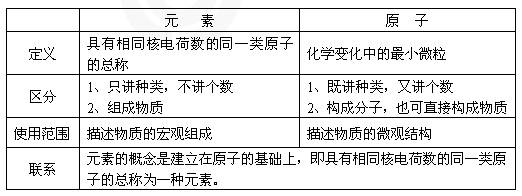
1. 定义:具有相同核电荷数的同一类原子总称为元素。
有些原子质子数相同,但中子数不同,如氢原子有氕、氘、氚三种,另外,H与H+ 都属于氢元素。
2. 地壳中含量最多的四种元素依次是:氧O、硅Si、铝Al、铁Fe
生物细胞中居前四位的元素为:氧O、碳C、氢H、氮N
3. 构成物质种类最多的元素为:碳(C);使用最广泛的金属元素为:铁(Fe)
4. 元素与原子的比较
(二)元素符号
1. 元素符号的意义:(宏观)表示一种元素,(微观)表示这种元素的一个原子。
2. 识记常见元素的名称及符号。
(三)元素周期表
1. 元素周期表共有7个横行,18个纵行。每个横行叫做一个周期,每个纵行叫一个族,8、9、10共同组成一个族,共有16个族。
2. 元素的分类以及区分

说明:还可根据元素原子的最外层电子数目特点来分
3、在元素周期表中的分布:
元素周期表上对金属元素、非金属元素用不同颜色做了分区,金属元素在左下角,非金属元素在右上角,稀有气体元素分布在元素周期表的最右侧。
4. 原子序数:元素周期表按元素原子核电荷数递增的顺序给元素编了号,叫原子序数。
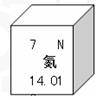
5. 下图是元素周期表中氮元素的示意图。
要明确:“
【典型例题】
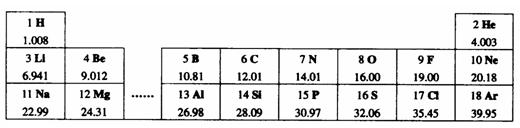
例6. 元素周期律是学习和研究化学的重要工具。下表是元素周期表的部分信息:
|
1H 氢 |
|
2He 氦 |
||||||
|
3Li 锂 |
4Be 铍 |
|
5B 硼 |
碳 |
7N 氮 |
8O 氧 |
氟 |
10Ne 氖 |
|
llNa 钠 |
12Mg 镁 |
|
铝 |
14Si 硅 |
15P 磷 |
16S 硫 |
氯 |
18Ar 氩 |
|
19K 钾 |
20Ca 钙 |
…… |
|
|
|
|
|
|
认真分析信息,回答:
(1)地壳中含量最多的金属元素的符号是
;
(2)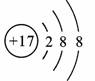 表示的是(填名称)
;
表示的是(填名称)
;
(3)由1、8、12号元素组成的化合物的化学式是
。
(4)上表中每一周期元素原子序数的变化规律是 。
解析:(1)地壳中含量最多的金属元素是铝,其元素符号为Al。(2)分析该结构示意图,核内质子数为17,但核外电子数是18,故为氯离子。(3)1、8、12号元素分别为H、O、Mg,组成化合物的化学式为Mg(OH)2。(4)每一周期元素原子序数的变化规律是从左向右依次递增1。
答案:(1)Al(2)氯离子(3)Mg(OH)2(4)从左向右依次递增1。
例7. 下图是元素周期表中硫元素的信息示意图,对图中信息理解错误的是( )
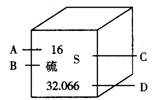
A. 原子序数 B. 元素名称 C. 元素符号 D. 中子数
解析:观察硫元素的信息图,硫元素的原子序数为“16”,元素名称为“硫”,元素符号为“S”,32.066是相对原子质量。
答案:D
知识专题(四):物质组成的表示
(一)化合价
1. 化合价的一般规律:
①化合价有正价和负价。要求:熟记常见元素和原子团的化合价
②一些元素在不同物质里可显不同的化合价,例:![]()
![]()
③在同一物质里,同一元素也可显不同的化合价,例:![]()
④在化合物里正负化合价的代数和为0
⑤在单质中,元素的化合价为0
2. 化合价的应用

(二)化学式
化学式的意义(以H2O为例)
定性:水由氢元素和氧元素组成
水由水分子构成
水分子由氢原子和氧原子构成
定量:1个水分子由2个氢原子和1个氧原子构成
水的相对分子质量为18
水中氢元素和氧元素的质量比为1:8
水中氢元素质量分数为11.1%
(三)化学式的有关计算(常见题型)
1. 计算物质的相对分子质量
2. 计算化合物中各元素的质量比
3. 计算化合物中某元素的质量分数
4. 计算一定量的化合物中某元素的质量
化合物里某元素的质量=化合物的质量×化合物中某元素的质量分数
5. 求化学式
6. 计算不纯物质中某元素(或某纯净物)的质量分数(杂质的组成中不含待求元素)
【典型例题】
例8. 据报道,用于清洗龙虾的“洗虾粉”中含有柠檬酸钠、亚硫酸钠(Na2SO3)等物质,可能对人体的健康产生危害。Na2SO3中S元素的化合价为 ( )
A. +6
B. +
解析:在Na2SO3中,钠元素的化合价为+1,氧元素的化合价为-2,根据化合物中正负化合价代数和等于零,设S的化合价为x,则有:(+1)×2+x+(-2)×3=0,解得x=+4。
答案:B
例9. 2008年北京奥运会主体育场的外形好似“鸟巢”,有一类物质也好似鸟巢,如化学式是B5H9的五硼烷(见下图)。
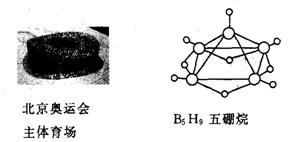
下列有关五硼烷的说法错误的是 ( )
A. 五硼烷属于化合物
B. 五硼烷的相对分子质量是64
C. 五硼烷中硼元素和氢元素的质量比为5:9
D. 1个五硼烷分子由5个硼原子和9个氢原子构成
解析:五硼烷属于化合物,A是正确的;五硼烷的相对分子质量=11×5+1×9=64,B是正确的;五硼烷中硼元素和氢元素的质量比为:11×5:1×9=55:9,C是不正确的;根据五硼烷的化学式B5H9知,D是正确的。
答案:C
例10. 某铁的氧化物中铁元素与氧元素的质量之比为21:8,求该铁的氧化物的化学式。
解析:设该铁的氧化物的化学式为FexOy,依题意可得
![]() 化学式为Fe3O4
化学式为Fe3O4
答案:Fe3O4
例11. 人体中钙元素主要以羟基磷酸钙晶体【Ca10(PO4)6(OH)2】(相对分子质量为1004)的形式存在于骨骼和牙齿中。牛奶含钙丰富又易吸收,且牛奶中含磷和钙比例适中,是理想的健骨食品。下图是某乳业公司纯牛奶包装标签上的部分文字,请仔细阅读后回答下列问题:

(1)包装标签上注明“脂肪≥
(2)求羟基磷酸钙晶体中钙元素的质量分数为
。
(3)若人体中每天至少需要
解析:该题考查学生能否看懂某些商品标签上标示的物质的有关信息,并对信息进行处理的能力。
(1)
(2)(40×10) ÷1004×100%=39.8%
(3)(
答案:(1)0.28(2)39.8%(3)2
四、考场清单
本专题知识在中考中的考查主要表现有以下特点:
借助考生熟悉的生活现象或学习经验,考查分子、原子的性质;结合微观粒子模型、卡通图、漫画等形式考查基本粒子之间的相互关系,离子、原子结构与符号的书写和辨析;以开放题、探究题的形式,结合粒子结构示意图、原子的结构、元素的分类知识考查元素周期表;物质的分类仍是考查的热点;对于元素,仍将以食品、医药、保健品等用品为背景,考查物质与元素的关系及物质的宏观组成与微观构成。近几年的中考中有关化学式的计算,内容涵盖面增大,体现了化学与社会生活、科学技术、环境保护、食品卫生、健康安全等方面的联系。
基本题型:选择题、填空题、实验探究题及计算题等
基本考点:
1. 化学物质的多样性
①物质的存在形态及物质的多样性 ②物质的分类
2. 微粒构成物质
①物质的微粒性 ②原子
3. 认识化学元素
4. 物质组成的表示
①化合价与化学式 ②化学式的有关计算 ③物质成分及其含量(标签问题)
五、本讲小结
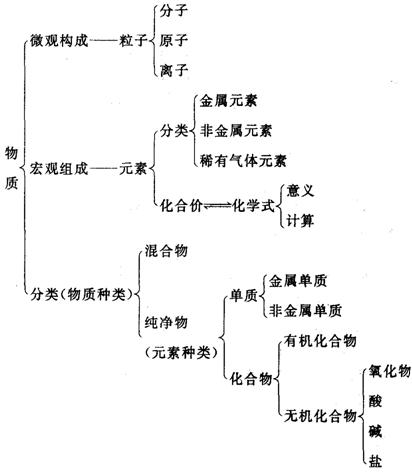
知识结构:
六、超前思维(中考第二轮复习——专题四:物质的化学变化)
(一)化学变化的基本特征
1. 物质的变化
2. 催化剂
(二)认识几种化学反应
1. 化学反应的基本类型
2. 金属活动性顺序
3. 化学反应在生活中的应用
(三)质量守恒定律
1. 质量守恒定律
2. 化学方程式
【模拟试题】(答题时间:45分钟)
相对原子质量:H
一、选择题
1. 水冷却后,除了会凝固成冰晶体外,还会形成玻璃态。它是由液态水急速冷却到-
A. 水由液态变为玻璃态,体积减小 B. 水由液态变为玻璃态,体积膨胀
C. 水由液态变为玻璃态是物理变化 D. 水由液态变为玻璃态是化学变化
2.
科学家发现某些原子具有放射性,即原子能自动地放射出一些固定的粒子。据此推断,当一种元素的原子经过放射变化后,结果变成了另一种元素的原子。它一定是放射了( )
A.
电子 B. 质子 C. 中子 D. 该原子的原子核
3. 对分子、原子、离子的下列认识,其中正确的是
( )
A. 氢原子是最小的微粒,不可再分
B. 镁原子的质子数大于镁离子的质子数
C. 元素间最本质的区别是中子数不同
D. 分子、原子、离子都可以直接构成物质
4. 下图是元素周期表中的一种元素,下列有关该元素的信息正确的是( )
A. 原子序数是 13 B. 它是非金属元素
C. 原子结构示意图为![]() D. 相对原子质量是13
D. 相对原子质量是13

5. 据报道,科学家发现了新的氢微粒。这种氢微粒由3个氢原子核(只含质子)和2个电子构成。下列说法中正确的是 ( )
A. 该微粒不显电性
B. 该微粒比一个普通H2分子相对分子质量多3
C. 该微粒的组成可用H3 表示
D. 该微粒比一个普通H2分子多一个氢原子核
6. 目前,科学家打算合成一种“二重构造”的球形分子,方法是把足球型的C60分子融进足球型的Si60分子中,使外面的Si原子与里面的C原子结合。下列与这种物质有关的一些说法中,错误的是(
)
A. 是由两种单质组成的混合物 B. 是一种新型化合物
C. 其相对分子质量为2400 D.
Si60分子的体积比C60分子大
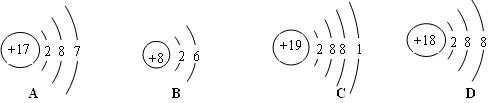
7. 钠原子结构示意图为 推测下列元素的单质与金属钠的化学性质相似的是( )
推测下列元素的单质与金属钠的化学性质相似的是( )
*8. 科学家发现在特殊条件下,水能表现出许多有趣的结构和性质。一定条件下给水施加一个弱电场,常温常压下水结成冰,俗称“热冰”,下图为其计算机模拟图。对此过程有以下描述:①水结成“热冰”的过程中原子个数发生变化;②上述变化过程中分子间间隔没有发生变化;③在弱电场下,水分子运动从无序转变为有序;④利用该性质,人们在常温常压下可建成溜冰场。其中完全正确的一组是( )
A. ①② B. ②③ C. ③④ D. ②③④

**9. 有MgSO4、Fe2(SO4)3、K2SO4三种的混合物,测得其中硫元素的质量分数为a%,则混合物中金属元素的质量分数为( )
A. (100-a)/3% B. (100-
C. 2(100-a)/3%
D.
(100-
*10. 超导材料为具有零电阻及反磁性的物质,以Y2O3、BaCO3和CuO为原料经研磨烧结可合成一种高温超导物质Y2Ba4Cu6Ox,假设在研磨烧结过程中各元素的化合价无变化,则x的值为(
)
A. 12 B.
二、填空题
11. 在化学晚会上,小林同学表演了一个化学小魔术“空瓶生烟”(如下图所示),A瓶中充满氯化氢气体,B瓶中充满氨气,抽开毛玻璃片,瓶中充满浓浓的白烟。请你根据所学知识回答下列问题:
(1)若用“![]() ”表示氢原子,用“
”表示氢原子,用“![]() ”表示氮原子,用“
”表示氮原子,用“![]() ”表示氯原子,上述反应过程可用下图表示为:
”表示氯原子,上述反应过程可用下图表示为:
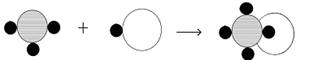
氨
氯化氢
氯化铵
(1)该反应的化学方程式为
。分析以上微观模拟图,你能得出的结论是
。(写一条)
(2)“烟”是由固体小颗粒形成的,如果这两个瓶子是质地较软的塑料瓶,我们将会观察到塑料瓶变瘪了,原因是 。
(3)生成物氯化铵是一种常见的化肥,它属于化肥中的________ 肥(填“氮”、“磷”、“钾”),此化肥不能与
混合使用。
12. 元素周期表是化学学习和研究的重要工具。下图是元素周期表的一部分。
(1)从表中查出硅(Si)元素的相对原子质量为
;
(2)6~11号元素中属于金属的有
(填元素符号);
(3)表中不同种元素最本质的区别是
(填序号):
A. 质子数不同
B. 中子数不同
C. 相对原子质量不同
(4)几年前,科学家宣布已人工合成了第116号元素,则此元素的核电荷数为
;
(5)仅由l、6、7、8号元素中的三种组成的一种盐的化学式为 。
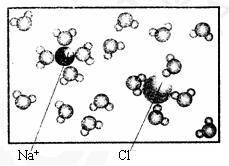
13. (1)下列微粒模型示意图可能代表水分子的是 (选填字母序号)。

*(2)利用(1)的结论,通过观察下图,试回答下列问题。
①框内代表的物质是
;
②框内NaCl质量分数为
;
③请描述框内离子与分子结合时的特点
。
*14. 在宏观物质、微观粒子和化学符号之间建立联系,是化学学科特有的思维方式。已知氢、碳、氧、钠、氯五种元素的荷电荷数分别为1,6,8,11,17。试按下列要求写出微观粒子的化学符号,以及由这种粒子构成的或含有这种粒子的一种物质的名称(微观粒子和物质所涉及的元素限定在上述5种元素内)。
|
需满足的条件 |
粒子的化学符号 |
对应物质的名称 |
|
(1)质子数为11的同种元素的原子和离子 |
|
|
|
|
|
|
|
(2)质子数均为10的两种不同的分子 |
|
|
|
|
|
|
|
(3)质子数为1的阳离子和质子数为9的阴离子 |
|
|
|
|
|
三、实验探究题
15. 探究蔗糖的组成元素。
(1)提出问题:蔗糖是我们常接触的一种食品,你是否想过蔗糖是由哪些元素组成的呢?
(2)猜想:生活中,我们偶尔会看见蔗糖在锅里加热时间过长,变成
色,因此,猜想蔗糖中含有碳元素,或许还有其他元素。
(3)收集资料:①蔗糖属于有机化合物(一般指含碳元素的化合物),所以蔗糖是____________(填“纯净物”或“混合物”)。有机化合物一般可以燃烧,受热容易分解,这都属于有机化合物的 (填“物理”或“化学”)性质。②化学反应的本质是
,因此,在化学反应前后,元素的种类
(填“变多”、“不变”或“变少”)。
*(4)设计实验:我们设计了这样两个方案:①将蔗糖在空气中点燃,单独点燃蔗糖,不易燃烧,但在蔗糖中掺入少量烟灰,蔗糖很容易被点燃,可见,烟灰可能在此起 作用。分别用干燥的玻璃片和蘸有澄清石灰水的玻璃片置于火焰上方,观察现象。②将蔗糖放在一密闭容器中加强热,观察现象。
(5)实验现象:分别观察到①的现象为
。②中的现象为
。
(6)实验结论:蔗糖是由
三种元素组成的(填元素符号)。
(7)讨论:实验①和②哪个更严谨,为什么?
。
16. 铝是重要的轻金属,广泛应用于航空、电讯和建筑等领域。铝亦有其特殊的性质,试根据以下信息填空或简答。
(1)按金属的活动性顺序,铝比锌 。但是将铝片和锌粒分别投入稀硫酸中,铝片表面产生的气泡却比锌粒少而慢。为了探究铝与酸反应的规律,小强将已被砂纸打磨过的相同大小的6枚铝片,分别放入下表所示溶液中进行实验。
|
溶液 |
现象 |
溶液 |
现象 |
溶液 |
现象 |
|
①稀硫酸 |
- |
③稀硫酸(加入少量Na2SO4固体) |
- |
⑤盐酸 (1 :4) |
+ |
|
②稀硫酸 (加热) |
+ |
④稀硫酸(加入少量NaCl固体) |
+ |
⑥盐酸 (37%) |
++ |
注:“-”表示铝表面产生气泡很小且慢;“+”表示铝表面产生气泡较大且快。“1:
根据上述表格内容,你认为铝与酸反应产生氢气的速率,除了跟酸溶液中氢离子浓度有关外,还可能受到 、 、 等多种因素的影响。
*(2)小芳将长条状铝片的一端放在酒精灯火焰上灼烧片刻,轻轻摇动铝条,受热一端会左右摇晃,却不像蜡烛那样滴落。为究其原因,小芳查阅资料得知:铝的熔、沸点分别是
请解释上述实验现象:
。
四、计算题
17. 下图是某包装袋上的部分文字说明。

(1)这袋奶粉中含蛋白质的质量为_______ g。
(2)这里的钙、铁、磷、锌指的是_______(填“分子”、“原子”或“元素”等)。
*18. 随着世界人口的增长,人类对粮食的需求量不断增大。俗话说,“庄稼一枝花,全靠肥当家。”农作物生长过程中,需求量最大的三种营养元素是 (填元素名称)。
某农民根据种植的农作物生长的情况,准备配制一种复合肥
![]()
【试题答案】
一、选择题
1. C 2. B 3. D 4. A 5. D
6. A 7. C 8. C 9. D 10. B
二、填空题
11. (1)NH3+HCl NH4Cl 每个氨分子由一个氮原子和三个氢原子构成(合理答案均可)
(2)由于反应物为气体,生成物为固体,使得瓶内气体压强变小,体积减小
(3)氮,碱性物质
12. (1)28.09 (2)Na (3)A (4)116 (5)NH4NO3
13. (1) B (2) ① 氯化钠溶液 ②15.3% ③ 钠离子与水分子中氧原子相互吸引,氯离子与水分子中氢原子相互吸引
14.
|
粒子的化学符号 |
对应物质的名称 |
|
Na |
金属钠 |
|
Na+ |
氯化钠(氢氧化钠 碳酸钠) |
|
H2O |
水 |
|
CH4 |
甲烷 |
|
H+ |
盐酸(碳酸) |
|
OH- |
氢氧化钠 |
三、实验探究题
15. (2)黑 (3)①纯净物 化学 ②分子分裂成原子,再重新组合成新分子 不变
(4)催化
(5)①石灰水变浑浊,干燥玻璃片上有水珠 ②器壁有水珠,蔗糖变为黑色固体
(6)C、H、O
(7)实验②,蔗糖在空气中燃烧,空气会提供氧,且空气中也有CO2和H2O。
16. (1)活动性强;温度 Cl-
SO42-;
(2)加热条件下,铝表面易被氧化成致密的高熔点氧化膜。这层膜可以将膜内熔融的铝包裹起来,而不会产生滴落现象。
四、计算题
17. (1)75;(2)元素
18. 氮、磷、钾
解析:(NH4)2SO4的质量为:
NH4H2PO4的质量为:
N元素的质量分数为: