![]()
【本讲教育信息】
一. 教学内容:
8.1 重要的酸
学习重要的酸(盐酸、硫酸、硝酸)的性质和用途
二. 重点、难点:
酸的化学性质
三.教学程序
第八章 生活中的酸碱盐

生活中经常用到酸碱盐
8.1 重要的酸
(一)盐酸、硫酸、硝酸的物理性质

|
|
盐酸(氢氯酸) |
硫酸 |
硝酸 |
|
颜色、状态 |
浓盐酸是无色液体,有酸味、有挥发性 |
浓硫酸为无色、粘稠、油状液体,密度较大 有吸水性、腐蚀性, |
浓硝酸为无色液体,易挥发,强腐蚀性,有特殊刺激性气味 |
|
打开瓶塞 |
在瓶口会形成白雾 |
在瓶口处无白雾 |
在瓶口会形成白雾 |
盐酸的用途
●盐酸能用于制造氯化锌等氯化物。
●在人的胃液里含有低浓度的盐酸,它具有以下的功用:
(1)促进胃蛋白酶起作用,使蛋白质容易水解从而被人体吸收;
(2)使二糖类物质如蔗糖、麦芽糖水解;
(3)杀菌。
●重要的化工原料
硫酸的用途
●硫酸大量用于清洗钢铁的表面。
●在肥料、冶金、石油精炼、农药、炸药、纺织、染料、塑料、油漆、电池、制革、颜料、药品和洗涤剂等工业中,处处都离不开硫酸。
●车用电池
硝酸的用途
●农药、化肥、炸药
(二)酸的化学性质:
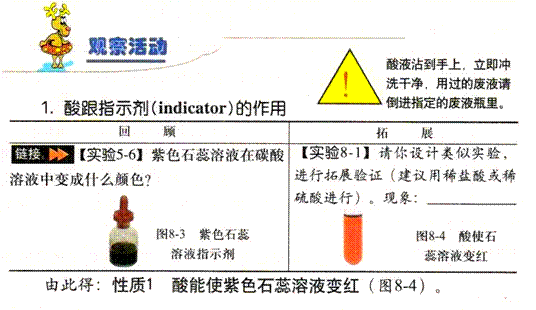
酸能使 紫 色石蕊试液变 红 色, 无 色酚酞试液 不变 色
2. 酸与金属的反应

金属+酸 → 盐+氢气
Zn+H2SO4
== ZnSO4 +H2↑ Fe+2HCl
== FeCl2 + H2↑
硫酸锌
氯化亚铁
3. 酸跟盐的反应
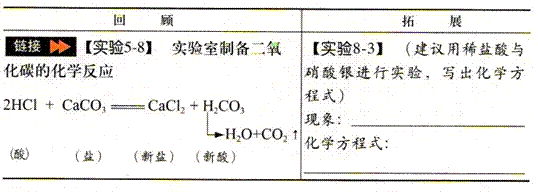
酸能跟某些盐起反应,生成另一种酸和另一种盐。
Na2CO3+H2SO4 = Na2SO4+H2O+CO2 ↑
HCl + AgNO3 = HNO3 + AgCl↓(白色)
4. 酸与金属氧化物的反应
【实验8—4】(1)在试管中,加入少量氧化铜粉末,再加入约2mL稀硫酸,在酒精灯上加热,不停振荡,观察变化情况。

观察现象___________________________________________________________
解释:氧化铜跟硫酸反应,生成硫酸铜和水。
![]()
(金属氧化物) (酸) (盐) (水)
(2)把生锈的铁钉浸入盛有稀盐酸溶液的试管中,过一段时间后,取出,洗净,并观察它的变化。

观察现象___________________________________________________________
解释:铁锈的主要成分是氧化铁,它跟盐酸反应后,生成氯化铁和水。
![]()
由此得:性质4
酸能跟某些金属氧化物反应,生成盐和水。
酸能跟金属氧化物起反应,生成盐和水。
金属氧化物+酸 → 盐+水
Fe2O3+3H2SO4 =Fe2(SO4)3+3H2 O CuO + 2HCl=CuCl2 + H2O
5. 酸与碱能反应吗?
[实 验]

[实验现象] 氢氧化钠溶液使酚酞变红,加入盐酸后,红色逐渐变浅,直至变成无色。
[反应原理]
NaOH + HCl = NaCl + H2O
碱 酸 盐 水
中和反应:酸和碱起反应,生成盐和水。
[练 习]
H2SO4 + NaOH =
H2SO4 + Cu(OH)2 =
H2SO4 + 2NaOH = Na2SO4 + 2H2O
H2SO4 + Cu(OH)2 = CuSO4 + 2H2O
复分解反应:由两种化合物互相交换成分,生成另外两种化合物的反应。
通式:AB + CD = AD + CB
酸与碱、酸与盐的反应都是复分解反应。
总结
|
加入物质 |
稀盐酸中发生的现象 |
稀硫酸中发生的现象 |
|
滴入紫色石蕊试液 |
变红 |
变红 |
|
滴入无色酚酞试液 |
不变色 |
不变色 |
|
镁 |
现象: 镁条溶解,产生大量气泡 |
现象:同左 |
|
Mg+2HCl=MgCl2+H2↑ |
Mg+H2SO4=MgSO4+H2↑ |
|
|
铝 |
现象: 铝溶解,产生大量气泡 |
现象:同左 |
|
2Al+6HCl=2AlCl3+3H2↑ |
2Al+3H2SO4=Al2(SO4)3+3H2↑ |
|
|
铁锈 |
现象: 铁锈溶解,生成黄色溶液 |
现象: 同左 |
|
Fe2O3+6HCl=2FeCl3+3H2O |
Fe2O3+3H2SO4=Fe2(SO4)3+3H2O |
|
|
氧化铜 |
现象: 氧化铜溶解,生成蓝色溶液 |
现象: 同左 |
|
CuO+2HCl=CuCl2+H2O |
CuO+H2SO4=CuSO4+H2O |
|
|
氢氧化钠 |
加入酚酞变红的氢氧化钠溶液,遇盐酸逐渐变无色 |
___________________________ |
|
硝酸银 |
生成白色沉淀 |
------------------------------------------- |

问题:为什么不同的酸会有相似的化学性质?
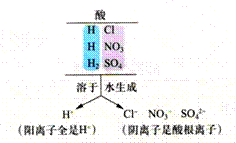
酸溶液中存在的阳离子全都是H+,这是酸具有通性的原因。
●浓硫酸的腐蚀性

强脱水性 (浓硫酸能使蔗糖、淀粉、纤维素等物质失水碳化)
强腐蚀性
强吸水性:浓硫酸可作干燥剂。
●浓硫酸的稀释
浓硫酸溶于水时,溶液的温度会升高。
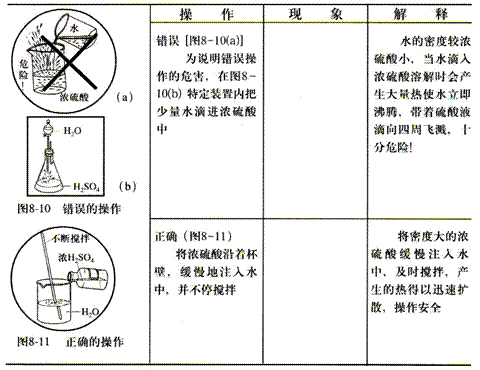
稀释浓硫酸时,应将浓硫酸沿着器壁慢慢注入水中,并不断搅拌,使产生的热量迅速的扩散。
【模拟试题】(答题时间:15分钟)
1、将一枚表面生锈的铁钉,浸泡在盛有足量稀盐酸的小烧杯中一段时间,能观察到的现象有_________________,发生反应的化学方程式是_________________。
2、在焊接铁制品前,常用稀盐酸处理,其主要原理可用下列哪一化学方程式表示( )
A.Fe + 2HCl = FeCl2 + H2↑ B.Fe2O3
+ 6HCl = 2FeCl3 + 3H2O
C.Fe(OH)3 + 3HCl = FeCl3 +
3H2O D.Fe2O3
+ 3H2 △ 2Fe
+ 3H2O
3、在所有能导电的溶液里,一定存在_____________;在酸的溶液里,一般存在_____________。
4、烧水的铝壶中常结有一层水垢(水垢的主要成分是CaCO3),用适量的稀盐酸可以除去它,反应的化学方程式是 。若盐酸的用量过多,会损坏铝壶,原因是(写化学方程式) 。
5、完全中和
![]()
【试题答案】
1、铁锈溶解,生成黄色溶液,一会铁钉表面有气泡生成;
Fe2O3 + 6HCl = 2FeCl3 + 3H2O
Fe + 2HCl = FeCl2 + H2↑
2、B
3、自由移动的离子;自由移动的氢离子和酸根离子。
4、CaCO3+2HCl=CaCl2+H2O+CO2↑;2Al+6HCl=2AlCl3+3H2↑
5、16%