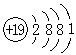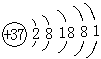![]()
【本讲教育信息】
一、教学内容
中考第一轮复习——基本概念和理论(三)——物质结构及化学用语
二、考点清单
1. 认识物质的微粒性,知道分子、原子、离子等都是构成物质的微粒。
2. 能用微粒的观点解释某些常见的现象。
3. 能从微观的角度对物质进行分类,知道常见物质的微观构成。
4. 知道分子、原子、离子之间的区别和联系。
5. 知道原子是由原子核和核外电子构成的,原子核一般是由质子和中子构成的。
知道原子中质子数、核电荷数与核外电子数的关系。
6. 熟悉常见的化学用语。
三、全面突破
知识点1:物质的微观构成
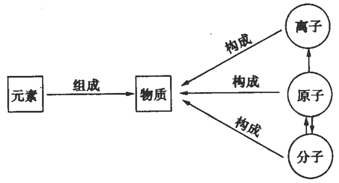
(1)纯净物是由同种或不同种元素组成的。
(2)大多数纯净物是由分子构成的,如氧气、水……
(3)少数物质是由原子构成的,如金属、金刚石、稀有气体等。
(4)还有少数物质是由离子构成的。如NaCl是由Na+和Cl-构成……
关键知识点拨:
(一)分子、原子、离子的关系
1.![]()
2. 
3. 三种粒子在化学变化中的关系:
![]()
(二)几个决定和几个等式
1. 决定
(1)质子数(或核电荷数)决定元素的种类。
(2)质子数和中子数决定相对原子质量。
(3)质子数与电子数的差决定粒子的类别和离子所带的电荷数。
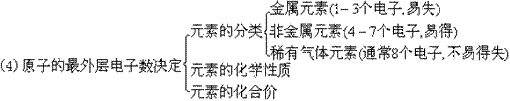
2. 等式
(1)质子数=核电荷数=电子数(在原子中)
(2)相对原子质量=质子数+中子数
(3)离子所带电荷数=其化合价数值
(4)元素最高正价数=原子的最外层电子数
(5)元素最低负价数=8-原子的最外层电子数
(6)原子团的化合价=其中各元素化合价的代数和
(三)化学变化和物理变化的本质区别
物理变化中分子本身不改变,只是分子间的间隔等发生变化;而化学变化中分子破裂为原子,原子重新组合成新物质的分子。
(四)物质的微观构成与宏观组成

【典型例题】
例1:下列关于分子的说法正确的是( )
A. 一切物质都是由分子构成的 B. 分子是化学变化中的最小粒子
C. 分子是不能再分的粒子 D. 分子是保持物质化学性质的最小粒子
【解析】构成物质的基本粒子有三种:分子、原子、离子。有些物质是由分子构成的,有些物质是由原子直接构成的,还有一些物质是由离子构成的,所以,A错。在化学变化中,分子可分为原子,而原子不能再分,故B、C错。
【答案】D。
例2:自第十一届奥运会以来,历届奥运会都要举行颇为隆重的“火炬接力”,火炬的可燃物是丁烷(化学式:C4H10),它燃烧时,火苗高且亮,在白天,
①丁烷是由碳、氢两种元素组成的
②丁烷由丁烷分子构成
③丁烷分子由碳、氢两种元素构成
④丁烷由4个碳原子和10个氢原子组成
⑤丁烷分子是由碳原子和氢原子构成的
A. ①②③④⑤ B. ①②⑤ C. ②③④⑤ D. ①②④⑤
【解析】从宏观上讲丁烷是由碳、氢两种元素组成的,从微观上讲丁烷是由丁烷分子构成的;每个丁烷分子由4个碳原子和10个氢原子构成. 或者说丁烷分子是由碳原子和氢原子构成的.
【答案】B
例3:根据下图所示的粒子结构示意图,回答问题:
![]()
![]()
![]()
![]()
![]()
![]()
(1)表示相对稳定结构的粒子是(填序号,下同)____。
(2)表示同一种元素的粒子是____。
(3)在化学反应中,易失去电子的粒子是____,易获得电子的粒子是____。
【解析】此题集识图、概念于一题,考查同学们对原子结构知识的掌握情况。对这部分知识关键要明了核电荷数与核外电子数是判断粒子属性的依据:核电荷数相同的粒子属于同种元素;最外层电子数为8的粒子属于稳定结构;最外层电子数少于4个,在化学反应中容易失去电子;最外层电子数多于4个,在化学反应中容易获得电子。
【答案】(1)BDF
(2)EF
(3)C、AE
例4:下列用微观图示表示的物质变化,属于化学变化的是
( )
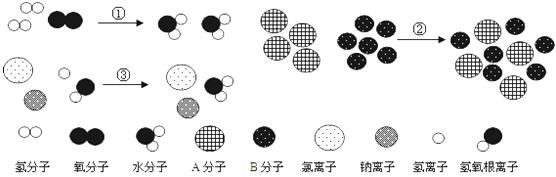
A. ①② B.
②③ C. ①③ D.
①②③
【解析】物理变化中分子本身不改变,只是分子间的间隔等发生变化;而化学变化中分子破裂为原子,原子重新组合成新物质的分子。
【答案】C
例5:某元素的硝酸盐的相对分子质量为M,该元素的硫酸盐的相对分子质量为N,则该元素的化合价可能为( )
A. ![]() B.
B. ![]() C.
C. ![]() D.
D.![]()
【解析】同种元素的相对原子质量在不同的化合物中是相同的,根据这一原理列代数方程可解得化合价的数值。但必须注意元素的化合价可能是奇数也可能是偶数,有两种情况需讨论。
设该元素为R,相对原子质量为a,化合价为x。
当x为奇数时,化学式为R(NO3)x、R2(SO4)x则:a+62x=M,
解得:![]()
当x为偶数时,化学式为R(NO3)x,![]() 则:a+62x=M,a+48x=N
则:a+62x=M,a+48x=N
解得:![]() 所以,答案为A、C
所以,答案为A、C
【答案】A、C
例6:锂(Li)、钠(Na)、钾(K)、铷(Rb)四种元素的原子结构、离子符号和元素的化合价如下表所示:
|
原子结构示意图 |
|
|
|
|
|
离子符号 |
Li+ |
Na+ |
K+ |
Rb+ |
|
元素化合价 |
+1 Li |
+1 Na |
+1 K |
+1 Rb |
请你分别从横向和纵向观察上表,写出其中的规律:___
_。
【解析】首先找准表中可以横向、纵向比较的内容。横向:(1)核电荷数、电子层数、最外层电子数;(2)离子所带电荷数;(3)元素的化合价。纵向可以比较上述三者之间的关系。
【答案】各元素原子的电子层数依次增加,最外层电子数相等;原子的最外层电子数与离子所带电荷数及化合价数相等。
知识点2:化学用语:
化学用语是高度浓缩的符号体系,可准确记录、表达、交流化学信息,是学好化学的重要工具,也是历年中考必考的内容之一。现就化学用语中所包含的信息(即化学用语的意义)进行归纳,希望能对同学们掌握这部分知识有所帮助:
(一)元素符号所含的信息
宏观信息:表示某种元素、有时还表示某种物质(单质)。
微观信息:表示该元素的一个原子。
例1:下列符号中,既能表示一种元素,又能表示该元素的一个原子,还能表示该元素组成的单质的是( )
A. Al B. N
【解析】N2不能表示元素和一个原子,Cl、H可表示一种元素和该元素的一个原子,但不能表示它所组成的单质。
【答案】A。
(二)化学符号周围小数字表示的信息
化学符号中数字所处位置主要有四处,位置不同,提供的信息(意义)也不同。
符号前:表示粒子个数,如元素符号、化学式、离子符号前的数字分别表示原子、分子、离子个数。
正上方:表示元素或原子团的化合价。
右上角:表示离子所带电荷数。
右下角:表示每个分子中所含原子或原子团的个数。
例2:指出下列符号中“2”的含义:
(1)2N__________;(2)N2__________;(3)H2O__________;(4)2CO__________;(5)![]() _________(6)Mg2+_________;(7)2H+__________。
_________(6)Mg2+_________;(7)2H+__________。
【解析及答案】根据上述分析不难得出答案:(1)2个氮原子;(2)1个氮分子中含有2个氮原子;(3)1个水分子中含有2个氢原子;(4)2个一氧化碳分子;(5)镁元素的化合价为+2价;(6)1个镁离子带2个单位的正电荷;(7)2个氢离子。
(三)化学式中的信息
宏观信息:表示某种物质、表示组成该物质的元素;
微观信息:表示构成该物质的一个分子、表示该分子由哪些原子构成、表示1个分子中各元素的原子个数比。
例3:甘油在印刷、化妆品等工业中常用作润湿剂,也可用来制造医药和炸药。根据甘油的化学式C3H8O3,你能得出哪些信息?(任写四条)
①__________;②__________;③__________;④__________。
【解析】本题是一道开放性试题,结合化学式的意义从宏观和微观角度逐一分析,即可得出答案。
【答案】①甘油由碳、氢、氧三种元素组成;②甘油属于有机物;③1个甘油分子中有14个原子;④1个甘油分子由3个碳原子、8个氢原子和3个氧原子构成;⑤甘油分子中原子个数比为C:H:O=3:8:3等。
(四)化学方程式中的信息
宏观信息:反应物、生成物、反应条件、反应物和生成物间的质量比、反应前后物质质量守恒等。
微观信息:反应物和生成物间的粒子数之比。
例4:化学方程式![]() 给我们提供了哪些重要信息。(写三点以上)
给我们提供了哪些重要信息。(写三点以上)
【解析】本题属于一道开放性题目,主要考查化学方程式的意义及化学方程式的相关知识。注意结合题给化学方程式进行回答。
【答案】①反应物:H2、O2;②生成物:H2O;③反应条件:点燃;④表示参加反应和生成的各物质的粒子的数目关系:2个氢分子和1个氧分子反应生成2个水分子;⑤参加反应的氢气、氧气和生成的水间的质量比为1:8:9;⑥参加反应的H2和O2质量总和等于生成的水的质量,等等。
(五)粒子结构示意图中的信息
粒子结构示意图提供的信息见图一:
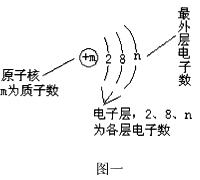
1. 其中,m决定元素种类,n决定元素的化学性质。当m=2+8+n时表示原子;当m>2+8+n时表示阳离子;当m<2+8+n时表示阴离子。
2. 在化学变化中,n可变,m不变。当n<4时,一般为金属元素,易失去电子:当n≥4时,一般为非金属元素,通常易得到电子;当n=8时,为相对稳定结构,不易得失电子。
例5:某粒子的结构示意图为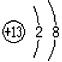 ,下列说法中不正确的是( )
,下列说法中不正确的是( )
A. 该元素原子的原子核外有2个电子层
B. 该元素是一种金属元素
C. 该粒子是阳离子
D. 该粒子具有稳定结构
【解析】根据图示,该示意图是离子结构示意图。是由该粒子的原子失去3个电子后形成的,因此其原子核外应有3个电子层,最外层有3个电子,A错;结合上述分析,B、C、D正确。
【答案】A。
(六)元素周期表中的部分信息
元素周期表中提供的部分信息见图二。
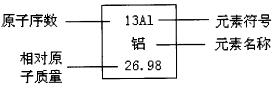
图二
其中:原子序数=质子数=核电荷数
例6:元素周期表是学习化学的重要工具,图三是元素周期表中的一格,从该图中,我们获取的相关信息中错误的是( )
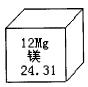
图三
A. 该元素的名称是镁
B. 该元素的原子序数为12
C. 该元素的原子结构示意图为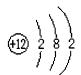
D. 该元素在地壳中的含量为24.31%
【解析】经分析可知:图中24.31是指镁元素的相对原子质量,不是它在地壳中的质量分数。
【答案】D
四、应考锦囊
初中化学中微观粒子包括分子、原子和离子。它们非常微小,人们用肉眼是无法直接观察到的。发生化学变化时分子可以再分,而原子不能再分,这是初中化学中的重点知识,一般考试时都要考查,用不同的圆球来代表不同的原子,让原子结合成分子,这样化为宏观的图形来考查化学变化,及其质量守恒定律。
要正确应用以下观点分析问题:
1、元素是从宏观角度描述物质组成的概念,因此不讲个数,只讲种类
2、由分子构成的物质,分子可以保持物质的化学性质,分子相同物质相同,物质的化学性质也相同。在化学变化中物质变化,因此物质分子一定变化。
3、原子是构成物质的粒子也是构成分子的粒子,它不同的组合可以构成不同的分子从而形成不同的物质,但在化学变化中它不再改变.
在原子中:(1)质子数决定元素的种类,质子数相同的原子属于同种元素。
质子数=核电荷数=核外电子数
(2)原子质量主要集中在原子核上,相对原子质量=质子数+中子数
(3)原子的化学性质与最外层电子数关系密切,最外层电子数相同的原子化学性质相似。原子间通过得失电子或共用电子对形成稳定结构,因此最外层电子数与化合价关系密切.
4、物质的结构决定物质的性质,结构相同性质相似.
五、超前思维:(中考第一轮复习——基本概念和理论(四)——溶液)
1、溶液
(1)概念:一种或一种以上的物质分散在另一种物质中,形成的 、 的混合物叫溶液。
(2)组成:溶液是由溶质和溶剂组成的。其中能溶解其它物质的物质叫 ,被溶解的物质叫 。溶质和溶剂是相对的,通常情况下不指明溶剂时,水就是溶剂。
(3)特征:
,
。
2、饱和溶液和不饱和溶液
(1)概念:在一定 下,一定量的溶剂中,不能再溶解某种物质的溶液,叫做这种
的饱和溶液,还能继续溶解某种物质的溶液,叫做这种 的不饱和溶液。
(2)饱和溶液和不饱和溶液的转化:
一般规律:

3、溶解性和溶解度
(1)溶解性:指一种物质在另一种物质中的溶解能力,是物质的一种物理性质。溶解性的大小取决于物质本身,还受外界条件(温度、溶剂的性质等)的影响。
(2)溶解度(常用S表示):在一定 下,某固体物质在 g溶剂中达到
时,所溶解溶质的质量(一般以“克”为单位),叫做这种物质在这种溶剂里的溶解度。
![]()
(3)溶解度和溶解性的关系:溶解度是衡量物质溶解性的尺度。
|
物质的溶解性 |
易 溶 |
可 溶 |
|
难溶(不溶) |
|
20℃时溶解度 |
>10g |
|
0.01g-1g |
|
(4)固体物质的溶解度曲线:
①横坐标表示
,纵坐标表示
。
同一条溶解度曲线上的点表示同种物质在
的溶解度。
两条曲线交点的含义
。
④溶解度曲线能反映出固体物质溶解度受温度影响情况(本质意义):
a. 大多数固体物质的溶解度随温度的升高而 ,例如
;
b. 少数固体物质的溶解度受温度的影响不大,例如
;
c. 极少数固体物质的溶解度随温度的升高而 ,例如
。
应用溶解度曲线可以比较不同物质在同一温度下的溶解度,知道温度或溶解度求对应的溶解度或温度。
4、溶解度与溶质的质量分数比较
|
|
溶 解 度 |
溶质质量分数 |
|
定 义 |
|
|
|
表示意义 |
物质溶解性大小的定量表示。 表示某温度时的饱和溶液中溶质的质量与溶剂的质量关系。 |
是溶液浓稀的定量表示。 表示某溶液中溶质的质量与溶液的质量关系。 |
|
温度要求 |
与温度 关 |
与温度 关 |
|
溶剂的量 |
在 g溶剂中 |
溶剂的量不一定是100g |
|
溶液类型 |
一定是 溶液 |
饱和溶液与不饱和溶液均可 |
|
单 位 |
克(g) |
比值无单位。常用百分数(%)表示 |
|
计算公式 |
溶解度(S)=——————×100g |
溶质的质量分数=————×100% |
5、溶液中溶质的质量分数计算的有关公式(注意单位统一):
(1)溶液的质量=溶质的质量+溶剂的质量=溶液的体积×溶液的密度
(2)溶质的质量分数= 的质量÷ 的质量×100%
(3)溶液的稀释(浓缩):
依据:溶液的稀释(浓缩)前后溶质的质量 。如有溶液Ag,其溶质的质量分数为a%,稀释(浓缩)成溶质的质量分数为b%的溶液Bg,则:Ag×a% =Bg×b%
(4)同溶质不同溶质的质量分数的溶液混合:
依据:混合溶液的质量 混合前各溶液的质量之和,混合溶液中溶质的质量 混合前各溶液中溶质的质量之和。如Ag溶质的质量分数为a%的溶液与Bg溶质的质量分数为b%的溶液混合得到Cg溶质的质量分数为c%的溶液,则有下列关系:
Ag + Bg = Cg Ag×a% + Bg×b% = Cg×c%
(5)饱和溶液中溶质的质量分数和溶解度的换算:
饱和溶液中溶质的质量分数=————————×100%
6、溶液的酸碱性
(1)溶液有酸性、中性、碱性之分。一般用pH定量描述溶液的酸碱度,pH< ,溶液显酸性,pH越小酸性越 ;pH> ,溶液显碱性,pH越大碱性越 ;pH= ,溶液显中性。pH的范围一般为
。溶液的pH大小可用pH试纸测得。(pH试纸的使用)。
(2)石蕊和酚酞能跟酸性溶液和碱性溶液反应显示不同颜色,这类物质叫
。
|
酸碱指示剂 |
在酸性环境中的颜色 |
在中性环境中的颜色 |
在碱性环境中的颜色 |
|
紫色石蕊试液 |
|
|
|
|
无色酚酞试液 |
|
|
|
7、酸、碱、盐溶液具有导电性。
【模拟试题】(答题时间:40分钟)
一、选择题(请将正确答案的序号填入题后的括号内)
1. 分子和原子的主要区别是( )
A. 分子体积大、原子体积小
B. 分子质量大、原子质量小
C. 分子之间有空隙、原子之间无空隙
D. 在化学反应中,分子可分、原子不可分
2. 下列粒子的结构示意图中,表示非金属元素的原子的是( )
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
3. 甲醛(化学式为CH2O)是室内装潢时主要的污染物之一,下列说法正确的是( )
A. 甲醛由一个碳元素、两个氢元素、一个氧元素组成
B. 甲醛分子由碳原子、氢分子、氧原子构成
C. 甲醛由碳、氢、氧三种元素组成
D. 甲醛是由碳原子和水分子构成的
4. 1803年,道尔顿提出了原子学说,对化学发展起了推动作用。其主要论点有:①物质是由原子构成的;②原子是微小的不可分割的实心球体;③同种元素的原子的性质和质量都相同。从现代原子观点看,这三个论点不确切的是( )
A. ② B. ②③ C. ①② D. ①②③
5. 某元素原子的核电荷数是电子层数的5倍,其质子数是最外层电子数的3倍,则该元素的核电荷数为( )
A. 11 B. 15 C.
17 D. 37
6. 知X、Y两种元素的核电荷数分别为a、b,它们的离子Xm+、Yn-核外电子排布相同,则下列关系式正确的是( )
A. a=b+m+n B.
a=b-m+n C. a=b+m-n D. a=b-m-n
7. A、B、C三种元素的化合价分别是+1、+4、-2,这三种元素组成的化合物的化学式可能是( )
A. ABC4 B. A4BC3 C. A2BC3 D. A3BC2
8. W、X、Y、Z四种元素原子的最外层电子数依次为4、1、6、2,则下列各组化学式正确的是( )
A. W2Z、Y2X B. ZW2、XY2 C. Z2W、X2Y D. WZ2、YX2
二、填空题:
1. 地壳含量最多的元素与地壳中含量最多的金属元素组成的化合物的化学式为____。
2. 构成并保持水的化学性质的最小粒子是____。在氧气、二氧化碳、二氧化硫中都含有相同的____,在它们相同数目的分子中都含有相同数目的____。
3. 某粒子的结构示意图为
![]()
(1)若该粒子为一稀有气体元素的原子,则x=____,y=____。
(2)若该粒子为R2+,则x=____,y=____。
(3)若该粒子为Mn-,则x=____,y=____。
4. 将元素、分子、原子、离子、质子、中子或电子分别填入下列恰当的空格内。
(1)化学变化中的最小粒子是____。
(2)氢气____是保持氢气化学性质的最小粒子。
(3)带电的原子或原子团叫____。
(4)具有相同____数的一类原子总称为元素。
(5)Na与Na+属于同一种____。
(6)铁原子核内含有26个质子和30个____。
(7)在离子化合物中,元素化合价的数值为一个原子得失____的数目。
(8)酸在水中电离时能产生相同的氢____。
(9)在金属活动性顺序中,只有排在氢前面的金属才能置换出酸的氢____。
5. 进入二十一世纪,全球拥有的化合物已超过3000万种,其中部分物质是由碳、氢、氧、钠中的某些元素组成的。请用上述元素,按要求各写出一种常见的化学式:
1)用作气体燃料的氧化物 ;
2)汽水中含有的一种酸
;
3)一种重要的化工原料、俗称苛性钠的碱 ;
4)家里蒸馒头要用的盐
6. 根据下列物质的俗名写出它们的化学式(混合物要求写出其主要成分的化学式):
纯碱
,胆矾
,干冰 ,铜绿
,石灰石
,熟石灰
,生石灰
,烧碱
,醋酸
,酒精 。
7. 用化学方程式解释下列现象:
1)做完硫在氧气中燃烧的实验后,常在集气瓶内倒入少量烧碱溶液,吸收瓶内产生的有刺激性气味的气体。
2)氢氧化钠固体敞口存放在空气中,质量会增加,滴入盐酸有气泡产生。
3)冷的浓硫酸不腐蚀铁,所以可以盛放在铁制容器中。某同学错把稀硫酸装入铁制容器,此时遇明火就有可能爆炸。
8. 以Mg为原料(其他反应物自选),依次按下列反应写出化学方程式,且要求前一个反应的生成物之一是下一个反应的反应物之一。
⑴置换反应_____________________;
⑵复分解反应(非中和反应)_____________________;
⑶复分解反应(中和反应)_____________________;
⑷分解反应_____________________;
⑸化合反应_____________________。
![]()
【试题答案】
一、1.
D 2. C 3. C 4. D 5. B 6. A 7. C 8. C
二、1.
Al2O3
2. 水分子 氧元素 氧原子
3.(1)18 8 (2)20 8 (3)18-n
8
4.(1)原子 (2)分子 (3)离子 (4)质子 (5)元素 (6)中子 (7)电子
(8)离子 (9)元素
5. CO H2CO3 NaOH Na2CO3
6. 以下为答案
Na2CO3、CuSO4·5H2O、CO2、Cu2(OH)2CO3、CaCO3、Ca(OH)2、CaO、NaOH、CH3COOH
C2H5OH
7. 1)S+O2![]() SO2 SO2+2NaOH=Na2SO3+H2O
SO2 SO2+2NaOH=Na2SO3+H2O
2)2NaOH+CO2=Na2CO3+H2O
Na2CO3+2HCl=2NaCl+H2O+CO2↑
3)Fe+H2SO4=FeSO4+H2↑ 2H2+O2![]() 2H2O
2H2O
8. 解析:本题因好多反应物需自选,所以每空均有好多答案(分解反应除外),具有一定的开放性。而它的特殊要求“前一个反应的生成物之一是下一个反应的反应物之一”很类似于成语接龙游戏,在增加本题难度的同时也增加了其趣味性。其解题思路为:有镁参加的置换反应可是镁与盐酸、稀硫酸或铜、银等可溶性盐的反应,生成的镁盐用于下步反应。而出于⑶(中和反应)的要求,第二步中要生成酸或碱,因为通过镁盐不能生成酸,显然只能通过⑴中生成的镁盐与可溶性碱反应生成镁的碱。而⑷中的分解反应只能靠电解水来完成,生成的氢气和氧气任何一种都可用于下步化合反应中。
答案:
⑴Mg+2HCl==MgCl2+H2↑
⑵MgCl2+2NaOH==Mg(OH)2↓+2NaCl
⑶Mg(OH)2+H2SO4==MgSO4+2H2O
⑷2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
⑸2Mg+O2![]() 2MgO
2MgO