![]()
【本讲教育信息】
一. 教学内容:
新课预习:第1章 原子结构与元素周期律 第1节 原子结构
二. 知识分析
初中学习过原子是由原子核和核外电子构成的,但原子核是由什么构成的呢?电子在原子核外怎样运动的?元素的性质与原子结构有什么关系?
(一)原子结构
|
微粒 |
电子 |
质子 |
中子 |
|
质量(kg) |
9.109×10-31 |
1.673×10-27 |
1.675×10-27 |
|
相对质量 |
0.005484 |
1.007 |
1.008 |
|
电量 |
1.602×10-19 |
1.602×10-19 |
0 |
|
电荷 |
-1 |
+1 |
0 |
讨论:据表中的数据讨论下列问题
(1)在原子中,质子数、核电荷数、核外电子数之间存在什么关系?
(2)原子的质量由哪些微粒决定?
(3)忽略电子质量,原子的相对质量与质子数、中子数有什么关系?
1、原子的结构

2、质量数
(1)概念:原子核中质子数和中子数之和叫质量数。
(2)关系式:原子中 核电荷数(Z)= 质子数 = 核外电子数
质量数(A)=( Z )+( N )
3、原子结构的表示方法

(二)核素
1、元素: 具有相同质子数的同一类原子的总称。
2、核素: 把具有一定数目质子和一定数目中子的一种原子称为核素。
一种原子就是一种核素,一种元素可能包括几种核素。
3、同位素: 质子数相同而中子数不同的同一元素的不同核素互称为同位素。
(1)氢元素的三种核素
|
|
11H |
21H |
31H |
|
名称 |
- |
重氢 |
超重氢 |
|
符号 |
H |
D |
T |
|
Z |
1 |
1 |
1 |
|
N |
0 |
1 |
2 |
(2)分类

(3)性质:a、同位素的 化学性质 相同, 物理性质 有一定差别。
b、天然存在的同一元素的各同位素所占的百分组成不变。
(三)元素的相对原子质量
定义: 由各种天然核素相对原子量与其原子百分组成计算出的平均值。
例如:同位素3517Cl的相对原子质量为34.969,在自然界占75.77%(原子数的百分含量),3717Cl为36.966,在自然界中占24.23%,则Cl的相对原子质量计算式为:
34.969×75.77%+36.966×24.23%
(四)核外电子的运动特点
1、核外电子的能量状况:任何一个电子都具有一定的能量
2、核外电子的运动区域:
电子层:
划分依据 :
电子层的名称与相互关系:
|
电子层 名称 |
第一层 |
第二层 |
第三层 |
第四层 |
第五层 |
第六层 |
第七层 |
|
K |
L |
M |
N |
O |
P |
Q |
|
|
与原子核 的距离 |
|
||||||
|
各层电子 的能量 |
|
||||||
3、核外电子的排布规律
(1)核外电子是分层排布的
(2)电子总是由内向外排布,先排布离核最近的电子层,然后依次往外。
(3)每个电子层最多容纳 2n2 个电子,最外层不超过8个(K层不超2个),次外层不超18个。
4、核外电子排布的表示方法: 用 原子结构示意图 表示
练习:分别画出O、Cl的原子结构示意图
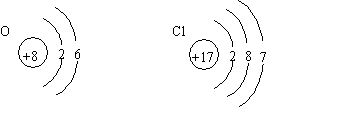
5、元素的性质与原子的电子层排布的关系
(1)元素的化学性质与 核外电子排布 密切相关。
(2)元素的化合价的数值与最外层电子数有关。
【典型例题】
例1. 若两种微粒的质子数和电子数都分别相等,则它们不可能是( )
A. 一种阳离子和一种阴离子 B. 一种单质和一种化合物分子
C. 一种分子和一种原子 D. 一种分子和一种离子
解析:阳离子的电子数小于质子数,而阴离子的电子数大于质子数,这两种微粒的质子数和电子数不可能相等。分子为电中性,离子带有电荷,它们之间质子数和电子数不等。
答案:AD
例2. 某元素的核电荷数是电子层数的5倍,其质子数是最外层电子数的3倍,则该元素的原子结构示意图为
。
解析:设质子数=核电荷数=Z,电子层数为x,最外层电子数为y。据题意有:Z=5x;Z=3y;y![]() 8;所以y=5;Z=15
8;所以y=5;Z=15
答案:
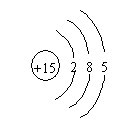
【模拟试题】(答题时间:15分钟)
1、化学变化中,可能发生改变的是 ( )
A、质子数 B、中子数 C、核外电子数 D、原子核
2、对Fe3+ 、Fe2+ 、Fe的说法正确的是 ( )
A、核电荷数相同 B、质量不相等
C、属于同一元素 D、核外电子数相同
3、某元素Rn-核外有x个电子,该元素的某种原子质量数为A,则该原子的中子数为( )
A、A-x-n B、A+x+n C、A-x+n D、A+x-n
4、下列四组物质中,两种分子不具有相同核外电子总数的是
( )
A、H2O2和CH3OH B、HNO2和HclO
C、H2O和CH4 D、H2S和F2
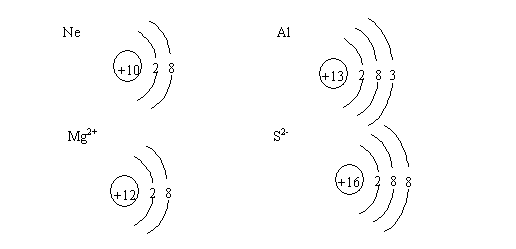
5、画出下列微粒的结构示意图:
Ne
Al
Mg2+
S2-
![]()
【试题答案】
1、C
2、AC 3、C 4、B
5、