“硫酸铜晶体里结晶水含量的测定”实验详解
1.实验原理
硫酸铜晶体中结晶水的质量分数=![]()
(硫酸铜晶体和瓷坩埚的质量—无水硫酸铜和瓷坩埚的质量=结晶水的质量)。
 2.实验步骤
2.实验步骤
①研磨:在研钵中将硫酸铜晶体研碎。
②称量;准确称量干燥的瓷坩埚的质量,并用此坩埚准确称取一定质量已研碎的硫酸铜晶体。
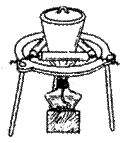
③加热:加热晶体,使其失去全部结晶水(由蓝色完全变为白色)。加热装置如图所示(加热时去年坩埚上盖)。
④称量:在干燥器内冷却后称量,并记下瓷坩埚和无水硫酸铜的质量。
⑤再加热、再称量至恒重:把盛有无水硫酸铜的瓷坩埚再加热,再放入干燥器里冷却后再称量,记下质量。到连续两次称量的质量相差不超过
⑥计算:根据实验测得的结果求硫酸铜晶体中结晶水的质量分数。
3.注意事项
①晶体加热后一定要放在干燥器内冷却,以保证无水硫酸铜不会从空气中吸收水分而引起测得值偏低(相当于水没有完全失去)。
②晶体要在坩埚底上摊开加热,有利于失去全部结晶水,以免引起测得值偏低。
③加热时间不充分、加热温度过低(未全变白),都会使测得值偏低。
④加热过程中,应慢慢加热(可改垫石棉网),以防因局部过热而造成晶体溅失,引起测量值偏高。
⑤加热温度过高或时间过长,会导致硫酸铜少量分解,使测得值偏高。
4.讨论题解答:分析实验中产生误差的原因
设硫酸铜晶体组成CuSO4·xH2O,m1为坩埚和晶体的质量,m2为加热后冷却称量所得坩埚与粉末的质量。
原理:![]()
产生误差的原因及误差分析:
⑴称量的坩埚不干燥:加热后水分蒸发,这样实验过程减少的质量包括晶体中结晶水的质量和坩埚带有水的质量两部分,因计算时将实验过程减少的质量看作结晶水的质量,这样该过程计算时代入的m1—m2的值偏大,则计算出的w或x偏大。
⑵晶体表面有水:加热后水分蒸发,原理同(1),使得m1—m2的值偏大,则w或x偏大。
⑶晶体不纯,含有不挥发杂质:加热后不挥发性杂质不分解,只有其中的硫酸铜晶体分解,使得m1—m2的值偏小,则w或x偏小。
⑷晶体未研成细粉末:加热时由于晶体颗粒太大,使得颗粒内部的结晶水不能失掉,导致m1—m2的值偏小,则w或x偏小。
⑸粉末未完全变白就停止加热:粉末未完全变白说明结晶水未完全失掉,导致m1—m2的值偏小,则w或x偏小。
⑹加热时间过长,部分变黑,说明CuSO4已发生分解:CuSO4 ![]() CuO+SO3↑,使得m1—m2的值偏大,则w或x偏大。
CuO+SO3↑,使得m1—m2的值偏大,则w或x偏大。
⑺加热后在空气中冷却:加热后在空气中冷却,会使CuSO4又结合空气中的水蒸气,使得m1—m2的值偏小,则w或x偏小。
⑻加热过程中有少量晶体溅出:晶体溅出,使得m1—m2的值偏大,则w或x偏大。
⑼两次称量相差>0.1g:两次称量相差>0.1g,说明结晶水未完全失掉,使得m1—m2的值偏小,则w或x偏小。