![]()
【本讲教育信息】
一、教学内容
期末试卷
【模拟试题】(考试时间:90分钟)
可能用到的相对原子质量:Cu 64 Fe 56 K 39 Na 23 S 32 N 14 O 16 Cl 35.5 C 12
一、单项选择题(本题包括10小题,每小题只有一个正确答案)
1. 下列说法正确的是 ( )
A、活化分子相应碰撞即可发生化学反应
B、升高温度会加快化学反应速率,其原因是增加了活化分子的百分率
C、某一反应的活化分子百分率是个定值
D、浓度增大使得反应物分子中的活化分子百分率增大
2. 下列电离方程式书写不正确的是( )
A、2H2O
![]() H3O++OH-
B、H2S
H3O++OH-
B、H2S
![]() H++HS-
H++HS-
C、NaHS
![]() Na++HS-
D、HCO3—+H2O
Na++HS-
D、HCO3—+H2O
![]() H3O++CO32-
H3O++CO32-
3、已知反应![]() ;
;![]() ,则反应
,则反应![]() 的△H为( )
的△H为( )
A. ![]() B.
B. ![]()
C. ![]() D.
D. ![]()
4、物质的量浓度相同的三种盐 NaX、NaY和NaZ的溶液,若它们的pH值依次为8、9、10,则HX、HY、HZ的酸性由强到弱的排列顺序是 ( )
A. HX、HZ、HY B. HZ、HY、HX
C. HX、HY、HZ D.HY、HZ、HX
5.
下图是某分子的比例模型,黑色的表示碳原子,白色的表示氢原子,灰色的表示氧原子。该分子是
( )

A. C2H5OH B. CH3COOH
C. CH3CHO D. C6H5OH
6. 常温下c(H+)最小的是下列各项中的( )
A. pH=0的溶液. B.
0.04 mol·L-1 H2SO4
C. 0.5 mol·L-1 HCl D.
0.05 mol·L-1HNO3
7. 室温下0.1mol·L-1KOH溶液滴定amL某浓度的HCl溶液,反应达到终点时消耗KOH溶液bmL,此时溶液中氢离子的浓度c(H+)是( ) mol·L-1
8. 向含下列离子的溶液中分别加入NaOH固体(溶液体积不变),能引起离子浓度减小的是 ( )
A. Cl- B. OH- C. AlO2-
D. HCO3-
9. 有机物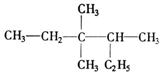 的正确命名为
( )
的正确命名为
( )
A.
2-乙基-3,3-二甲基-4-乙基戊烷
B.
3,3-二甲基-4-乙基戊烷
C.
3,3,4-三甲基已烷
D.
2,3,3-三甲基已烷
10. 1体积某气态烃和2体积氯化氢发生加成反应后,最多还能和6体积氯气发生取代反应。由此可以断定原气态烃是(气体体积均在相同条件下测定)
( )
A. 乙炔 B.
丙炔 C. 丁炔 D.
丁二烯
二、多项选择题(本题包括10小题,每小题有1-2个正确答案)
11. 下列关于过程判断的方向的说法中错误的是( )
A、NH4NO3溶于水吸热,说明其溶于水不是自发过程
B、同一种物质在气态时熵值最大,液态时次之,而固态时熵值最小
C、不借助于外力能自发进行的反应过程,其体系的能量趋向于从高能状态转变为低能状态
D、由能量判据和熵判据组合而成的复合判据,更适合于所有的反应过程
12. 常温时,将pH=3的盐酸和pH=11的氨水等体积混合后,所得溶液的pH ( )
A. 等于7 B. 大于
13.
A. 1×10-7mol·L-1 B. 1×10-12mol·L-
14. 下列关于小苏打水溶液的表述,正确的是( )
A、c(Na+)=c(HCO3-)+ c (CO32-)+
B、c(Na+) + c(H+)= c(HCO3-)+
C、HCO3-的电离程度大于HCO3-的水解程度
D、存在的电离有:NaHCO3=Na++HCO3-,HCO3-![]() H++CO32-,H2O
H++CO32-,H2O![]() H++OH-
H++OH-
15. 化合物HIn在水溶液中因存在以下电离平衡,故可用作酸碱指示剂
HIn(溶液) ![]() H+(溶液)+In-(溶液)
H+(溶液)+In-(溶液)
红色
黄色
浓度为0.02 mol·L-1的下列各溶液 ①盐酸 ②石灰水 ③NaCl溶液 ④NaHSO4溶液 ⑤NaHCO3溶液 ⑥氨水,其中能使指示剂显红色的是 ( )
A. ①④⑤ B. ②⑤⑥ C. ①④
D. ②③⑥
16. 工业上制备纯硅时反应的热化学方程式为:SiCl4(g)+2H2(g)![]() Si(s)+4HCl(g);△H=+QkJ/mol(Q>0),在相同的温度、压强条件下,将一定量反应物通入密闭容器进行以上反应(此条件下为可逆反应),下列叙述正确的是 ( )
Si(s)+4HCl(g);△H=+QkJ/mol(Q>0),在相同的温度、压强条件下,将一定量反应物通入密闭容器进行以上反应(此条件下为可逆反应),下列叙述正确的是 ( )
A、反应过程中,若减小压强能提高SiCl4的转化率
B、若反应开始时SiCl4为1mol,则达到反应平衡时,吸收的热量为QkJ
C、反应至4min时,若HCl浓度为0.12mol/L,则H2的反应速率为0.03mol/(L![]() min)
min)
D、当反应吸收热量为0.025QkJ时,生成的HCl通入100mL 1mol/L的NaOH溶液恰好完全反应
17. 用物质的量均是0.1 mol的CH3COOH和CH3COONa配成
A. c(H+)>c(OH-)
B. c(CH3COO-)+c(CH3COOH)=0.1 mol·L-1
C. c(CH3COOH)>c(CH3COO-)
D. c(CH3COO-)+c(OH-)=0.1mol·L-1
18. 在下列溶液中,各组离子一定能够大量共存的是
A、使酚酞试液变红的溶液:Na+、Cl-、SO42-、Fe3+
B、由水电离的c(H+)=10-12 mol·L-1的溶液:K+、Ba2+、Cl-、Br-
C、在pH=1的溶液中:NH4+、K+、NO3-、Cl-
D、有NO3—存在的强酸性溶液中:NH4+、Ba2+、Fe2+、Br-
19. 放热反应CO(g)+H2O(g)![]() CO2(g)+H2(g)在温度t1时达到平衡,c1(CO)=c1(H2O)=1.0 mol·L-1,其平衡常数为K1。其他条件不变,升高反应体系的温度至t2时,反应物的平衡浓度分别为c2(CO)和c2(H2O),平衡常数为K2,则( )
CO2(g)+H2(g)在温度t1时达到平衡,c1(CO)=c1(H2O)=1.0 mol·L-1,其平衡常数为K1。其他条件不变,升高反应体系的温度至t2时,反应物的平衡浓度分别为c2(CO)和c2(H2O),平衡常数为K2,则( )
A、若增大CO的浓度,K2 和K1都增大 B、K2 >K1
C、c2(CO)=c2(H2O)
D、c1(CO)>c2(CO)
20. pH=1的两种酸溶液A、B各1mL,分别加水稀释到1000mL,其pH与溶液体积(V)的关系如图所示,下列说法不正确的是 ( )
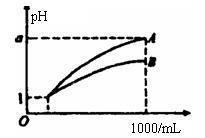
A. A、B两种酸溶液的物质的量浓度一定相等
B. 稀释后,A酸溶液的酸性比B酸溶液的酸性弱
C. 若a=4,则A是强酸,B是弱酸
D. 若1<a<4,则A、B都是弱酸
三、填空题
21. (1)家用液化气的主要成分之一是丁烷,当
(2)已知:C(s)+O2(g)=CO2(g);ΔH=-393.5
kJ/mol;2H2(g)+O2(g)=2H2O(g);ΔH=-483.6
kJ/mol,现有0.2 mol的炭粉和氢气组成的悬浮气,且混合物在氧气中完全燃烧,共放出63.53 kJ热量,则混合物中C与H2的物质的量之比为
22. 在密闭容器里,通入x mol H2(g)和y mol I2(g),发生反应H2(g)+I2(g) ![]() 2HI(g) △H<0。改变下列条件,反应速率将如何改变?(选填“增大”“减小”或“不变”)
2HI(g) △H<0。改变下列条件,反应速率将如何改变?(选填“增大”“减小”或“不变”)
(1)升高温度
;
(2)加入催化剂
;
(3)充入更多的H2
;
(4)扩大容器的体积
;
(5)保持容器容积不变,通入氖气
。
23. 在抗击非典型性肺炎期间,过乙酸(过氧乙酸)曾被广泛用作消毒剂。已知硫酸和过硫酸的结构简式如下:请从以下八个式子中选择正确选项回答下列问题(答案用编号表示,错选要倒扣分)。
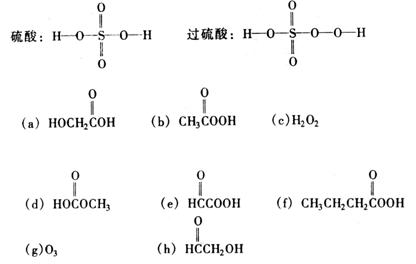
(1)过乙酸(过氧乙酸)的结构简式是
。
(2)过乙酸的同分异构体是
。
(3)过乙酸的同系物是
。
(4)氧的质量分数最小的物质是
。
24. 已知AgCl为难溶于水和酸的白色固体,Ag2S为难溶于水和酸的黑色固体。向AgCl 和水的悬浊液中加入足量的Na2S溶液并振荡,结果白色固体完全转化为黑色固体:
(1)写出白色固体转化为黑色固体的化学方程式:
(2)白色固体转化为黑色固体的原因是:
四、实验题(10分)
25.
乙二酸俗称草酸,某化学学习小组的同学欲探究测定草酸晶体(H 2Mn2++10CO2↑+8H2O
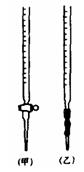
该组同学设计了如下滴定方法测定x的值。
①称取
②取25.00
mL待测液放入锥形瓶中,再加入适量的稀H2SO4
③用浓度为0.1000
mol/L的KMnO4标准溶液进行滴定,达到反应终点时消耗了10.00mL;
请回答:
⑴滴定时,将KMnO4标准溶液装在图中的 (选填“甲”或“乙”)滴定管中。
⑵本实验滴定达到终点的标志是
。
⑶通过上述数据,可计算出x=
。
讨论:①若滴定终点时俯视滴定管刻度,则由此测得的x值会 (选填“偏大”、“偏小”或“不变”,下同)。
②若滴定时所用的KMnO4溶液因久置而导致浓度变小,则由此测得的x值会 。(同上)
五、计算题
26. 已知水在
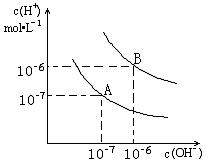
(1)则25时水的电离平衡曲线应为 (选填“A”或“B”)
(2)25时,将=9的NaOH溶液与=4的溶液混合,若所得混合溶液的 =7,则NaOH溶液与溶液的体积比为 。
(3)95时,若100体积=的某强酸溶液与1体积=b的某强碱溶液混合后溶液呈中性,则混合前,与b之间应满足的关系是
27.
25时,如果取0.1 mol·L
(1)混合溶液的pH=8的原因是
(用离子方程式表示);
(2)混合溶液中由水电离出的c(H+)__ ___0.1 mol·L-1 NaOH溶液中由水电离出的c(H+);(选填“>”、“<”、或“=”)
(3)求出混合液的下列算式的精确计算结果(填具体数字):
c(Na+)-c (A-)= mol·L-1;
(4)已知NH
(5)将相同温度下浓度相同的四种盐溶液:
A. NH4HCO3 B. NH
按pH由大到小的顺序排列 (填序号)
![]()
【试题答案】
|
题号 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
14 |
15 |
16 |
17 |
18 |
19 |
20 |
|
答案 |
B |
C |
D |
C |
B |
D |
D |
D |
C |
B |
A |
B |
B |
BD |
C |
AD |
A |
BC |
C |
A |
21、(1)C4H10(g)+13/2O2(g)=4CO2(g)+5H2O(l) △H=-2900kJ/mol
(2)1:1 解:设混合物中C为xmol,H2为(0.2-x)mol,依题意有:393.5 kJ/mol ×xmol+241.8kJ/mol ×(0.2-x)mol =63.53 kJ x=0.1,则混合物中C与H2的物质的量之比为1:1
22、(1)增大,(2)增大,(3)增大,(4)减小(5)不变
23、(1)b (2)a,d (3)f (4)f
24、(1)2AgCl+Na2S=Ag2S+2NaCl
(2)因为Ag2S的溶解度比AgCl的溶解度小,沉淀溶解平衡向离子浓度减小的方向移动了。
25、(1)甲(2)最后一滴高锰酸钾滴入后,锥形瓶内的溶液突然呈现紫色(或紫红色),且半分钟内溶液不褪色(3)2 ①偏大 ②偏小
26、① A ②10:1 ③+b=14
27、(1)A-+H2O![]() HA+OH-
(2)> (3)9.9×10-7 (4)> (5)ABDC
HA+OH-
(2)> (3)9.9×10-7 (4)> (5)ABDC
【点拨】水的电离和溶液的pH值及盐类水解是电解质溶液这部分内容的重点和难点,同时也是高考化学考查的热点。另外,弱电解质的电离平衡也是高考考查的重点,所以同学们要重点掌握。
解析(1)若HA是强酸,则恰好生成强酸强碱盐,溶液显中性,而溶液PH=8,说明溶液显碱性,生成的是强碱弱酸盐,水解显碱性。
(2)盐类水解促进水的电离,酸、碱都能抑制水的电离,所以混合溶液中由水电离出的c(H+)>0.1 mol·L-1 NaOH溶液中由水电离出的c(H+)
(3)本小题考查的是电荷守恒问题和有关pH的计算,c(Na+)+c(H+)=c (OH-)+ c (A),所以c(Na+)-c(A)=c(OH)-c(H+)=1×10-6mol·L-1-1×10-8mol·L-1 。根据质子守恒A-+H2O![]() HA+OH-和H2O
HA+OH-和H2O![]() H++OH-可知OH-有两个来源,c(OH-)= c(H+)+ c(HA),c(OH-)-c(HA)=c(H+)=1×10-8mol·L-1
H++OH-可知OH-有两个来源,c(OH-)= c(H+)+ c(HA),c(OH-)-c(HA)=c(H+)=1×10-8mol·L-1
(4)已知将HA溶液加到Na2CO3溶液中有气体放出,说明HA比H2CO3的酸性强,HA比H2CO3的电离程度大,NH
(5)根据水解规律可知H2CO3的电离程度最弱,故NH4HCO3溶液显碱性,其pH最大,NH