![]()
【本讲教育信息】
一、教学内容
酸和碱的性质
二、学习目标
1、认识酸和碱的性质(重点),理解酸和碱化学性质的实质就是H+、OH-的性质(难点)。
2、初步认识复分解反应,会判断并会书写常见复分解反应的化学方程式(重点)。
3、认识几种重要的酸和碱,掌握使用酸和碱的方法。
4、通过对酸和碱性质的探究(难点),引领学生进一步发展科学探究能力。
三、全面突破
知识点(一):酸的性质
▲几种常见的酸:胃 液:盐酸(氢氯酸);
蓄电池:硫酸;
食用醋:醋酸(CH3COOH);
酸 雨:硫酸和硝酸(HNO3)。
其 它:磷酸(H3PO4)
▲工业三大强酸:盐酸、硫酸、硝酸
1、浓盐酸和浓硫酸
(1)浓盐酸和浓硫酸物理性质的比较
|
|
浓盐酸(化学名称:氢氯酸) |
浓硫酸 |
|
颜色 |
无色、工业盐酸略带黄色(Fe3+) |
无色 |
|
状态 |
液体 |
黏稠、油状液体 |
|
气味 |
刺激性气味 |
无 |
|
挥发性 |
打开试剂瓶瓶口有白雾出现 (怎样保存?) |
无 |
|
溶解性 |
易溶于水 |
易溶于水且放出热量 |
|
密度 |
比水大 |
比水大 |
|
其他 |
盐酸是氯化氢气体的水溶液 |
有吸水性(怎样保存?) |
辨析:“烟”与“雾”的区分
烟是固体小颗粒,如磷在空气中燃烧的现象之一是冒白烟。
雾是小液滴,如打开浓盐酸瓶子,会看到白雾。这是由于挥发出来的HCl气体与空气中的水蒸气接触,形成盐酸小液滴的缘故。
(2)浓硫酸的稀释:
在稀释浓硫酸时,一定要把浓硫酸沿器壁慢慢注入水里,并不断搅拌,使产生的热量迅速扩散。切不可将水倒进浓硫酸里。如果将水倒进浓硫酸里,由于水的密度小,浮在硫酸上面,溶解时放出的热会使水沸腾,使硫酸液滴向四周飞溅。
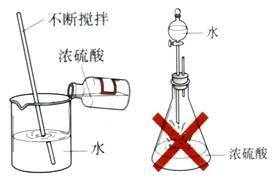
(3)浓硫酸的特性
①吸水性:若敞口放置,会因吸收空气中的水蒸气使溶液质量增加,溶质质量分数变小,所以浓硫酸应密封保存。
浓硫酸因具有吸水性,可用作某些气体干燥剂,可干燥H2、O2、N2、CO、CO2 等气体,但不能干燥NH3。所需装置如图所示,气体应从长管进,短管出,即“长进短出”。

②脱水性:能把由碳、氢、氧等元素组成的化合物(如蔗糖、淀粉、纤维素等物质)里的氢、氧元素按2:1的比例从上述化合物中夺取出来,使之发生碳化现象。

将浓硫酸滴在纸上或火柴梗上,观察到的现象
③氧化性:浓H2SO4的氧化性很强,它跟金属起反应时,一般生成水而不生成氢气。(可使铁、铝等金属钝化)
(说浓硫酸有强烈腐蚀性就是指综合它的脱水性和氧化性而言的。如果有少量浓H2SO4粘在皮肤或衣服上,应立即用大量清水冲洗,然后涂上3%—5%的NaHCO3溶液。)
2、酸的化学性质
▲由于酸溶液中都含有H+,所以酸具有一些相似的化学性质(称为:酸的通性)。
▲酸的通性:(酸→H+ + 酸根离子, 所以酸的化学性质实质就是H+ 的性质)
(1)酸溶液能使酸碱指示剂显示不同的颜色,酸能使紫色石蕊溶液变红色,使无色酚酞溶液不变色。
(2)酸能与多种活泼金属反应,生成盐和氢气。(要明确现象)
|
|
与稀盐酸反应 |
与稀硫酸反应 |
|
镁 |
Mg+2HCl====MgCl2+H2↑ |
Mg+
H2SO4====MgSO4+H2↑ |
|
铝 |
2Al+6HCl====2AlCl3+3H2↑ |
2Al+
3H2SO4====Al2(SO4)3 +3H2↑ |
|
锌 |
Zn+2HCl====
ZnCl2+H2↑ |
Zn+
H2SO4 ==== ZnSO4 +H2↑ |
|
铁 |
Fe+2HCl====
FeCl2+H2↑ |
Fe+
H2SO4 ==== FeSO4+H2↑ |
(注意:FeCl2 和FeSO4溶液的颜色均为浅绿色)
(3)酸能与某些金属氧化物反应,生成盐和水。(要明确现象)
|
|
铁锈(主要成分是 Fe2O3) |
氧化铜 |
|
稀盐酸 |
Fe2O3+6HCl====2 FeCl3+3
H2O |
CuO+2HCl====CuCl2+ H2O |
|
稀硫酸 |
Fe2O3+3 H2SO4====
Fe2(SO4)3+3 H2O |
CuO +H2SO4==== CuSO4+
H2O |
(注意:Fe2 (SO4)3和FeCl3的溶液为黄色,CuCl2溶液为蓝绿色,CuSO4溶液为蓝色)
(4)酸与碱反应,生成盐和水。
|
|
氢氧化钠 |
氢氧化钙 |
|
稀盐酸 |
HCl + NaOH==NaCl+H2O |
Ca(OH)2+2HCl==CaCl2+2H2O |
|
稀硫酸 |
H2SO4
+ 2NaOH = Na2SO4 + 2H2O |
H2SO4+Ca(OH)2=CaSO4 + 2H2O |
(5)酸能跟某些盐反应,生成新酸和新盐。如:
CaCO3+2HCl==== CaCl2+
H2O+ CO2↑(实验室制取二氧化碳的原理)
Na2CO3+2HCl====2
NaCl+ H2O+ CO2↑(泡沫灭火器的反应原理)

CaCO3+H2SO4=CaSO4+H2O+CO2↑(生成的CaSO4微溶于水,覆盖在石灰石的表面,阻碍反应的继续进行。因此实验室制取二氧化碳不能使用稀硫酸。)
HCl +
AgNO3==AgCl↓+ HNO3 (产生白色沉淀)
H2SO4 +BaCl2
==BaSO4↓+ 2HCl(产生白色沉淀)
▲离子的检验:
(1)检验Cl-的方法:向溶液中滴加硝酸银溶液,有白色沉淀产生,再加入几滴稀硝酸,若白色沉淀不消失,则证明溶液中存在Cl-。
(2)检验SO42-的方法:向溶液中滴加硝酸钡溶液,有白色沉淀产生,再加入几滴稀硝酸,若白色沉淀不消失,则证明溶液中存在SO42-。
两者均加入稀硝酸的目的是:排除其它离子的干扰。如溶液中有可溶性的碳酸盐(如碳酸钠),它们也能跟硝酸银或氯化钡、硝酸钡反应生成白色沉淀碳酸银或碳酸钡,但碳酸银和碳酸钡均可溶于稀硝酸,而氯化银和硫酸钡既不溶于水,也不溶于稀硝酸。
列表比较如下:
|
离子 |
Cl- |
SO42- |
|
试剂 |
AgNO3 、H NO3 |
Ba(NO3)2、H NO3 |
|
操作 |
往待测溶液中滴加 AgNO3 和稀HNO3 ,看是否产生白色沉淀 |
往待测溶液中滴加Ba(NO3)2 和稀 H NO3 ,看是否产生白色沉淀 |
(3)若溶液中同时存在Cl-和SO42-:应该先检验SO42-的存在,所需试剂为足量的硝酸钡溶液和稀硝酸,后用硝酸银溶液和稀硝酸检验Cl-的存在。
其原因有三:
①如果先检验Cl-,则Ag+不仅和Cl- 形成白色的AgCl沉淀,而且和SO42- 结合生成微溶于水的Ag2SO4 ,量多时会形成白色的沉淀,而影响判断。
②在首先检验SO42-时,应选用Ba(NO3)2溶液,而不是BaCl2溶液,否则就会向溶液中引入Cl- ,使溶液中Cl-的存在不确定性。
③加入足量的Ba(NO3)2溶液,其作用除检验SO42-外,还可以将SO42- 除净,以免对后续Cl- 的检验产生干扰。
3、盐酸(HCl)和硫酸(H2SO4 )的用途
①盐酸是重要的化工产品,用于金属表面除锈,制造药物(如盐酸麻黄素、氯化锌等),人体胃液中也含有盐酸,可以帮助消化。
②硫酸是重要的化工原料,用于生产化肥、农药、火药、染料以及冶炼石油和金属除锈等,在实验室中常用它的浓溶液作干燥剂。
【典型例题】
例1:下列物质长期暴露在空气中,溶质成分不变,但溶质质量分数减少且溶液质量增加的是( )
A. 浓硫酸 B. 浓盐酸 C. 浓硝酸 D.
氢氧化钠溶液
解析:题目主要考查学生对几种重要化工原料性质的了解和掌握情况。浓盐酸和浓硝酸具有挥发性,长期暴露在空气中,溶质挥发后,溶质的质量分数减小,溶液质量也减少,但溶质成分不变;浓硫酸具有吸水性,长期暴露在空气中能吸收空气里的水分,溶质质量分数减少,溶液质量增大,但溶质成分不变;氢氧化钠则不同,它长期暴露在空气中,会吸收二氧化碳并发生反应:2NaOH+CO2 == Na2CO3+H2O,溶质成分改变了,不符合题意。
答案:A
例2:为区别稀盐酸和稀硫酸,最好选用下列哪种试剂( )
A. 石蕊试液 B. 碳酸钠溶液
C. 氯化钡溶液 D.
硝酸银溶液
解析:稀盐酸和稀硫酸都是常见的酸,都具有酸的通性,都能使石蕊试液变红色,都能与碳酸钠反应生成盐和水,并放出二氧化碳气体,所以,选项A、B都不能区分它们。若选C,则氯化钡溶液与稀盐酸不反应,而稀硫酸和氯化钡反应生成不溶于稀硝酸的白色沉淀;若选D,则硝酸银溶液与稀盐酸反应生成不溶于稀硝酸的白色沉淀氯化银,而硫酸和硝酸银反应生成的硫酸银,由于微溶于水而产生一定量的白色沉淀,产生干扰,所以,区分稀盐酸和稀硫酸最好选择氯化钡作为检验的试剂。
答案:C
例3:构建知识网络是一种重要的学习方法。下图是关于盐酸化学性质的知识网络,“——”表示相连的两种物质能发生反应,“→”表示一种物质转化成另一种物质,A、C属于不同类别的化合物。完善这个知识网络:
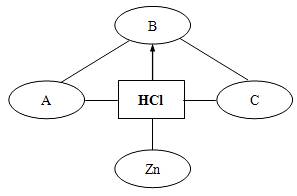
(1)写出A、B、C的化学式:
A ;B ;C 。
(2)根据自己得出的知识网络写出
一个复分解反应化学方程式:
解析:该题看似考查盐酸的化学性质,实则考查酸、碱、盐及氧化物的性质,有一定的难度。盐酸的化学性质有五点:与酸碱指示剂反应;与活泼金属反应;与金属氧化物反应;与碱反应;与某些盐反应。分析此网络,显然A、C属于金属氧化物、碱、盐中的两种,若A是常见的碱(如NaOH、Ca(OH)2),则C就是盐(如Na2CO3等碳酸盐)或者金属氧化物(如Fe2O3等);而B是盐酸与金属氧化物或盐发生反应的产物,分析可知,B只能是盐或是酸,而且和A、C能够发生反应;若A是NaOH,C是Na2CO3,则B只能是盐酸和金属氧化物(CuO、Fe2O3)反应的产物(CuCl2、FeCl3)。若A是NaOH,C是金属氧化物(CuO、Fe2O3),则B只能是酸(HNO3)。
答案:(1)NaOH、CuCl2、Na2CO3 或NaOH、HNO3、Fe2O3
(2)Na2CO3+2HCl==2NaCl+H2O+CO2↑[或NaOH+HCl==NaCl+H2O
或2NaOH+CuCl2==Cu(OH)2↓+2NaCl或Na2CO3+CuCl2==CuCO3↓+2NaCl等]
知识点(二):碱的性质
▲常见的碱有:氢氧化钠—NaOH 氢氧化钙—Ca(OH)2
氢氧化钾—KOH 氨 水—NH3·H2O
(Cu(OH)2 蓝色沉淀,Fe(OH)3红褐色沉淀,Mg(OH)2白色沉淀)
▲碱的命名:“氢氧化某”,如Fe(OH)3 或“ 氢氧化亚某”,如Fe(OH)2
1、氢氧化钠和氢氧化钙
(1)物理性质比较:
|
|
NaOH(俗称:苛性钠、火碱、烧碱) |
Ca(OH)2(俗称熟石灰、消石灰) |
|
颜色状态 |
白色固体 |
白色粉末状固体 |
|
溶解性 |
极易溶于水,溶解时放出大量的热 |
微溶于水 |
|
吸水性 |
在空气中易吸水而潮解,可作干燥剂 |
不吸水 |
|
其他 |
水溶液有滑腻感 |
水溶液俗称:石灰水 |
(2)氢氧化钠易吸收空气中的水分而潮解。

氢氧化钠固体露置在空气中一段时间后的变化
注意:固体氢氧化钠具有吸水性,可作干燥剂,但不能干燥CO2、SO2等与它反应的气体,可以干燥O2、H2、CO、NH3等气体。
(3)氢氧化钠对皮肤、纸张、织物等有强烈的腐蚀性。如不慎沾到皮肤上的处理:立刻用较多的水冲洗,再涂上硼酸溶液。
氢氧化钙对皮肤、衣服等也有腐蚀作用。
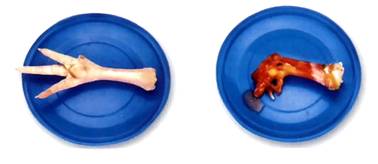
氢氧化钠的强烈腐蚀性
2、碱的化学性质
▲由于碱溶液中都含有OH-,所以碱有一些相似的化学性质(称为:碱的通性)
▲碱的通性(碱→金属阳离子+ OH-:所以碱的化学性质实质就是OH- 的性质)
|
|
NaOH |
Ca(OH)2 |
||
|
化 学 性 质 |
1.
与酸碱指示剂反应 |
碱的水溶液能使紫色石蕊试液变蓝,使无色酚酞试液变红 |
||
|
2.
与非金属氧化物反应 |
2NaOH+CO2
== Na2CO3+H2O 2NaOH+SO2
== Na2SO3+H2O |
Ca(OH)2+CO2====
CaCO3↓+H2O (这个反应常用于鉴别CO2 气体) |
||
|
3.
与酸发生中和反应 |
NaOH+HCl
== NaCl+H2O |
Ca(OH) 2+2
HCl ==== CaCl2+2H2O |
||
|
4.
与某些盐反应 |
CuSO4 + 2NaOH= FeCl3 + 3NaOH = Fe(OH)3↓+
3NaCl |
Ca(OH)2+Na2CO3=CaCO3↓+
2NaOH Ca(OH)2+CuCl2=
Cu(OH)2↓+
CaCl2 |
||
注意:
①氢氧化钠的保存方法:氢氧化钠应密封保存。
原因:易吸收水分而潮解,能与空气中的CO2 反应而变质。
②盛放碱及溶液的试剂瓶应用橡皮塞密封,而不能用玻璃塞。
3、工业制法:Ca(OH)2+Na2CO3==== CaCO3↓+2
NaOH
CaO+ H2O==== Ca(OH)2 (反应放出大量的热)
4、碱的用途
(1)NaOH的用途
重要的化工原料,用于肥皂、石油、造纸、纺织、印染等工业。
(2)Ca(OH)2的用途
建筑业:与粘土、沙子混合制成三合土,砌砖、抹墙。
工业:制取氢氧化钠
农业:改良酸性土壤,与硫酸铜配制波尔多液。
【典型例题】
例4、下列不能用固体氢氧化钠作干燥剂的是( )
A. 氢气 B. 氧气 C. 二氧化碳 D.
一氧化碳
解析:看氢氧化钠能否作干燥剂,主要看它能否与被干燥的气体反应,不能反应才能用氢氧化钠干燥;氢气、氧气、一氧化碳都属于中性气体,不能和氢氧化钠反应,可以用氢氧化钠来干燥;二氧化碳属于非金属氧化物,能和氢氧化钠反应,所以,不能用氢氧化钠固体作二氧化碳的干燥剂。特别注意CO是非金属氧化物,但是不能和氢氧化钠反应。
答案:C
例5、下列有两组实验,请根据实验中的问题写方程式。
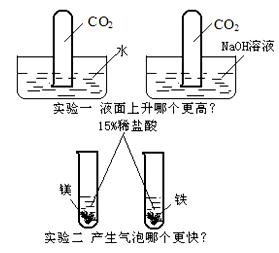
写出实验中“更高”的化学方程式:
写出反应“更快”的化学方程式:
解析:实验一中的“更高”是指试管内液面上升得更高、更快。二氧化碳虽然与水反应,但是受到二氧化碳溶解性的影响(二氧化碳能溶于水,即一体积水中能溶解一体积二氧化碳),所以倒立于水中的试管内液面上升得慢且低,倒立于氢氧化钠溶液中的试管内液面上升得快且高。
实验二中的“更快”,是指金属与酸反应的快慢,由于两试管内的稀盐酸浓度相同,又由于金属镁的活动性比铁强,所以镁与稀盐酸的反应更快。
答案:CO2+2NaOH === Na2CO3+
H2O
Mg+2HCl=== MgCl2+ H2↑
例6、皮蛋是我国传统风味食品,制作皮蛋的方法有多种,一种制作含锌皮蛋的方法是把鸭蛋放在培养液中浸泡,培养液由水、食盐、氢氧化钠、少量硫酸锌等物质配制而成。
(1)取少量培养液于试管中,滴入无色酚酞溶液后变红,则培养液的pH 7(填“<”、“>”或“=”)
(2)在(1)的试管中滴加过量稀硫酸,红色褪去,发生反应的化学方程式为:
。
(3) 在(2)所得的溶液中加入一种盐溶液产生了沉淀,该盐可能是
A. BaCl2 B. CuSO
解析:使无色酚酞试液变红色的溶液一定呈碱性,所以该培养液的pH>7。
该培养液中含有水、食盐、氢氧化钠、少量硫酸锌及酚酞等物质,加入过量的稀硫酸,硫酸将氢氧化钠中和掉,溶液呈现酸性,而酚酞在酸性溶液中呈现无色,所以红色会褪去。
在(2)所得的溶液中,含有的物质有:食盐、硫酸锌、硫酸、硫酸钠,因此加入BaCl2,会生成硫酸钡沉淀;加入AgNO3 会生成氯化银的白色沉淀。
答案:(1)>
(2)2NaOH+H2SO4===Na2SO4+
2H2O
(3)A、C
例7、小明同学在食品包装袋内,发现有一个小纸袋,上面写着“生石灰干燥剂,请勿食用”。他随手将小纸袋拿出来放在桌面上,经过一段较长时间后发现纸袋内的白色颗粒粘在一起成为块状固体M。请你与他一起对块状固体M进行探究。
【探究任务】
(1)探究固体M是否失效;
(2)探究固体M中是否含有氢氧化钙。
【探究方案】
|
问题与猜想 |
实验步骤 |
实验现象 |
实验结论 |
|
探究一:固体M是否失效 |
取适量固体M,溶解于盛有水的烧杯中,用温度计测量加入前后的温度 |
温度没有明显变化 |
|
|
探究二:固体M中是否含有氢氧化钙 |
将上述烧杯内的液体充分搅拌、静置,取上层清液,加入无色酚酞试液 |
|
有氢氧化钙 |
【反思拓展】
(1)你认为“探究二”是否严密 ,其原因是
;
(2)你认为固体M中除含有氢氧化钙外,还可能含有
,请你设计实验检验是否含有该物质
。
解析:生石灰与水反应生成氢氧化钙,并放出热量。探究一:取适量固体M,溶解于盛有水的烧杯中,用温度计测量加入前后的温度,温度没有明显变化,应理解为温度不变或略有变化两种情况。但不管哪种情况,此块状固体M已经失效。探究二:结论是有氢氧化钙,说明溶液呈碱性,所以加入无色酚酞试液,一定会变红色。
探究一中,若溶液的温度略有变化,即略有升高,则说明块状固体M中仍有少量的氧化钙未变质,与水反应生成少量氢氧化钙,同样可以使酚酞变红色,因此“探究二”不严密。
氧化钙变质生成氢氧化钙,而氢氧化钙又和空气中的二氧化碳反应生成碳酸钙,所以固体M中除含有氢氧化钙外,还可能含有CaCO3。
若要证明碳酸钙的存在,可加入稀盐酸,并用澄清石灰水检验是否有二氧化碳生成即可。
答案:固体M失效 溶液变红
(1)不严密 氢氧化钙也可能是未变质的氧化钙与水反应刚生成的
(2)碳酸钙(或CaCO3) 把适量固体M放入试管中,再滴加稀盐酸,立即用涂有石灰水的玻璃片盖住试管口部,若石灰水变浑浊,证明固体M中含有碳酸钙。
知识点(三):复分解反应
1、定义:两种化合物互相交换成分,生成另外两种化合物的反应,叫做复分解反应。
2、复分解反应类型的认识
(1)表达式(用字母表示)为:AB+CD=AD+CB。
(2)特征:
①复分解反应中反应物、生成物都是化合物,一定没有单质出现。
②生成的化合物必须是通过交换成分生成的。
如:2NaOH+CO2 == Na2CO3+H2O就不是复分解反应
③反应前后元素的化合价保持不变。
3、复分解反应发生条件:生成物中有气体或水或沉淀生成。
4、复分解反应包括的类型
(1)酸+碱性氧化物→盐+水(如:Fe2O3+6HCl====2
FeCl3+3 H2O)
(2)酸+碱→盐+水(如:NaOH + HCl == NaCl+H2O)
(3)酸+盐→新盐+新酸(如:HCl +
AgNO3==AgCl↓+ HNO3 )
(4)碱+盐→新碱+新盐 (反应物必须都可溶,如:Ca(OH)2+Na2CO3=CaCO3↓+
2NaOH)
(5)盐+盐→另两种新盐 (反应物必须都可溶,如:NaCl + AgNO3==AgCl↓+
NaNO3 )
5、复分解反应中的注意事项:
(1)KNO3 NaNO3一般不参加复分解反应。
(2)碱与盐、盐与盐反应的前提条件是都要可溶,再观察是否符合复分解反应的条件。
(3)复分解反应的反应方式是互相交换成分。但有些反应,虽然反应前后均是两种化合物,但并不是靠相互交换成分而发生的反应,如:CO2+Ca(OH)2====
CaCO3↓+H2O。所以“碱和非金属氧化物”的反应不属于复分解反应。
有些反应看似较复杂,如:CaCO3+2HCl==== CaCl2+H2O+CO2↑,深入分析,这个反应也属于复分解反应,因为CaCO3+2HCl ==CaCl2+H2CO3,而H2CO3==H2O+CO2↑,两反应相加即得CaCO3+2HCl==== CaCl2+H2O+CO2↑,所以此反应也属于复分解反应。
(4)初中常见的沉淀为:
①不溶于酸的白色沉淀为:BaSO4、AgCl;
②溶于酸有气体生成的白色沉淀为:BaCO3、CaCO3;
③溶于酸生成水的沉淀有:Cu(OH)2(蓝色沉淀)、Fe(OH)3红褐色沉淀,![]() 白色沉淀等。
白色沉淀等。
【典型例题】
例8、下列反应属于复分解反应的是 ( )
A. CO2+Ca(OH)2=CaCO3↓+H2O B. H2+CuO![]() H2O+Cu
H2O+Cu
C. 3NaOH+FeCl3=Fe(OH)3↓+3NaCl D. CO2+H2O=H2CO3
解析:复分解反应是指两种化合物互相交换成分,生成另外两种化合物的反应,其表达式为:AB+CD=AD+CB。A选项中虽然是两种化合物反应,生成了另外两种化合物,但是两种反应物并没有交换成分,所以不属于复分解反应;B选项属于置换反应;D选项属于化合反应;而C是碱和盐的反应,所以属于复分解反应。
答案:C
四、考场清单
本讲知识中,常见酸和碱的物理性质、化学性质、复分解反应及有关的实验探究,是历年中考的重点和热点。基本题型有选择、填空、实验探究及计算题等,通常结合生产生活实际考查学生学以致用的情况。
考点1、几种常见的酸(盐酸、硫酸)的物理性质、特性、使用方法及用途。
考点2、几种常见的碱(氢氧化钠、氢氧化钙)的俗名、物理性质、特性、使用方法及用途。
考点3、酸的化学性质,有关化学方程式的书写、现象等。
考点4、碱的化学性质,有关化学方程式的书写、现象等。
考点5、复分解反应及其判断
考点6、酸和碱性质的有关实验探究。
五、本讲小结
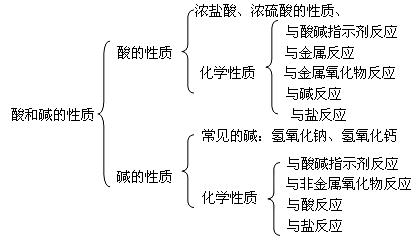
知识结构:
规律方法:
1、进行比较、分析、联想:两种浓酸敞口放置,浓盐酸质量减少、体积减少,溶质质量分数减小,溶液的pH增大;浓硫酸的质量增大,体积增大,溶质质量分数减小,溶液的pH增大。
2、学习酸的化学性质时,既要掌握H+ 是酸具有相似化学性质的原因,又要明确不同的酸根离子所具有的特殊性,而导致性质不同的一面。
学习碱的化学性质时,既要掌握OH-是碱具有相似化学性质的原因,又要明确不同的阳离子所具有的特殊性,而导致性质不同的一面。
3、复分解反应要抓住“两种化合物”和“互相交换成分”两个关键词。
4、作干燥剂的物质必须满足两个条件:(1)能吸收水分;(2)不与被干燥的物质发生反应。
疑难辨析:
1、错误观点:碱能使酚酞试液变红,所以Cu(OH)2也能使酚酞试液变红。这种说法是错误的,因为Cu(OH)2难溶于水,不能电离出自由移动的OH-,所以不能使酚酞试液变红。
2、“烟”、“雾”的区分
“烟”是固体小颗粒,如磷在空气中燃烧的现象之一是冒白烟。“雾”是小液滴,如打开盛浓盐酸的瓶口会看见白雾。这是由于浓盐酸挥发出来的氯化氢气体与空气里的水蒸气接触,形成盐酸小液滴的缘故。
3、复分解反应是两种化合物相互交换成分,生成另外两种化合物,且生成物中必须有水或气体或沉淀。往往把一些反应如:2NaOH+CO2==Na2CO3+H2O和![]() +CO2==CaCO3↓+H2O当成复分解反应,把一些反应如CaCO3+2HCl==CaCl2+H2O+CO2↑不当成是复分解反应。
+CO2==CaCO3↓+H2O当成复分解反应,把一些反应如CaCO3+2HCl==CaCl2+H2O+CO2↑不当成是复分解反应。
六、超前思维(《常见的酸和碱》复习)
1、识别酸和碱的方法
2、溶液酸碱性的强弱程度
3、酸和碱对生命活动的意义
4、酸、碱、盐的定义、组成以及常见酸碱盐的判断
5、中和反应的实质、判断及应用
6、常见酸和碱的物理性质、特性及用途
7、酸的化学性质,常见化学方程式的书写
8、碱的化学性质,常见化学方程式的书写
9、复分解反应的条件及判断
【模拟试题】(答题时间:40分钟)
一、选择题
1. 下列说法,错误的是
( )
A. 盐酸是氯化氢气体的水溶液
B. 盐酸、硫酸都是无色液体
C. 浓盐酸、浓硫酸都能在空气中形成白雾
D. 盐酸、硫酸的密度都比水大
2. 下列各组物质属于同种物质的是
( )
A. 生石灰、熟石灰、
C. 石灰石、熟石灰、Ca(OH)2 D.
火碱、烧碱、NaOH
3. 氢氧化钠固体可用于干燥某些气体,是因为氢氧化钠固体具有 ( )
A. 脱水性 B. 强腐蚀性 C.
易潮解
D.
强碱性
4. 下列物质溶于水时,没有明显放热现象的是
( )
A. 烧碱 B.
浓硫酸
C.
生石灰 D. 食盐
*5. 下列物质不能由酸和金属反应产生的是
( )
A. FeCl3 B.
FeCl
6. 区别稀氢氧化钠溶液和石灰水可用
( )
A. 稀盐酸 B.
二氧化碳 C.
紫色石蕊 D.
酚酞
7. 能使木材、纸张变黑的酸是
( )
A. 浓硫酸 B.
浓盐酸 C.
稀硫酸
D.
醋酸
8. 下列物质久置于空气中,质量会减少的有
( )
①浓硫酸 ②浓盐酸 ③浓硝酸 ④生石灰
A. ①②③④ B.
①③
C.
②④ D.
②③
9. 物质存放在烧杯中一段时间后,质量变大且变质的是 ( )
①浓盐酸 ②浓硫酸 ③烧碱 ④食盐 ⑤生石灰 ⑥稀硫酸
A. ①⑥ B. ②③⑤ C. ③⑤ D. ②③④
10. 不用其他试剂,可以鉴别石蕊、盐酸、氢氧化钙、氢氧化钠、碳酸钠五种溶液,第二个被鉴别出来的物质是
( )
A. 盐酸 B. 氢氧化钙 C. 氢氧化钠 D. 碳酸钠
二、填空与简答
11. 盛氢氧化钠固体的试剂瓶敞口放置于空气中,因吸收________而潮解,这种变化属于________变化;因吸收________而变质,这种变化属于________变化。所以氢氧化钠固体必须保存在_____________________。
12. 在所有能导电的溶液里,一定存在_____________;在酸的溶液里,一定存在_____________;在碱的溶液里,一定存在_____________。
*13. 小波用实验方法区别稀盐酸和硫酸钠溶液(记作A、B)。
(1)他向A、B两溶液中分别加入Na2CO3溶液,观察到A溶液中产生无色气体。则A是 ,发生反应的化学方程式为
。
(2)他向A、B两溶液中分别加入BaCl2溶液,B溶液中的现象是
。
(3)他还用了下列试剂中的一种区别A、B两溶液,这种试剂是 (填序号)。
①石蕊试液 ②CuSO4溶液 ③醋酸溶液 ④KCl溶液
14. 某镇硫酸厂排出的尾气中含有SO2,废水中含有H2SO4 。请回答:
(1)该镇经常下酸雨,酸雨的pH 5.6(填:>、<、=);要粗略地测定酸雨的pH,通常用精密 试纸。
(2)请举一例酸雨的危害:
。
(3)用熟石灰处理该厂废水的化学方程式为:
。
(4)该厂的下列整治措施不妥的是 (填序号):
A. 废气循环利用
B. 将废气点燃后排放
C. 废水用碱中和后排放
D. 改进工艺,减少废气废水的产生
三、实验探究题
**15. 实验室常用的干燥剂“碱石灰”是CaO和固体NaOH的混合物,极易与空气中水蒸气和CO2反应而变质。某同学对一瓶久置的“碱石灰”作了如下探究:
(1)【猜想】猜想Ⅰ:没有变质,“碱石灰”只含有CaO、固体NaOH;
猜想Ⅱ:已完全变质,“碱石灰”全部变成了CaCO3和Na2CO3。
则CaO与水反应的反应方程式为
。
(2)【实验】如下图所示:
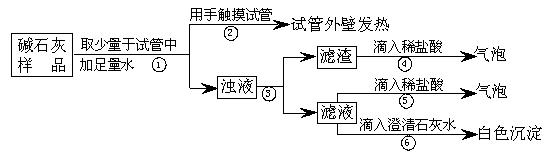
(3)【判断】
a. 若Ca(OH)2、CaCO3和Na2CO3投入到水中不会放热,则由操作②现象判断:猜想Ⅱ (填:成立、不成立)
b. 操作④发生化学反应的方程式为
;由操作⑤⑥的现象判断:滤液中含有 (写化学式);由此判断猜想Ⅰ (填:成立、不成立)。
c. 综合a和b的结论,判断该样品变质情况为
。
(4)【拓展】由上述实验说明,实验室中“碱石灰”应 保存;操作③中玻璃棒的作用是
。
四、计算题
16. 完全中和25g 氢氧化钠溶液,用去质量分数为20%的稀硫酸24. 5g,求氢氧化钠溶液中溶质的质量分数。
【试题答案】
一、选择题:
|
题号 |
1 |
2 |
3 |
4 |
5 |
|
答案 |
C |
D |
C |
D |
A |
|
题号 |
6 |
7 |
8 |
9 |
10 |
|
答案 |
B |
A |
D |
C |
A |
5、解析:单质铁与酸或者盐发生置换反应时,生成+2价的亚铁盐,如FeCl2或FeSO4;而不是生成+3价的铁盐,如FeCl3或Fe2(SO4)3。所以酸和金属反应不能得到FeCl3。
二、填空题
11、水分 物理 二氧化碳 化学 密闭容器中
12、自由移动的离子 自由移动的氢离子(或H+) 自由移动的氢氧根离子(或
OH-)
13、(1)稀盐酸 Na2CO3+2HCl====2
NaCl+ H2O+ CO2↑
(2)有白色沉淀生成
(3)①
14、(1)< pH(若写为PH或ph不给分)
(2)影响人类健康(或使森林大面积枯死、或建筑物腐蚀损坏、或土壤酸化等等)
(3)Ca(OH)2+H2SO4==CaSO4+2H2O
(4)B
三、实验探究题
15、解析:(3)a用手触摸试管外壁,感到发热,说明碱石灰样品中存在溶于水放热的物质,由于Ca(OH)2、CaCO3和Na2CO3投入到水中不会放热,所以样品中一定存在CaO或NaOH,因此,“猜想Ⅱ:已完全变质,“碱石灰”全部变成了CaCO3和Na2CO3”是不成立的。
答案:(1)CaO+H2O==Ca(OH)2
(3)a.不成立
b. CaCO3+2HCl==CaCl2+CO2↑+H2O Na2CO3 不成立
c. 部分变质
(4)密封 引流,防止溶液外溅
四、计算题
16、16%