![]()
【本讲教育信息】
一、教学内容
钢铁的锈蚀与防护
二、学习目标
1、了解导致钢铁锈蚀的因素,以及减缓钢铁锈蚀的方法。
2、知道废旧金属对环境的污染,认识回收利用废旧金属对环境及金属资源保护的重要性。
3、通过对钢铁锈蚀条件的探究,进一步加深对科学探究各要素的理解,提高学生的科学素养。
三、全面突破
知识点(一):导致钢铁锈蚀的因素(重点、难点)
1、钢铁的锈蚀条件
Δ生锈的条件(原理):钢铁锈蚀主要是铁与氧气、水共同反应的结果。
Δ影响钢铁生锈的因素:钢铁的纯度、环境的温度和酸碱性也是影响钢铁锈蚀的因素。如:酸、氯化钠等物质能加速钢铁的生锈。
Δ钢铁锈蚀条件的实验探究:
|
|
|
|
|
将洁净的铁钉放入干燥的试管中,并用橡皮塞密封试管口 |
将洁净的铁钉全部浸没在煮沸过的蒸馏水中,并滴入一层植物油(或加满水用橡皮塞密封试管口) |
将洁净铁钉的一半放入蒸馏水中,试管敞口放置。 |
|
现象:铁钉不生锈 |
现象:铁钉不生锈 |
现象:铁钉生锈,且液面附近生锈最重 |
2、钢铁锈蚀的原因
钢铁锈蚀是铁与氧气、水蒸气共同反应的结果,铁的化学性质较为活泼,这是铁易锈蚀的内因,有些不活泼的金属不易与氧气等反应,所以抗腐性强。但有些金属的化学活动性比铁强,抗腐蚀性却很强,如铝、锌等,这是因为它们与氧气反应后形成致密的氧化物薄膜,阻止了铝、锌等进一步被氧化。
铁锈主要成分为氧化铁(Fe2O3),铁锈疏松多孔,不仅不能防止钢铁制品与空气、水接触,还会把空气和水分保留在钢铁制品的表面,进一步加剧钢铁的锈蚀。所以钢铁制品表面的铁锈应及时除去。
【典型例题】
例1、如图所示,取一团光亮无锈的铁丝绒,放入一支洁净试管的底部,将试管倒立在盛有水的烧杯中,数天后,能观察到的现象是
。
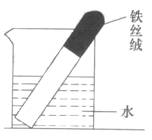
解析:铁在潮湿的空气中会与O2、H2O共同作用而生成铁锈,因此试管内氧气逐渐消耗,压强减小,外界大气将水压向试管内一部分,试管内水面上升。
答案:铁生锈,试管内水面上升
例2、如图电杆的铁丝拉线上M、N、P三处,最容易生锈的地方是( )
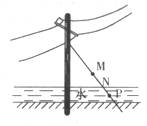
A. M处 B. N处 C. P处 D. 不能判定
解析:该题往往会错误地认为水中生锈更快,没有考虑氧气。铁钉生锈的实验证明,铁在潮湿的空气中容易跟氧气发生化学反应,生成铁锈。即铁同时跟氧气和水接触,才容易生锈。唯有N处的铁丝同时跟充足的氧气和地面上的水充分接触,故最容易生锈。
答案:B
例3、全世界每年因生锈损失的钢铁,约占世界年产量的1/4。某学生想弄清楚铁生锈是否必须同时有空气和水,他将干净的铁钉放入A、B、C三支试管中,进行研究.
A B C
(1)如图所示,每支试管中画出并标明所需的物质和用品.
(2)一周后,编号为________的试管中铁钉最易生锈.
(3)常温下铁生锈的实质是铁与 和 等物质发生的化学反应。
(4)比较吐鲁番盆地和海南岛两地,铁生锈相对较慢的地区是____________,理由是___________________.
(5)铁锈覆盖在铁制品表面,但不能阻止铁制品继续被锈蚀的原因是 (填序号)。
①铁锈能与内部的铁继续发生反应
②铁的活动性非常强
③铁锈很疏松,会把空气和水分保留在钢铁制品的表面
(6)A中加入的蒸馏水要事先煮沸,其目的是
。
解析:解答本题时,必须先明确实验的目的:铁生锈是否必须同时有空气和水。因此,可创设三个不同的环境:①有水而没有空气;②有空气而没有水;③有水也有空气,比较三个环境中铁钉生锈的快慢。
本题还结合地理知识考查了不同地理位置环境对铁生锈快慢的影响,体现了研究铁生锈条件的实际价值。
铁锈疏松多孔,不仅不能防止钢铁制品与空气、水接触,还会把空气和水分保留在钢铁制品的表面,进一步加剧钢铁的锈蚀,所以钢铁制品表面生的铁锈应及时除去。
久置的蒸馏水中会溶有一定量的氧气,由于气体的溶解度随温度的升高而减小,所以,通过加热煮沸可以除去水中溶解的氧气。
答案:(1)如图所示
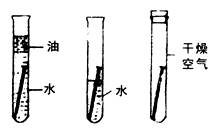
(2)B (3)氧气 水 (4)吐鲁番盆地 气候干燥 (5)③ (6)除去水中溶解的氧气
知识点(二):减缓钢铁锈蚀的方法(重点、热点)
铁是应用最普遍也是最容易被腐蚀的金属材料,人类一直在寻找能有效地减缓或防止钢铁锈蚀的方法。
1、思路:破坏金属锈蚀的条件,使它们不再具备锈蚀的条件,就能防止铁制品锈蚀。
2、方法:隔绝空气或隔绝水。具体方法有:
(1)保持铁制品表面洁净干燥。
(2)在铁制品表面涂一层保护膜。采用保护膜是最普遍又非常重要的防锈措施。如在生产和生活实践中,人们常把暂时不用的钢铁制品表面进行清洁干燥后,再涂上防锈材料,
如机油、凡士林、防锈油脂等;若长期防锈常用保护膜法,如钢铁表面涂油漆、沥青、橡胶、搪瓷等非金属材料。
(3)通过化学反应使铁制品表面生成一层致密的氧化物薄膜,如锯条的烤蓝。利用某些金属如锌、铝、铬、镍等能在表面形成一层致密氧化膜的性质,用电镀法、喷镀法等,将上述金属镀在钢铁制品的表面,防止空气和水对金属铁的锈蚀,如,镀锌铁板、自行车钢圈镀铬等。
(4)改变铁的组织结构,制成合金钢,如不锈钢就是在钢中熔合铬、镍等金属,使钢铁的抗腐蚀能力大大加强
【典型例题】
例4、据统计,每年锈蚀的钢铁约占世界钢铁年产量的![]() ,联系生活,生产实际,说出自行车各个构件的防锈措施:
。
,联系生活,生产实际,说出自行车各个构件的防锈措施:
。
解析:要防止钢铁生锈,必须弄清钢铁生锈的条件:空气(氧气)和水同时存在情况下,钢铁易生锈,要防止其生锈,其一是改善钢铁的组织结构,如加入铬、镍制成不锈钢;其二是在钢铁表面涂一层保护层,使钢铁与水分、空气隔离,如刷漆、涂机油或电镀等。对于自行车来说,各个构件的防锈措施是不一样的,如支架、链条、钢圈等部位。
答案:自行车构件的防锈措施:支架上刷漆、链条上涂油、钢圈上电镀金属铬等。
例5、某同学晚上帮妈妈做饭,切完青菜就将菜刀放在菜板上,第二天早晨发现菜刀生锈了。试问:(1)菜刀上是否发生了化学变化? (2)菜刀为什么会生锈? (3)为了防止菜刀生锈,你有哪些建议?
解析:菜刀生锈,生成了与铁不同的物质,即有新物质生成,发生了化学变化。用菜刀切菜,刀上沾了水又与空气接触,满足了铁生锈的条件,所以会生锈。菜刀防锈的方法有许多种,如可将菜刀洗净擦干,放在干燥处,也可在菜刀表面涂上一层食用油等。
答案:(1)发生了化学反应。(2)因为菜刀上有水,并与空气中的氧气接触,生成了铁锈。(3)将菜刀擦洗干净,放在干燥处(或洗净擦干后涂上一层食用油)。
例6、日常生活中的一些铁制品经常会被锈蚀。下列做法中不能起到防锈作用的是( )
①在铁制品表面镀锌;②在铁制品表面涂油漆;③保留铁器表面的铁锈作保护层;④在铁器表面刷油漆;⑤自行车脏了用清水冲洗;⑥用废酸液冲洗铁制污水管道;⑦切完咸菜后,尽快将菜刀洗净擦干
A. ⑤⑦ B. ③⑤⑥ C. ①③⑦ D. ②⑥⑦
解析:铁生锈是因为铁与水、氧气发生了化学反应。生成的铁锈疏松多孔。极易吸水,因此铁锈不仅不能防锈还会加快铁的锈蚀;脏了的自行车用清水冲洗而没有及时将水擦干,不但不能起到防锈的作用,反而为生锈提供了条件;废酸液会与铁反应,所以会腐蚀铁制污水管道,且在酸液浸过后,还会加快铁的生锈。
答案:B
知识点(三):废旧金属的回收利用(热点)
1、由于金属制品的腐蚀、损坏和自然淘汰,每年都有大量的废旧金属产生。这些金属如果弃置,既造成环境污染,又浪费了有限的金属资源。
有人曾做过这样的估计:回收一个废弃的铝质易拉罐要比制造一个新易拉罐节省20%的成本,同时还可节约90%~97%的能源。回收1 t废钢铁可炼得好钢0.9 t,与用矿石冶炼相比,可节省成本47%,同时还可减少空气污染、水污染和固体废弃物污染。可见,树立可持续发展的观念,加强垃圾的分类回收、处理,并循环利用弃旧金属有着巨大的经济效益和社会效益。
回收废旧金属的意义:
可节约金属资源
由于金属冶炼需在高温下进行,回收废弃金属并再利用可节约能源
降低金属制品的生产成本,可方便人们得到物美价廉的金属制品
可减少金属对环境的污染
(注意:回收废旧金属要分类处理)
2、保护金属资源的有效途径有:
①防止金属腐蚀;
②回收和利用废旧金属;
③有计划、合理地开采矿物;
④开发和使用新的代用品,如:塑料。

【典型例题】
例7、“绿箱子环保计划——废弃手机及配件回收联合行动”已在全国40个重点城市中开展了近两年。下列有关废弃手机中的金属材料回收利用的说法不正确的是( )
A. 可以节约金属资源
B. 可以节约冶炼相关金属所消耗的能量
C. 可以减少对环境的污染
D. 回收废弃手机中的金属材料没有任何价值
解析:回收废旧金属的意义:可节约金属资源;由于金属冶炼需在高温下进行,回收废弃金属并再利用可节约能源;降低金属制品的生产成本,可方便人们得到物美价廉的金属制品;可减少金属对环境的污染。
答案:D
例8、欢欢同学对金属铁的相关知识开展了研究性学习。
(1)实地调查铁制品锈蚀情况如下:
|
调查内容 |
掉漆的自行车 |
露天堆放的钢筋 |
洗净并擦干的菜刀 |
镀铬的铁质水龙头 |
|
铁制品锈蚀情况 |
长时间风吹雨淋掉漆的地方出现锈迹 |
时间长了钢筋表面出现锈层 |
菜刀放置较长时间也不生锈 |
龙头较长时间不生锈 |
由调查结果可知:铁生锈实际上是铁与 和 等发生反应的过程。
(2)她提出了保护金属资源的下列建议,正确的是 (填字母序号)。
A. 防止铁制品锈蚀 B. 回收利用废旧铁制品 C. 任意开采铁矿石
(3)通过进一步探究铁与硫酸铜溶液反应的实验,可以比较铁与铜的金属活动性强弱,请写出该反应的化学方程式
,该反应类型属于 反应。
解析:根据实地调查内容和调查结果分析,铁生锈就是铁与氧气和水反应的结果。
保护金属资源的有效途径有:①防止金属腐蚀;②回收和利用废旧金属;③有计划、合理地开采矿物;④寻找新的代用品等,因此A、B选项正确。由于铁能置换出硫酸铜溶液中的铜离子,所以铁的活动性比铜强,该反应属于置换反应。
答案:(1)氧气, 水
(2)A、B
(3)Fe+CuSO4 =FeSO4+Cu 置换
例9、钢铁是重要的金属材料,在生产、生活中有广泛的用途。建造北京奥运会主体育场“鸟巢”,就是用了大量的钢铁。
(1)钢铁属于______________(填“纯净物”或“混合物”);
(2)每年世界上钢铁的产量很高,钢铁的锈蚀也给人类带来了巨大的损失。铁在空气中锈蚀,实际上是铁跟空气中的__________和___________共同作用的结果;
(3)为了防止钢铁锈蚀,人们常采用在其表面涂刷矿物油或镀上其他金属等覆盖保护膜的方法。这些方法都能防止锈蚀的共同原理是_________________________;
(4)炼铁厂常以焦炭、赤铁矿(主要成分是氧化铁)、空气等为主要原料炼铁,反应过程如下:

请写出第③步反应的化学方程式:_________________________________________;
(5)金属矿物的储量有限,而且不能再生;目前世界上已有50%以上的废钢铁得到回收利用,其目的是_____________________________(填“合理开采矿物”或“节约金属资源”)。
解析:钢铁是合金,属于混合物。铁生锈就是铁与氧气和水反应的结果。防锈的原理是破坏金属锈蚀的条件,使它们不再具备锈蚀的条件,就能防止铁制品锈蚀。在铁制品表面涂刷矿物油或镀上其他金属等,其原理都是为了形成一层保护膜,而达到隔绝氧气的目的。
第(4)问,炼铁过程中,第①步反应是提供热量,第②步反应是得到还原剂一氧化碳,第③步反应就是一氧化碳在高温条件下还原氧化铁,得到生铁,是炼铁的基本原理。
回收废旧钢铁的目的是节约金属资源,与合理开采矿物无关。
答案:(1)混合物 (2)水蒸气 氧气 (3)隔绝氧气
(4)3CO + Fe2O3 ![]() 2Fe + 3CO2 (5)节约金属资源
2Fe + 3CO2 (5)节约金属资源
四、考场清单
本讲知识中,金属锈蚀的因素和金属制品的防护措施是历年中考的重点,而金属制品的回收和利用则是中考的热点。主要以选择、填空、简答和实验探究题的形式出题,通常结合生产生活实际考查学生学以致用的情况。
考点1、钢铁锈蚀条件的探究
考点2、导致钢铁锈蚀的因素
考点3、减缓钢铁锈蚀的方法
考点4、废旧金属的回收利用
五、本讲小结
知识结构:
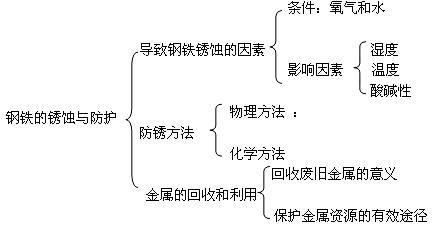
规律方法:
1、铁的生锈与防锈
(1)铁在潮湿的空气中,会与氧气、水同时作用发生复杂的缓慢氧化反应,生成红色的铁锈。铁锈的主要成分是Fe2O3 。铁锈是混合物。
(2)防锈方法
①保持铁制品表面洁净和干燥;
②在铁制品表面涂上一层保护膜;
③在铁制品表面镀一层其他不易生锈的金属;
④通过化学反应使铁制品表面生成一层致密的氧化膜。
2、金属资源的保护有四种途径
①防止金属锈蚀;
②回收、利用废旧金属;
③有计划、合理地开采矿物
④开发和使用新的代用品,如:塑料。
疑难辨析:
1、钢铁生锈必须具备两个条件①与空气接触;②与水接触,不要误认为只具备一种就行。而防锈时,只要缺少其中一个条件就达到目的,不用两种都杜绝。这两种方法易混为一谈,要区分清楚。
2、铝比铁活泼,但铁比铝在空气中易生锈,是因为铝有“自我保护”作用。
六、超前思维(第三单元复习与综合素能检测)
1、金属的物理性质
2、合金
3、炼铁的原理
4、金属的化学性质
5、金属活动性顺序
6、金属的锈蚀和防护
7、废旧金属的回收利用
8、氧化反应、还原反应、置换反应
【模拟试题】(答题时间:40分钟)
一、选择题
1、通过实验回答,铁钉在下列哪些情况下容易生锈( )
A. 在干燥的空气中 B.
在潮湿的空气中
C. 全部浸入食盐水中 D.
浸没在植物油中
2、下列做法能防止铁制品生锈的是( )
A. 自行车脏了用清水冲洗 B.
用废酸液冲洗铁制污水管道
C. 在铁制篮球架上刷一层油漆 D.
切完咸菜后,尽快将菜刀用清水洗净
3、随着人们生活质量的提高,各种电池使用量大幅度增加,废电池进行集中处理的问题被提到议事日程上来。其首要原因是 ( )
A. 回收利用电池外壳的金属材料
B. 防止电池中汞、镉、铅等重金属对土壤和水源的污染
C. 减轻电池中渗漏的液体对其他物品的腐蚀
D. 回收利用电池中的石墨电极
﹡4、海口市秀英炮台是国家文物保护单位,也是爱国主义教育基地。下列关于炮台中的大炮(由铁合金制造)的保护措施不正确的是( )
A. 常用稀盐酸除去大炮表面的锈 B. 在大炮表面涂上一层油
C. 尽量避免被雨淋
D. 禁止用手摸
﹡5、下列有关铁的描述不正确的是( )
A. 人体的铁元素主要存在于血液中
B. 铁具有良好的导电性和导热性
C. 铁在潮湿的空气中形成致密的保护膜
D. 铁质容器不能盛放硫酸铜溶液
6、为预防金属制品锈蚀,下列措施或做法不当的是( )
A. 将使用后的菜刀洗净擦干
B. 在铁制门窗表面喷涂油漆
C. 在铁制水管表面镀一层锌
D. 用力擦去铝锅表面的氧化膜
7、垃圾是放错了位置的资源,应该分类回收,生活中废弃的铁锅,铝制易拉罐、铜导线等可以归为一类回收,它们属于( )
A. 氧化物 B. 化合物 C. 金属或合金 D. 非金属
8、下列关于金属资源的说法中,不正确的是( )
A. 自然界中除少数不活泼的金属如金、银等以单质形式存在外,其余都以化合物形式存在
B. 自然界中的金属资源是取之不尽的
C. 防止金属锈蚀、回收利用废旧金属可以保护金属资源和环境
D. 合理开发矿物,寻找金属代用品都是保护金属资源的有效途径
9、目前许多城市实行了垃圾分类回收。市区街道的垃圾箱有明显不同的颜色,绿色箱用来装可回收再利用垃圾,黄色箱用来装不可回收垃圾,以下物质能扔进绿色垃圾箱的是( )
①废旧报纸 ②易拉罐 ③一次性塑料饭盒 ④果皮 ⑤煤渣 ⑥空矿泉水瓶 ⑦废铁锅
A. ①②⑤⑦
B. ①③⑤⑦
C. ③④⑤⑥ D. ①②⑥⑦
**10、关于铁的下列说法正确的是 ( )
A. 铁能和高温水蒸气、硝酸锌溶液、盐酸发生置换反应
B. 在铁制品表面涂油漆或电镀上一层其他金属,这两种防锈措施的原理是相同的
C. 炼铁的过程是铁矿石(主要成分为Fe3O4或Fe2O3等)被氧化的过程
D. 铁是地壳中含量最多的金属
二、填空题
11、(1)下列家庭生活垃圾:①废旧书刊报纸 ②废电池 ③废弃橡胶、塑料制品 ④易拉罐饮料瓶 ⑤废弃电线 ⑥破旧铁锅、铝壶 ⑦变质剩饭菜 ⑧瓜皮果壳 ⑨废弃玻璃物品等,其中可回收利用的有
。
回收利用与保护金属资源相关联的是
。
(2)请你联系实际再提出两条节约金属资源的建议:
;
。
12、钢铁在潮湿的空气中容易被锈蚀。在工厂里通常采用试剂除去铁制品表面的锈,工人师傅用除锈剂除铁锈时,浸泡时间不宜过长,其原因是
。高层建筑常采用铝合金门窗而不采用铁制门窗,其原因是
(答出一点即可)
13、小明把一根用砂纸打磨过的铁丝弯成螺旋状放入试管中,放置1—2周时间后,装置中出现的现象是:
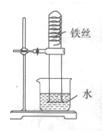
现象1
;
现象2
。
分析产生上述现象的原因
。
我们日常生活中随处可见以上现象发生,请你任举
两例
、
。
谈一谈防止该现象发生的措施有哪些
、
。
三、实验探究题
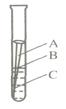
**14、钢铁、铝合金、铜制品等是应用广泛的金属材料。据估计,每年全世界被腐蚀损耗的钢铁材料,约占全年钢产量的十分之一。某校化学兴趣小组的同学探究金属腐蚀的原因,设计如下实验:
(1)如图,取一根约
(2)一同学联想到家里铜制餐具上有一层绿色物质,认为铜在空气中也会生锈。他上网查阅资料,知道这种绿色物质的化学成分为Cu2(OH)2CO3(铜绿)。他从铜绿组成和空气的成分大胆猜测,铜生锈除了与铁生锈条件相同外,还应该有CO2参加反应。
请写出铜在空气中生成铜绿的化学方程式
。
(3)【查阅资料】孔雀石的主要成分是Cu2(OH)2CO3,也可以表示成CuCO3·![]() 。与孔雀石相似,还有许多矿物可用xCuCO3·yCu(OH)2(x、y都是正整数)表示,石青就是其中的一种。
。与孔雀石相似,还有许多矿物可用xCuCO3·yCu(OH)2(x、y都是正整数)表示,石青就是其中的一种。
【实验探究】为了验证石青的组成成分,他们设计了如下实验,请你共同参与探究。
|
|
实验操作 |
实验现象 |
结论 |
|
步骤l |
取少量石青样品置于大试管中加入足量稀硫酸 |
(1)产生大量气体 (2)溶液呈蓝色 |
(1)石青中含有 离子 (2)石青中含有 离子 |
|
步骤2 |
取少量石青样品置于大试管中加热 |
(1)残留固体呈 色 (2)大试管内壁 |
石青加热易分解 |
【反思与拓展】
①确定步骤1中产生气体成分的实验方法是
。
②根据以上探究,只要测定出参加反应的石青的质量、生成的氧化铜的质量和 的质量,就可确定石青的化学式(即确定x、y的值)。
③防止金属锈蚀的方法很多,如制成不锈钢、在金属表面
(任写一种方法)。
四、计算题
**15、为了测定黄铜(铜、锌合金)的组成,某研究性学习小组称取该样品
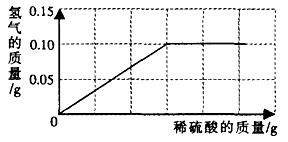
(1)样品中铜的质量分数;
(2)反应所消耗的硫酸溶液质量;
(3)反应后所得溶液质量。
![]()
【试题答案】
一、选择题:
|
题号 |
1 |
2 |
3 |
4 |
5 |
|
答案 |
B |
C |
B |
A |
C |
|
题号 |
6 |
7 |
8 |
9 |
10 |
|
答案 |
D |
C |
B |
D |
B |
二、填空题
11、(1)① ② ③ ④ ⑤ ⑥ ⑨;②④ ⑤ ⑥
(2)①防止金属锈蚀;②回收、利用废旧金属;
12、除锈剂呈酸性,既可以与铁锈反应,也可以与铁反应,若长时间浸泡会腐蚀铁制品。铝制品质轻,耐腐蚀等。
13、解析:铁与水和氧气接触易生锈,同时试管内氧气减少,压强减小,试管内液面上升。日常生活中生锈的例子非常多,如菜刀生锈,锄镰生锈、暖气片生锈等;防止生锈的措施围绕隔绝与氧气和水的接触填写。
答案:铁丝生锈 试管内液面上升 铁丝与试管内的氧气、水反应而生锈,使试管内压强减小,液面上升 菜刀生锈 钢铁生锈 刷油漆 镀金属保护膜
三、实验探究题
14、(1)B
O2或氧气
H2O或水 (2)2Cu+O2+H2O+CO2 ===Cu2(OH)2CO3
(3)【查阅资料】CO32- Cu2+ 黑 有水珠
【反思与拓展】
①将产生的气体通入足量的澄清石灰水中
②水或二氧化碳
③涂油、刷漆等
四、计算题
15、解:(1)解:设样品中锌的质量为x,设反应所消耗的硫酸溶液质量为y
Zn +
H2SO4=== ZnSO4 + H2↑
65 98
2
x 9.8%y
![]()
![]()
x=
(1)样品中铜的质量分数=(
(2)反应所消耗的硫酸溶液质量=
(3)反应后所得溶液质量=


