![]()
【本讲教育信息】
一、教学内容
质量守恒定律
1、质量守恒定律
2、如何正确书写化学方程式
二、考点清单
1、理解质量守恒定律的内容,明确质量守恒的原因
2、应用质量守恒定律解决一些简单的问题
3、能正确书写并配平简单的化学方程式
4、学会对初中化学反应类型进行初步分类
三、全面突破
知识点1:质量守恒定律

白磷燃烧实验
铁与硫酸铜溶液反应
一)定律内容
参加化学反应的各物质的质量总和,等于反应后生成的各物质的质量总和。

镁条燃烧
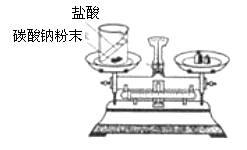
若反应前后有气体物质时,探究质量守恒必须在密闭体系中进行。
*关键词的理解:
(1)质量守恒定律只适用于化学变化,不适用于物理变化,且体现的是质量守恒,而不是体积等守恒。
(2)不参加反应的物质质量及不是生成物的物质质量不能计入“总和”中
(3)要考虑空气中的物质是否参加反应或物质(如气体)有无逸散。
二)微观解释
在化学反应前后,原子的数目没有增减,原子的种类没有改变,原子的质量也没有变化,因此,化学反应前后质量必然相等。

三)质量守恒定律的应用
1、根据质量守恒定律进行简单的计算;
2、运用质量守恒定律解释化学反应中的一些简单的现象和问题;
3、判断化学反应中某种物质的组成;
4、确定化学反应中某种物质的化学式。
【典型例题】
例1:下列说法中,符合质量守恒定律的是
A.
蜡烛完全燃烧后,生成水和二氧化碳的质量之和等于蜡烛的质量
B.
镁带在空气中燃烧后,生成物的质量比镁带的质量增加了
C.
高锰酸钾受热分解后,剩余固体的质量与反应物的质量相等
D.
粗盐提纯实验得到精盐的质量和滤纸上砂子的质量之和等于溶解的粗盐的质量
【解析】应用质量守恒定律分析问题时,要注意的是参加化学反应的各物质的质量总和等于反应后生成的各物质的质量总和。
蜡烛在空气中燃烧生成水和二氧化碳的质量之和应等于参加反应的蜡烛和氧气的质量之和,而不等于蜡烛的质量,选项A是错误的。
镁在空气中燃烧生成氧化镁的质量应等于参加反应的镁和氧气的质量总和,所以氧化镁的质量比镁的质量增加了,选项B是正确的。
高锰酸钾受热分解后,生成锰酸钾、二氧化锰、氧气的质量总和一定等于分解的高锰酸钾的质量。由于氧气逸出,剩余物的质量比原反应物的质量小,选项C是错误的。
选项D的变化不属于化学变化,所以不能用质量守恒定律解释。故本题选B。
【答案】B
例2:现将10gA和足量的B混合加热,A和B发生化学反应。10gA完全反应后生成8gC和4gD,则参加反应的A与B的质量比是
A.
1:l B.2:
【解析】 A + B = C + D
参加反应的物质的质量
由质量守恒定律可得参加反应的B的质量为8+4-10=
【答案】C
例3:在化学反应A+B=C+D中,有10gA与20gB恰好完全反应,生成5gC。若反应后生成5gD,则参加反应的A的质量是
A.
【解析】此题考查了质量守恒定律的运用。根据反应物A+B的质量总和10+20=30(g),可推知生成物的质量总和为
【答案】C
例4:著名的发明家诺贝尔经过长期的研究与试验,终于发明了安全炸药—三硝酸甘油酯,三硝酸甘油酯的化学式为C3H5N3O9,这种炸药发生爆炸的反应方程式为
(1)Ⅹ的化学式是
(2)推断Ⅹ的化学式的依据是
【解析】本题的思维切入点是根据质量守恒定律,反应前后原子的个数不变。
反应前
反应后
碳原子个数:12
碳原子个数:12
氢原子个数:20
氢原子个数:20
氮原子个数:12
氮原子个数:0
氧原子个数:36 氧原子个数:36
所以6X中共有12个氮原子,X的化学式为N2
【答案】(1)N2 (2)质量守恒定律
例5:某物质在氧气中燃烧后只生成水和二氧化碳,关于该物质的组成,下列说法中正确的是
A.
一定含有C、H、O三种元素
B.
一定含有C、H元素,不含O元素
C.
一定含有C、H元素,可能含有O元素
D.
可能含有C、H、O元素
【解析】从燃烧产物水和CO2的组成来看,共含有三种元素,即碳、氢、氧元素。根据质量守恒定律,化学反应前后元素的种类不会改变,可知反应物中必定也含有碳、氢、氧三种元素.
由于可燃物是在氧气中燃烧的,即氧气中肯定含有氧元素,而且也只含氧元素,所以可燃物中就一定含有碳、氢元素,而是否含氧元素就不能确定了。
【答案】选C
例6:某有机物
A.
只含C、H元素
B. 只含C、H、O元素
C.
不只含C、H、O元素 D. 不含氧元素
【解析】本题初看与例5差不多,学生很容易做错,实际上需通过计算来判断该有机物中所含元素。根据质量守恒定律,可知该有机物中一定含有C、H两种元素,关键是判断该有机物中有无氧元素和其它元素.
计算可知:
8.8
gCO2中含C质量![]() =
=
O质量
5.4
gH2O中含H质量![]() =
=
O质量
∵产物中C、H两种元素的质量总和为:
∴该有机物中不只含有C、H两种元素.
有机物
∴该有机物中含有C、H、O三种元素.
【答案】B
知识点2:化学方程式——用化学式来表示化学反应的式子。
一)遵循的原则
(1)以客观事实为依据(2)遵守质量守恒定律
二)书写步骤
(1)写:根据事实写出反应物和生成物的化学式,中间用短横线相连;
(2)配:配平化学方程式;
(3)等:将短横线改为等号;
(4)标:标明反应条件以及生成物的状态“↑”或“↓”。
(5)查:检查化学式是否写错、是否配平、条件和生成物状态是否标了、标得是否恰当。
(注:计量数比为最简单的整数比)
三)配平方法
(1)最小公倍数法(2)奇数配偶法(3)观察法等
四)意义
(1)宏观意义:表明反应物和生成物种类以及反应条件
(2)微观意义:表明各物质的粒子个数比(对气体来说,还表明体积比)
(3)表明各物质之间的质量比(这是根据化学方程式进行计算的主要依据)
(以C + O2![]() CO2为例)
CO2为例)
宏观:碳和氧气在点燃的条件下反应生成二氧化碳;
微观:每1个碳原子和一个氧分子反应,生成一个二氧化碳分子;
量:每12份质量的碳和32份质量的氧气完全反应,生成44份质量的二氧化碳。
五)化学方程式提供的信息包括
(1)反应物是什么
(2)通过什么反应条件
(3)生成物是什么
(4)参加反应的各物质粒子的相对数量
(5)反应前后质量守恒
(6)化学反应类型等
(基本反应类型:化合反应、分解反应、置换反应、复分解反应)
【典型例题】
例1:指出下列化学方程式的错误所在,并写出正确的化学方程式。
(1)铁丝在氧气中燃烧 ![]()
![]()
(2)磷在氧气中燃烧 2P2O5![]() 4P+5O2
4P+5O2
(3)氢气在氧气中燃烧 4H2↑+2O2↑![]() 4H2O
4H2O
【解析】判断化学方程式的正误,首先看反应物与生成物的位置是否颠倒;然后检查各物质的化学式的正误;最后看反应条件有无说明;方程式是否配平;“↑”或“↓”符号是否正确运用。
【答案】反应(1)有二处错误:①应把“燃烧”改为“点燃”,因为前者是反应现象,后者才是反应条件。②应把“FeO”改为“Fe3O![]() Fe3O4。
Fe3O4。
反应(2),反应物与生成物位置颠倒,应把反应物(P、O2)写在“=”左边,生成物(P2O5)写在“=”右边:4P+5O2![]() 2P2O5。
2P2O5。
反应(3)有两处错误:①各化学式前的系数不成最简单的整数比,应予约分;②应去掉两个“↑”符号,因为化学方程式里只有当生成物有气体逸出时才可使用“![]() ”符号。正确的为:2H2+O2
”符号。正确的为:2H2+O2![]() 2H2O
2H2O
例2:配平下列化学方程式:
(l)Fe3O4 + CO-Fe + CO2
(2)Al + Fe3O4 ─ Fe + Al2O3
【解析】(1)用观察法配平
从反应式不难分析出:每一个CO分子从Fe3O4中夺取了一个氧原子生成一个CO2分子,而一个Fe3O4分子可使四个CO分子氧化成CO2分子,所以配平的化学方程式为:Fe3O4+4CO===3Fe+4CO2
(2)用最小公倍数法配平
求出Fe3O4和Al2O3中氧原子个数(4和3)的最小公倍数为12。这样Fe3O4前的系数为12/4=3,Al2O3前的系数为12/3=4。然后用观察法推出Fe和Al前的系数。该小题配平的化学方程式为:8Al+3Fe3O4=9Fe+4Al2O3
【答案】见分析。
例3:我们长跑后,腿会发酸,这是因为肌肉中产生了乳酸C3H6O3,过一段时间后,这种酸痛现象会慢慢消失,原因是乳酸与人体中的氧气反应生成了水和二氧化碳,该反应的化学方程式为:
【解析】根据化学方程式的书写步骤,可用观察法进行配平
【答案】C3H6O3 + 3O2
== 3CO2 + 3H2O
例4:用奇数配偶法配平化学方程式:
C2H2+O2—CO2+H2O
【解析】配平化学方程式有两个注意点:一是不能任意改动化学式,只能在化学式前面添加适当系数。二是各化学式前面的系数经配平后必须为最简单的整数比。用奇数配偶法配平化学方程式时,必须抓住“看”、“定”、“配”三个步骤。
【答案】见下表。

例5:实验室制取有毒的氯气时,常用氢氧化钠溶液来吸收多余的氯气,其方程式为:Cl2+2NaOH=NaCl+NaClO+H2O。写出工业上用氯气和熟石灰(Ca(OH)2)为原料制取漂白粉[Ca(ClO)2+CaCl2]的化学方程式:______。
【解析】用氯气和熟石灰为原料制取漂白粉,不是初中化学学习的内容,要写出这一反应的化学方程式,应先明确熟石灰和氢氧化钠一样都属于同一类物质,再联系题目给予的氯气和氢氧化钠反应的方程式,运用演绎的方法,由此及彼,完成本题解答。
【答案】2Cl2+2Ca(OH)2=Ca(ClO)2+CaCl2+2H2O
四、本讲小结
五、应考锦囊
质量守恒定律基本上年年出现在中考试题中,化学方程式的书写,根据化学方程式的计算是历年中考的必考试题。常见题型有选择题、填空题、计算题、探究性学习题等。通常结合农业生产、日常生活、科学实验等考查学生的计算能力、综合分析能力和灵活运用知识的能力。
六、超前思维(有关化学方程式的计算)
1. 解题步骤及格式
一般分为以下七步:
(1)
(2)
(3)
(4)
(5)
(6)
(7)
2. 计算中常用的关系式
(1)m= ρv
(2)单位换算:
(3)物质的纯度=纯物质的质量/不纯物质的质量×100%
变形:纯物质的质量=
不纯物质的质量=
(4)物质的纯度(纯物质的质量分数)=1-杂质的质量分数
3. 常见的计算类型
(1)利用化学方程式的简单计算;
(2)有关含杂质物质的化学方程式的计算;
*(3)质量守恒定律结合化学方程式的综合计算。
【模拟试题】(答题时间:60分钟)
一、填空题
1. 无数实验证明,参加化学反应的各物质的质量总和,等于 ,这个规律叫做质量守恒定律。
2. 将A g 氯酸钾与B g 二氧化锰的混合物加热到质量不再减少为止,得到剩余固体C g,则反应后生成氧气的质量为 g;同时生成氯化钾的质量为 g。
3. 石蜡在空气中燃烧生成水和二氧化碳,根据质量守恒定律可知,石蜡中一定含有_________元素,可能含有_______元素。
4. 前几年曾喧闹一时的“水变油”,是一场用伪科学进行诈骗的闹剧。其实,稍有化学常识的人都知道,化学反应前后原子种类不变,水中的氢、氧元素是不可能转变成汽油中的
元素的,这依据的是________
___定律。
5. 向煤中加入适量石灰石,可大大减少燃烧产物中SO2的量,其反应式如下:2CaCO3+O2+2SO2=2CaSO4+2X,请你推断X的化学式为
。
6. 书写化学方程式必须遵循两个原则:一是 ,二是 。
7. 在C+O2![]() CO2的反应中,每
份质量的碳粉跟 份质量的氧气反应,就生成 份质量的二氧化碳。
CO2的反应中,每
份质量的碳粉跟 份质量的氧气反应,就生成 份质量的二氧化碳。
8. 根据所给信息写出化学反应方程式
(1)一氧化氮是大气的污染物之一。目前有一种治理的方法是:
(2)航天飞机曾用金属铝粉和高氯酸铵(NH4ClO4)的混合物作固体燃料,加热铝粉使其被氧气氧化,放出大量的热,促使混合物中高氯酸铵受热分解,同时生成四种气体,两种是空气中的主要成分,一种气体是氯气(Cl2),还有一种气体是水蒸气,因而产生巨大的推动力,试写出其中涉及的化学方程式:
①铝粉被氧气氧化成氧化铝
。
②高氯酸铵受热分解
。
二、选择题
1. 下列变化可用质量守恒定律进行解释的是 ( )
A.
B. 物质升华时要吸收热量
C.
D.
2. 在化学反应前后,下列各项中一定没有变化的是 ( )
①原子的数目②分子的数目③元素的种类④物质的总质量⑤物质的种类⑥原子种类
A. ①③④⑤ B. ①③④⑥ C. ①③⑤ D. ①④⑥
3. 在化学反应前后,下列粒子总数可能改变的是 ( )
A. 质子 B. 电子 C. 分子 D. 原子
4. 根据质量守恒定律,电解NaCl的水溶液,不可能得到的生成物是 ( )
A. KNO3 B. C
5. 加热辰砂和铁的混合物,完全反应后得到汞和硫化亚铁(FeS2),试分析辰砂组成中一定含有的元素是 ( )
A. 汞、硫 B. 汞、铁、硫 C. 汞 D. 硫
6. 经检测某瓶气体只含有C、H两种元素,则对这瓶气体的下列分析不可能的是( )
A. 有一种单质 B.
有两种单质 C.
是混合物 D. 是纯净物
7. 在化学反应A+B=C中,1.5gA与足量的B充分反应后生成9.5gC,则参加反应的B的质量为 ( )
A.
8. 在化学反应A+B=
A. M+N-P/2 B.
M+N-2P C
9. 在反应4NH3+5O2===
A. N2O B.
NO C.
NO2 D.
N2O4
﹡10. “绿色化学”是当今社会提出的一个新概念。在“绿色化学工艺”中,理想状态是反应中原子全部转化为欲制得的产物,即原子的利用率为100%。在用C3H4(丙炔)合成C5H8O2(2-甲基丙烯酸甲酯)的过程中,欲使原子的利用率达到最高,在催化剂作用下还需要的其他反应物是 ( )
A. CO和CH3OH B. CO2和H2O C. CO和C2H5OH D. CH3OH和H2
11. 如下图所示,二分子甲生成二分子乙与一分子丙,已知甲、乙、丙三者为不同的纯净物,则乙物质的化学式为 ( )

A. XY2 B.
X2Y C.
X2 D.
X4Y2
﹡12. 将
A. 该物质中只含有碳、氢两种元素 B. 该物质中含有碳、氢、氧三种元素
C. 该物质的化学式为C2H6O D. 该物质的化学式为CH4
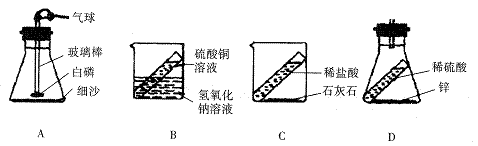
13. 下列装置能用来证明质量守恒定律的是( )
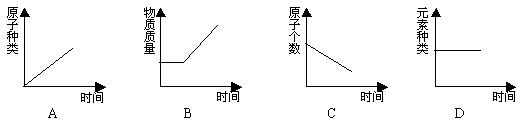
14. 红磷在密闭容器(含有空气)内燃烧,容器内有关的量随时间变化的图象正确的是( )
15. 化学方程式揭示了化学反应中的 ( )
①反应条件 ②哪些是反应物或生成物 ③反应物和生成物的粒子个数比 ④各反应物与各生成物之间的质量比
A. ①③ B.
①② C.
①②③ D.
①②③④
16. 化学方程式2H2+O2 ![]() 2H2O所表示的意义是 ( )
2H2O所表示的意义是 ( )
①氢气和氧气在点燃的情况下生成水 ②每两个氢分子和一个氧分子在点燃的情况下生成两个水分子 ③氢气、氧气、水的质量比为4 :32:36
A. ①③ B.
①②③ C.
②③ D.
①②
17. 如图四位同学正在讨论某一化学方程式表示的意义,他们所描述的化学方程式是(相对原子质量:H—1;C—12;O—16;S—32) ( )

A. S+O2![]() SO2
B. 2CO+O2
SO2
B. 2CO+O2![]() 2CO2
2CO2
C. 2H2+O2![]() 2H2O
D. CH4+2O2
2H2O
D. CH4+2O2![]() CO2+2H2O
CO2+2H2O
18. 已知
A.
C.
﹡19. mg红磷在含ng氧气的空气中燃烧,生成pg五氧化二磷,则 ( )
A. p=m+n B. p>m+n C. P<m+n D. P≤m+n
﹡20. 在化学方程式aC2H6+bO2![]() mCO2+nH2O 各化学式前的计量数之间的关系正确的是 ( )
mCO2+nH2O 各化学式前的计量数之间的关系正确的是 ( )
A.
三、简答题
1. 从分子和原子的角度解释为什么参加化学反应的各物质的质量总和一定等于反应后生成的各物质的质量总和。
2. 用质量守恒定律解释下列现象
(1)加热高锰酸钾后留下的固体物质的质量比高锰酸钾的质量小。
(2)液氧气化体积增大,质量不变,符合质量守恒定律。
四、实验题
1. 做白磷燃烧前后质量测定的实验里,锥形瓶底部应铺有细沙,再把白磷置于细沙上,其原因是 ,第二次称量时,一定要待锥形瓶冷却后再称量,这样做的原因是 。
2. 为了验证质量守恒定律。甲、乙、丙三位同学各做了一个实验。
(1)甲同学用实验测定的数据有:木炭和坩埚的总质量m g;其燃烧后灰烬和坩埚的总质量为n g。m和n的关系为:m n(填“<”或“>”或“=”)。
(2)乙同学用实验测定的数据有:光亮的铁钉的质量为x g;其生锈后的质量为y g。x和y的关系为:x y(填“<”或“>”或“=”)。
(3)丙同学用实验测定的数据有:锌、硫酸铜溶液和烧杯的总质量为a g;其反应后的混合物和烧杯的总质量为b g。a与b的关系为:a b(填“<”或“>”或“=”)。
(4)通过对三个实验的分析,你认为用有气体参加和生成的化学反应来验证质量守恒定律时,应 ,才能判定参加化学反应的反应物总质量和生成物总质量是否相等。
![]()
【试题答案】
一、填空题
1. 反应后各生成物质量总和
2. (A+B-C) ![]() A
A
3. 碳、氢 氧
4. 碳 质量守恒
5. CO2
6. 符合化学反应事实 遵循质量守恒定律
7. 12 32 44
8. (1)6NO+4NH3![]() 5N2+6H2O
5N2+6H2O
(2)① 4Al+3O2![]() 2Al2O3
2Al2O3
②2NH4ClO4![]() N2↑+2O2↑+Cl2↑+4H2O↑
N2↑+2O2↑+Cl2↑+4H2O↑
二、选择题
1. C 2.
B 3.
C 4.
A 5.
A 6.
B 7.
C 8.
D 9.
B 10.
A
11. B 12. BC 13. AB
14. D 15.
D 16.
B 17.
C 18.
B 19.
D 20.
B
三、简答题
1. 因为化学反应即化学变化的实质是构成物质的分子分裂成原子,原子又重新组合成新分子的过程,前后原子种类、数目和质量都不变。所以由微粒聚集起来的宏观物质在参加化学反应前后质量的总和不变。
2. ①根据质量守恒定律,参加反应的高锰酸钾的质量等于反应后生成的锰酸钾固体,二氧化锰固体和氧气质量总和。反应后有气体放出,所以留下的固体物质的质量比高锰酸钾的质量小。
②不符合,因为液氧气化是物理变化,没有参加化学反应;
四、实验题
1. 防止集气瓶炸裂 集气瓶内空气受热后膨胀,使气球膨胀,空气浮力变大,测出质量会偏小
2. ①> ②< ③= ④在密闭体系中进行