![]()
【本讲教育信息】
一、教学内容
常见的金属材料
二、学习目标
1、了解常见金属的物理性质,知道金属材料在日常生活和工农业生产中的重要地位。
2、初步建立“混合”能改变物质性质的化学观念。知道在一种金属中熔合进一种或多种其他金属(或非金属),能得到适合人类不同需要的合金。
3、了解重要的铁矿石和炼铁的基本原理。
4、掌握含杂质的反应物或生成物的有关计算。
三、全面突破
知识点(一) 金属的物理性质
1、大多数金属都具有金属光泽,密度和硬度较大,熔、沸点较高,具有良好的延展性和导电、导热性能。在室温下除汞外,金属都是固体。
2、金属的物理性质差异
①金属的物理性质比较相似,但是金属的颜色及其硬度、密度、熔点、导电性和导热性的具体代数值有很大差异。
②几种重要金属的颜色
纯铜是紫红色固体;纯净的铁具有银白色金属光泽。(注意:铁粉由于物理上的光学原因而呈黑色)
③不同的金属还具有各自的特性,物质的性质决定其用途
如:铂的延性好,可以抽成直径仅有1/5000mm的细丝;
金的展性好,可以压成厚度只有1/10000mm的薄片;
钨的熔点高,可以做灯丝;
银的导电性好,广泛用于电子制造业(如电脑、电视机等的印刷电路);
金特有的黄色象征富有和高贵,被大量用作饰品等。
④一些金属物理性质的比较:
|
物理性质 |
物理性质比较 |
|
导电性 (以银的导电性为100作标准) |
银 铜 金 铝 锌 铁 铅 (优):100 99 74 61 27 17 7.9(良) |
|
密度(g/cm3) |
金 铅 银 铜 铁 锌 铝 (大)19.3 11.3 10.5 8.92 7.86 7.14 2.70(小) |
|
熔点/℃ |
钨 铁 铜 金 银 铝 锡 (高)3410 1535 1082 1064 962 660 232(低) |
|
硬度 (以金刚石的硬度为10作标准) |
铬 铁 银 铜 金 铝 铅 (大)9 4~5 2.5~4 2.5~3 2.5~3 2~2.9 1.5(小) |
⑤金属之最
地壳中含量最高的金属元素——铝
人体中含量最高的金属元素——钙
目前世界年产量最高的金属——铁
导电、导热性最好的金属——银
硬度最高的金属——铬
熔点最高的金属——钨
密度最大的金属——锇
密度最小的金属——锂
3、金属材料的分类

注意:黑色金属是工业上的一种划分方法,而不是从颜色上区分,纯净的铁是银白色,具有金属光泽的固体,铁粉才是黑色的。
【典型例题】
例1、下表列出了几种物质的熔点(在标准大气压下):
|
物质名称 |
固态水银 |
金 |
铜 |
铁 |
钨 |
固态氢 |
|
熔点 |
-38.8 |
1064 |
1083 |
1535 |
3410 |
-259 |
据此判断以下说法中正确的是( )
A. 铜球掉入铁水中不会熔化
B. 在零下
C. 水银温度计可测量零下
【解析】题目提供了几种物质的熔点数据,根据数据对选项的正误作出判断。铁的熔点比铜高,A错;-
【答案】D
例2、某种新型“防盗玻璃”为多层结构,每层中间嵌有极细的金属线,当玻璃被击碎时,产生电信号,与金属线相连的警报系统就会立刻报警,这利用了金属的( )
A. 延展性 B.
导电性 C. 弹性 D. 导热性
【解析】这是一个联系实际的问题。首先应明确,这里讲的金属丝应该是导电性、延展性等性能极好的金属,如金、银、铜、铝等。在平常状态下,那些金属线与报警系统之间是通着电的,而当玻璃碎掉后,金属线断开,电流消失,报警系统感受不到电流,便开始报警,因此是利用了金属的导电性。
【答案】B
知识点(二) 合金
1、定义:合金是一种金属中加热熔合其他金属或非金属,而形成的具有金属特性的物质。
注意:①合金是一种混合物,至少含有一种金属。
②主要保持原金属的特性。
2、合金与纯金属相比较,性质上存在着较大的差异,金属在熔合了其他金属或非金属后,不仅组成发生了变化,其内部组织结构也发生了变化,从而引起性质的变化。(因此,通过合金知识的学习,同学们应初步建立“混合”能改变物质性质的化学观念。)
①合金比其组成金属的颜色更鲜艳。
②合金的硬度大于组成它们的金属。
③合金的熔点低于组成它们的金属。
④合金的抗腐蚀能力一般强于组成它们的金属。
3、常见的合金:铁合金、铝合金、铜合金、钛合金等




4、古今常用的各种合金:



【典型例题】
例3、下列有关钢的说法错误的是( )
A. 是合金
B. 是金属材料
C. 钢的性能优于生铁
D. 是有机合成材料
【解析】生铁和钢是铁的两种合金,具有金属特性,主要保持原金属铁的性质。属于金属材料,但由于含碳量不同,导致性能也不同,生铁硬而脆,可铸不可锻;钢硬而韧,有弹性,机械性能好,可铸、可锻、可压延。
有机合成材料品种很多,塑料、合成纤维、合成橡胶就是我们通常所说的三大合成材料,主要是指通过化学合成将小分子有机物合成大分子聚合物。没有金属特性。
故D选项错误。
【答案】D
例4、某合金与铁的物理性质的比较如下表所示:
|
|
熔点 |
密度 |
硬度 |
导电性 |
|
某合金 |
|
|
7. 5 |
3. 5 |
|
铁 |
|
|
4. 5 |
17 |
(注:硬度以金刚石的硬度为10作标准,导电性以银的导电性为100作标准)
已知合金耐腐蚀、强度大,从性能上看,该合金不适合制( )
A. 门窗框 B. 炉具 C. 导线 D. 飞机外壳
【解析】A项主要从硬度方面考虑,该合金的硬度大于铁,适合制作门窗框;B项从熔点方面考虑,该合金熔点大于铁,适合于制炉具;C项从导电性方面考虑,该合金的导电性不如铁,不适合作导线;D项从密度方面考虑,该合金密度比铁小,适合制飞机外壳。
【答案】C
例5、下列各组物质中,属于纯净物的一组是( )
A. 24K金、铜导线
B. 不锈钢、黄铜
C. 生铁、钢
D. 钱币、铜钟
【解析】B,C,D都是不同金属的合金,都属于混合物。24K金一般指含金量在99.9%以上的黄金。绝对纯净的物质是没有的,通常所说的纯净物指的是含杂质很少的具有一定的纯度的物质。
【答案】A
例6、下列关于生铁和钢的描述中,正确的是( )
A. 生铁和钢都是混合物,其主要成分都是碳
B. 生铁硬且有韧性,既可铸又可锻
C. 生铁和钢的性能有很大的差别,主要是生铁和钢中含碳量不同
D. 钢是用铁矿石和焦炭做原料炼制成的
【解析】该题容易对生铁,钢的主要成分混淆。生铁(含碳量:2%~4. 3%)和钢(含碳量:0.03~2%)是铁的两种合金,主要成分是铁,A错;由于含碳量不同,性能差别很大,生铁硬而脆,可铸不可锻;钢硬而韧,有弹性,机械性能好;可铸、可锻、可压延,故B错C对;钢是以生铁等为原料进一步冶炼而得到的,故D错。
【答案】C
知识点(三) 炼铁的原理
1、常见铁矿石:磁铁矿(主要成分为Fe3O4)、赤铁矿(主要成分为Fe2O3)、菱铁矿(主要成分为FeCO3)、黄铁矿(主要成分为FeS2)

2、炼铁的原理:
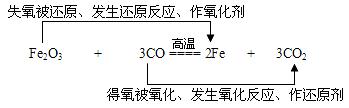
在高温条件下,用还原剂一氧化碳从铁的氧化物中将铁还原出来,其主要反应为:
Fe2O3+3CO![]() 2Fe+3CO2
2Fe+3CO2
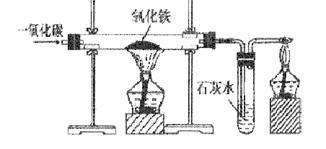
说明:一氧化碳还原氧化铁的实验的要点:
(1)该反应的现象:玻璃管中的固体物质由红色变为灰黑色,试管中的石灰水变浑浊,导管口有蓝色火焰。
(2)实验步骤:①检查装置的气密性;②装入药品并固定;③向玻璃管内通入一氧化碳气体;④给氧化铁加热;⑤停止加热;⑥停止通入一氧化碳。
明确:实验开始时,要先通入一会一氧化碳,然后再给氧化铁加热,原因是:用一氧化碳赶净玻璃管内的空气,以免加热时玻璃管里的一氧化碳和空气的混合气体发生爆炸。
实验结束时,要先停止加热,还要继续通入一氧化碳直到玻璃管冷却,原因是:防止空气进入,与高温的铁反应,以及防止石灰水倒流进玻璃管,使之爆炸。
(3)尾气的处理:点燃或用气球收集后再处理。
(4)石灰水的作用:检验并吸收二氧化碳气体。
3、工业炼铁的过程
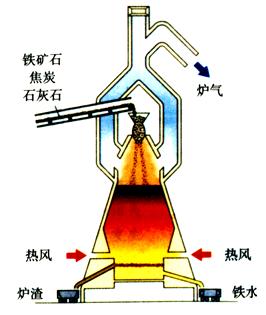
①炼铁的主要设备:高炉。
②高炉炼铁的主要原料:铁矿石、焦炭、石灰石。
③主要反应:
提供热量,达到高温:C+O2 ![]() CO2
CO2
产生还原剂:![]() 2CO CO2 +
C
2CO CO2 +
C ![]() 2CO
2CO
形成生铁:Fe2O3+3CO ![]() 2Fe+3CO2
2Fe+3CO2
形成炉渣:CaCO3 ![]() CaO + CO2 ↑ CaO + SiO2
CaO + CO2 ↑ CaO + SiO2 ![]() CaSiO3
CaSiO3
4、还原反应:含氧化合物中的氧被夺去的反应,叫做还原反应。
5、含杂质的反应物或生成物的有关计算
(1)计算时先把含杂质的物质的质量换算成纯净物的质量,再代入化学方程式进行计算。
(2)混合物中某纯净物的质量分数(即纯度)=(纯净物的质量∕混合物的质量)×100%
【典型例题】
例7、化学兴趣小组用以下装置探究炼铁的原理。
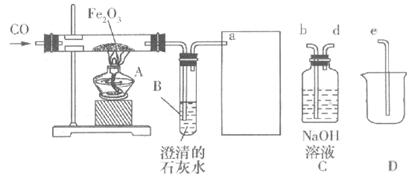
(1)加热Fe2O3之前要先通一会儿CO,目的是
。
(2)方框中连接的是C和D,导管接口的连接顺序为a—( )—( )—( ),如果导管连接错误,后果是
。
(3)玻璃管A中发生反应的化学方程式为
。用这种方法“炼”得的铁与工业上炼出的生铁在组成上的最大区别是
。
【解析】CO是一种可燃性气体,与氧气混合后点燃可能会发生爆炸,因此在实验中要先排尽装置中的空气。对装置C、D分析,尾气进入C后,剩余的CO2与氢氧化钠溶液反应,CO将要被收集在瓶中,瓶中的部分溶液将被“压”到D装置中,所以导管接口的顺序是d、b、e。
【答案】(1)排尽玻璃管中的空气,防止加热时发生爆炸。 (2)d
b e CO排入空气中污染空气
(3)Fe2O3+3CO
![]() 2Fe+3CO2 此种方法“炼”得的铁不含碳,工业上的生铁含有碳。
2Fe+3CO2 此种方法“炼”得的铁不含碳,工业上的生铁含有碳。
例8、某炼铁厂用含氧化铁80%的赤铁矿冶炼生铁。若要炼出1120t含铁95%的生铁,需要含氧化铁80%的赤铁矿多少吨?
【解析】化学方程式表示的是纯净物之间的质量关系,因此,计算时应将含杂质的质量换算成纯净物的质量。
【答案】解法一:设需要含氧化铁80%的赤铁矿的质量为x。
Fe2O3 + 3CO ![]() 2Fe + 3CO2
2Fe + 3CO2
160
112
x·80%
1120t·95%
![]()
x=1900 t
答:需要含氧化铁80%的赤铁矿1900t。
解法二:根据铁元素的质量守恒定律,即生铁中铁元素的质量等于赤铁矿中铁元素的质量。
设需要含氧化铁80%的赤铁矿的质量为x。
x·80%·[(2×56)/(2×56+3×16)]·100% =1120t·95%
x=1900 t
答:需要含氧化铁80%的赤铁矿1900t。
四、考场清单
本讲知识,在选择题、填空题、探究题及计算题中均有可能出题,通常结合生产、生活实际考查学生学以致用的情况。
考点1、金属的物理性质
考点2、合金材料
考点3、炼铁的原理
考点4、含杂质的反应物或生成物的有关计算
考点5、氧化反应、还原反应
五、本讲小结
知识结构:

规律方法:
1. 纯铁质软应用不广,平时常用的是铁的合金(生铁和钢)。
2. 生铁冶炼原理主要是应用还原反应。
疑难辨析:
1. 把纯铁的颜色与“黑色金属”这两个不同概念混淆,造成这一误区的原因主要是对这两种概念没有理解清楚。因此应该明确“黑色金属”是指工业上对金属的分类方法,铁、锰、铬虽属黑色金属,但它们本身的颜色并不一定是黑色,纯铁是银白色。
2. 合金是一种混合物,不能误认为是纯净物,生铁和钢都是铁的合金,其主要成分是铁,不能错认为是碳。
3. 对于生铁和钢各自的性能不能混淆。
4. 纯金属和合金都属于金属材料。
六、超前思维(金属的化学性质)
1、金属与氧气的反应:
|
|
化学方程式 |
|
镁在空气中燃烧 |
|
|
铁在氧气中燃烧 |
|
|
铜在空气中加热 |
|
|
铝在氧气中燃烧 |
|
你认为下列哪些原因会导致金属与氧气反应的难易和剧烈程度不同( )
A. 金属本身的性质 B.
金属与氧气的接触面积
C. 氧气的浓度 D.
温度
2、金属与酸的反应
①默写常见金属活动性顺序表:
。
②在金属活动性顺序中,金属的位置越靠前,它的活动性越 ,排在 的金属能与酸反应放出 ,排在 的金属不能与酸反应放出 。
③写出铝、锌、铁与盐酸反应的化学方程式:
。镁、铝、铁与稀硫酸反应的化学方程式:
。
以上化学反应都属于 反应,其定义是
。
3、金属与盐溶液的反应
铁与硫酸铜反应的化学方程式是
。
铜与硝酸银反应的化学方程式是
。
【模拟试题】(答题时间:40分钟)
一、选择题
1、食品包装中经常用到铝箔。铝能制成铝箔是因为铝具有良好的( )
A. 导电性 B. 延展性 C. 导热性 D. 抗腐蚀性
2、金属材料在人类活动中已得到越来越广泛的应用。下列性质属于金属共性的是( )
A. 硬度很大、熔点很高
B. 有良好的导电性、传热性
C. 是银白色的固体
D. 易与酸反应产生氢气
3、下列物质不属于合金的是( )
A. 氧化铁 B. 锰钢 C. 不锈钢 D. 黄铜
4、世界卫生组织把铝确定为食品污染源之一。铝的下列应用必须加以控制的是( )
A. 用铝合金制门窗
B. 用铝合金作飞机材料
C. 用金属铝制装碳酸饮料的易拉罐 D. 用金属铝制电线
﹡5、北京2008年奥运会火炬“祥云”,外体用轻薄高品质铝合金和优质有机材料加工而成,内部使用的燃料是丙烷。下列有关“祥云”中使用材料的说法错误的是( )
A. 燃料丙烷完全燃烧生成二氧化碳和水,体现了“绿色奥运”的理念。
B. 铝合金比纯铝的硬度小
C. 铝合金质轻且延展性好
D. 火炬外体的制作材料均为可回收的环保材料
6、2007年7月,美国“深度撞击”飞行器成功炮轰彗星,其撞击器采用的是一种含铍(一种金属)3%的铜合金。关于合金,下列说法错误的是( )
A. 合金属于金属材料 B. 只能是金属熔合而成
C. 合金比纯金属性能更优 D. 生铁和钢都属于铁合金
7、“垃圾是放错了位置的资源”应分类回收,生活中废弃的铁锅、铝制易拉罐、铜导线等,可以归为一类回收,它们属于( )
A. 氧化物 B. 金属或合金 C.
盐 D.
碱
﹡8、钛和钛合金是21世纪的重要金属材料,它们具有优良的性能如熔点高、密度小、可塑性好、易于加工、抗腐蚀能力强,钛合金与人体有很好的“相容性”。根据它们的主要性能,下列用途不切合实际的是( )
A. 用于制造船舶
B. 用于制造航天设备
C. 用来做保险丝
D. 可用来制造人造骨
﹡9、下列化学反应不是在炼铁高炉中发生的是( )
A. CO2 + C![]() 2CO
B. C + O2
2CO
B. C + O2 ![]() CO2
CO2
C. Fe2O3+3CO![]() 2Fe+3CO2 D. 4Fe+3O2
2Fe+3CO2 D. 4Fe+3O2![]() 2Fe2O3
2Fe2O3
10、芯片是电脑、“智能”家电的核心部件,它是用高纯度硅制成的。下面是生产单质硅过程中的一个重要反应:SiO2 +
A. 化合反应 B. 分解反应 C. 置换反应 D. 复分解反应
二、填空题与简答
11、金属在生活、生产中的许多应用都主要由金属的物理性质决定。请你根据金属的特性,将你知道的金属特性的应用实例填写在下表中。
|
金属的物理性质 |
体现金属特性的应用 |
|
1、具有美丽的金属光泽 |
|
|
2、硬度大 |
|
|
3、延展性好 |
|
|
4、导电性好 |
|
|
5、导热性好 |
|
﹡12、请把下列铁矿石和其对应的主要成分,用短线连接起来:
磁铁矿
Fe2O3
赤铁矿
FeCO3
菱铁矿
FeS2
黄铁矿
Fe3O4
如果你是炼铁厂的老板,你觉得以上哪种矿石不宜作为炼铁的原料( ),为什么?
。
﹡13、在空白处填写所用原料的名称:
(1)我国北方取暖用的暖气片是用
制作的,暖气管是用 制作的。(填“生铁”或“钢”)
(2)日常生活中使用的刀、剪是用 制作的(“生铁”或“钢”)
(3)一般干电池的负极是用
制作的,正极是用 制作的。
(4)糖果、烟盒中的包装纸是用
制作的。
(5)保温瓶胆壁上的金属是
。
(6)温度计中填充的金属是
14、某钢铁厂高炉炼铁的主要原料是焦炭、赤铁矿(主要成分为Fe2O3)、空气等,主要反应过程如下所示:
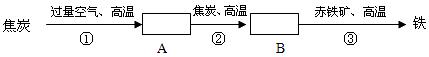
(1)在上面方框中写出相关反应中生成物的化学式。
(2)写出②③两步反应的化学方程式。
②
③
三、实验探究题
﹡﹡15、下图所示是高炉炼铁时高炉内的化学变化过程:
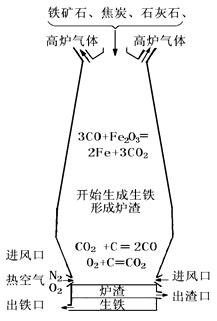
认真阅读有关信息,回答下列问题:
(1)将铁从铁矿石中还原出来的物质是(填化学式) ;
(2)取少量高炉中炼出的生铁放入烧杯中,加入足量稀盐酸,可观察到的现象是
,发生反应的化学方程式为
,当反应停止后,还可观察到烧杯底部有黑色不溶物,该物质是(填化学式)
,请设计一个简单实验证明你的判断,简要写出主要操作和现象
四、计算
﹡16、用2000t含Fe20375%的赤铁矿石,可炼出多少吨含杂质3%的生铁?
![]()
【试题答案】
一、选择题:
|
题号 |
1 |
2 |
3 |
4 |
5 |
|
答案 |
B |
B |
A |
C |
B |
|
题号 |
6 |
7 |
8 |
9 |
10 |
|
答案 |
B |
B |
C |
D |
C |
二、填空题
11、金银饰品 制造刀具、磨具 制造铝箔 导线 铁锅、铝锅
12、磁铁矿(Fe3O4) 赤铁矿(Fe2O3)
菱铁矿(FeCO3)
黄铁矿(FeS2)
不宜作为炼铁的原料的是黄铁矿,因为容易产生SO2对空气造成污染
13、(1)生铁 钢 (2)钢 (3)锌 碳棒(4)铝 (5)银 (6)汞
14、【解析】此题考查的是高炉中用焦炭为原料制取还原剂CO,并用CO还原铁矿石的炼铁过程。
【答案】(1)A:CO2 B:CO (2) CO2 + C ![]() 2CO Fe2O3+3CO
2CO Fe2O3+3CO ![]() 2Fe+3CO2
2Fe+3CO2
15、(1)CO ;(2)有气泡产生、溶液逐渐变为浅绿色;
Fe + 2HCl = FeCl2
+ H2 ↑;C;将黑色固体放在坩埚内加热至其燃烧,并在火焰上方罩一个杯壁沾有澄清石灰水的烧杯,杯壁出现白色斑点。
四、计算
16、1082.5t