![]()
【本讲教育信息】
一、教学内容
第二单元综合素能检测
【模拟试题】(答题时间:90分钟)
相对原子质量:(H—1 O—16 Na—23 S—
一、选择题(本题包括10小题,每小题3分,共30分。每小题只有一个选项符合题意,将符合题意的选项序号填入题后的括号内)
1、
A. 海水是混合物
B. 海水是饱和溶液
C. 海水中的化学资源十分丰富 D. 海水晒盐的原理是蒸发溶剂得到晶体
2、下列过程发生化学变化的是
( )
①海水“晒盐” ②海水“制碱” ③海水淡化 ④从海水中提取镁
A. 全部是 B. 只有② C. 只有②④ D. ①②③
3、在一定条件下,某物质的饱和溶液一定是
( )
A. 浓溶液
B. 加入该溶质的晶体,溶质的质量分数不发生改变的溶液
C. 降温后能析出晶体的溶液
D. 蒸发水分后能析出晶体的溶液
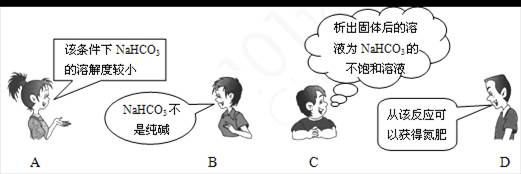
4、“NaCl+CO2+NH3+H2O=NaHCO3+NH4Cl”是著名的“侯氏制碱法”的重要反应。下面是4位同学对该反应涉及的有关知识发表的部分见解。其中不正确的是 ( )
5、嵊泗是个易旱缺水的海岛县. 现在依靠海水淡化技术,每天可生产6600吨淡水,解决了缺水问题。该技术(原理如图所示)采用对海水加压,海水中的溶剂分子可以通过半透膜,而溶质分子很难透过。下列说法正确的是
( )
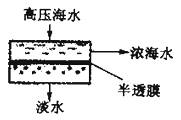
A. 浓海水中溶质质量增加
B. 浓海水的溶质质量分数增大
C. 浓海水的溶质质量分数减小
D. 解决了缺水问题,就可以不用节水了
6、下列各组物质不能发生复分解反应的是
( )
A. 稀硫酸与氢氧化钠溶液
B. 稀盐酸与纯碱溶液
C. 硝酸钾溶液与氯化钠溶液
D. 氯化铜溶液与氢氧化钙溶液
7、只用一种试剂来鉴别NaOH、Ca(OH)2、稀硫酸三种溶液,这种试剂是 ( )
A. 氯化钡溶液 B. 紫色石蕊试液 C. 碳酸钠溶液 D. 酚酞试液
8、下图是KNO3和NaCl的溶解度曲线。下列说法中正确的是
( )
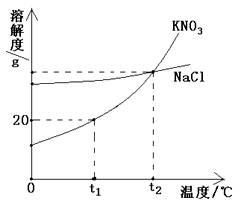
A. NaCl的溶解度不受温度的影响
B. t
C. t
D. 在温度高于t
9、要除去下列三种物质中的少量杂质(括号内的物质为杂质), 甲:CaCO3 (Na2CO3) 乙:NaOH (Na2CO3) 丙:KNO3(NaCl)。 可选用的试剂及操作方法有:①加适量水,搅拌,过滤; ②溶解,加适量石灰水,过滤,蒸发。 ③热水溶解—降温结晶—过滤
下列组合正确的是:
( )
A. 甲—②,乙—③,丙—① B. 甲—①,乙—③,丙—②
C. 甲—②,乙—①,丙—③ D. 甲—①,乙—②,丙—③
10、为了除去粗盐中混有的少量钙盐、镁盐、硫酸盐和泥沙,得到精制食盐水,可将粗盐溶于水,然后进行下列操作:①过滤,②加过量NaOH溶液,③加适量盐酸,④加过量Na2CO3溶液,⑤加过量BaCl2溶液。则正确的操作顺序是
( )
A. ①②③④⑤ B. ②③④⑤①
C. ⑤②④①③ D. ③⑤①②④
二、填空与简答(本题包括5小题,共43分)
11、(4分)从以下物质中,选择适当的物质填空(填序号)
①锰结核 ②纯碱
③可燃冰 ④高锰酸钾 ⑤熟石灰
可用作糕点的盐 ; 被科学家誉为“未来能源”的燃料 ; 蕴藏在海底的金属矿物 ;用于中和硫酸厂污水中过量的酸 。
12、(6分)现有一瓶接近饱和的氢氧化钙溶液,试举出三种使其变成饱和溶液的方法
、
、
。
13、(2分)做馒头的面粉在发酵时会产生一种酸,使蒸出的馒头有酸味。如果在面团中加入一些碳酸钠,可使馒头不酸且松软,其原因是 。
14、(13分)烟台是美丽的海滨城市,有较长的海岸线,海洋资源十分丰富。以下是对海水资源的部分利用。
(1)海水中含量最高的盐是
,海水经
结晶可获得粗盐。
(2)从晒盐后的卤水中可提取重要金属镁。提取镁的步骤如下:
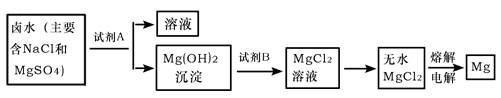
提取Mg的过程中,试剂A最好选用
(从我市有丰富的石灰石资源考虑),试剂B选用
。要使MgSO4完全转化为沉淀,加入试剂A的量应 ,反应的化学方程式为
。电解MgCl2的过程中 能转化为 能。
(3)向饱和的氯化钠溶液中依次通入氨气、二氧化碳,析出碳酸氢钠晶体,加热碳酸氢钠晶体可制得纯碱。写出上述反应的化学方程式:
①
;
②
。
15、(5分)鉴别盐酸、氢氧化钠、碳酸钠和氯化钠四种无色溶液。各取少量,分别加入四支试管中,再分别向这四支试管中滴入紫色石蕊试液。先被鉴别出来的两种物质分别为 、 ;鉴别另外两种溶液你选用的试剂是 (填化学式),有关的方程式为
。
16、(7分)甲、乙、丙三种物质的溶解度曲线如图所示,据图回答:
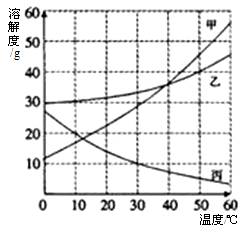
(1)
(2)
(3)要使饱和的丙溶液变为不饱和溶液,可采取的措施是
、
;
(4)
(5)
(6)若甲中含少量乙,应用
的方法提纯甲。
17、(6分)为了除去氯化钠样品中的碳酸钠杂质,兴趣小组最初设计了如下的方案并进行试验。
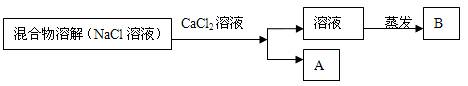
(1)写出沉淀A的化学式
。
(2)加入CaCl2溶液后,分离除去沉淀A的实验操作方法是 。
(3)同学在实验过程中,又发现了新的问题:此方案很容易引入新的杂质,请写出固体物质B的成分
(用化学式表示)。
(4)同学继续探究后又提出新的方案:将混合物溶解,滴加盐酸至不再产生气体为止,则既能除去碳酸钠杂质,又能有效的防止新杂质的引入。写出有关反应的化学方程式:
。
三、实验探究题(本题包括2个小题,共17分)
18、(11分)实验中学同学开展复分解反应研究性学习,设计了如下研究性学习思路:
【练习质疑】下列各组物质间均能反应,写出③、④反应的化学方程式。
①氢氧化钠溶液与盐酸 ②碳酸钠溶液与硫酸
③硫酸铜溶液和氢氧化钠溶液
。
④碳酸钠溶液和氯化钡溶液
。
【研究讨论】上述反应为什么能够发生?是因为这些反应物中含有特殊的阴、阳离子,如①中有H+和OH-,②中有H+和CO32-,③中有
,④中有
。
【构建网络】按照一定的顺序排列这些离子,就可以形成一种网络形式。在网络中,用短线相连的这些阴、阳离子能两两结合生成沉淀或气体或水。现有Ca2+、SO42-,请将它们填入下面合适的“( )”中,使其形成一个更为完整的复分解反应网络。
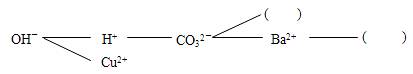
【拓展运用】通过形成的网络,可以判断化合物间能否共存,进行物质的鉴别,用于物质的除杂等。如氢氧化钠溶液混有碳酸钠,可以加入
(填写化学式)除去碳酸钠。
19、(6分)工业上常用电解纯净的饱和食盐水来制烧碱。将制得的烧碱溶液再经浓缩、蒸发等步骤制成固体烧碱。我们知道,原料往往不能全部转化为烧碱(NaOH);另外,如果固体烧碱长时间在仓库放置,表面可能会有Na2CO3杂质生成。
(1)现从仓库中取来烧碱样品,请你推断,该烧碱样品中可能含Na2CO3杂质外,还可能含有的另一种杂质是
。
(2)要检验样品中可能含有的这两种杂质,请你完成下列的实验设计方案。
|
实验步骤 |
实验现象 |
结论 |
|
1、取少量样品于试管中并加入过量的稀HNO3 |
|
|
|
2、再向实验①的溶液中加入AgNO3溶液 |
|
|
四、计算题(本题包括1个小题,共10分)
20、向
求:①产生二氧化碳的质量。
②反应后所得溶液的质量分数。
超前思维:
第一单元《常见的酸和碱》
1、酸碱指示剂、酸碱试纸、pH试纸、溶液的酸碱性、酸碱度
2、酸、碱、盐的定义、组成、分类、命名及判断
3、几种常见的酸和碱的俗名、物理性质、特性、使用方法及用途
4、酸、碱的化学性质,有关化学方程式的书写、现象及有关的实验探究
5、中和反应、复分解反应
第二单元《海水中的化学》
1、海水中的物质、海底矿物、海洋资源开发、利用及保护
2、海水提镁、海水淡化、海水“晒盐”、海水“制碱”
3、饱和溶液、不饱和溶液、结晶、溶解度、溶解度曲线
4、粗盐的提纯(不溶性杂质、可溶性杂质)
5、纯碱等盐类物质的重要性质
![]()
【试题答案】
一、选择题:(本题包括10小题,每小题3分,共30分)
|
题号 |
1 |
2 |
3 |
4 |
5 |
|
答案 |
B |
C |
B |
C |
B |
|
题号 |
6 |
7 |
8 |
9 |
10 |
|
答案 |
C |
C |
D |
D |
C |
二、填空与简答
11、② ③ ① ⑤
12、增加溶质、蒸发水分、升高温度
13、碳酸钠能够和发酵时产生的酸发生反应,生成二氧化碳气体,使馒头形成很多小孔,变得松软
14、(1)氯化钠 蒸发
(2)石灰乳 盐酸 过量 MgSO4+Ca(OH)2==Mg(OH)2↓+ CaSO4 电 化学
(3)①NaCl+NH3+
CO2+H2O=NaHCO3+NH4Cl
②2NaHCO3![]() Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑
15、盐酸 氯化钠 Ca(OH)2 Ca(OH)2+Na2CO3=CaCO3↓+
2NaOH(合理即可)
16、(1)40 (2) 乙、甲、丙
(3)降低温度、增加溶剂(水)的量 (4)能 (5)甲(6)降温结晶(即冷却热饱和溶液法)
17、(1)CaCO3 (2)过滤 (3) NaCl和CaCl2 (4)Na2CO3+2HCl=2NaCl+
H2O+ CO2↑
三、实验探究题
18、【练习质疑】③CuSO4 + 2NaOH = Cu(OH)2↓+Na2SO4
④ BaCl2+Na2CO3=BaCO3↓+
2NaCl
【研究讨论】③Cu2+ 和 OH-
④Ba2+ 和CO32-
【构建网络】Ca2+ SO42-
【拓展运用】Ca(OH)2或Ba(OH)2
19、(1)氯化钠
(2)
|
|
|
|
|
|
有气泡产生 |
含有Na2CO3 |
|
|
有白色沉淀生成 |
含有NaCl |
四、计算题
20、解:设产生二氧化碳的质量为x,生成Na2SO4的质量为y
Na2CO3+H2SO4=Na2SO4+H2O+CO2↑
106
142
44
106:142=
106:44=
反应后所得溶液的质量分数是:
答:产生二氧化碳的质量为