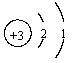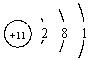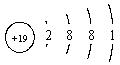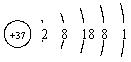![]()
【本讲教育信息】
一、教学内容
原子和离子
二、考点清单
1、初步了解原子核外的电子是分层排布的;认识原子结构示意图
2、认识原子结构与元素化学性质的关系;
3、了解离子的概念,并掌握它的形成规律及与原子的区别。
4、了解化合物形成的过程。总结物质与其构成离子的关系,完成课后练习题
三、全面突破
知识点1:原子核外电子的排布
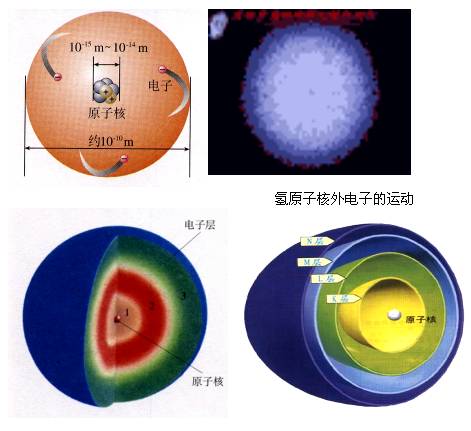
1、核外高速运动的电子是按能量由低到高,离核由近至远的顺序分层排布的
核外电子的运动状况:高速运动 分层排布
电 子 层 数 :一 二 三 四 五 六 七……
电 子 能 量 : 逐 渐 升 高
离 核 距 离 : 逐 渐 增 大
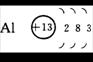
2、原子结构示意图:
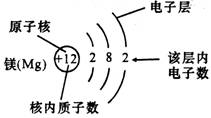
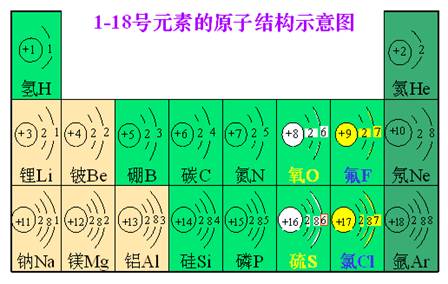
3、原子的最外层电子数与元素的分类及化学性质的关系
|
|
最外层电子数 |
得失电子 |
元素性质 |
|
金属元素 |
一般<4 |
易失 |
活泼 |
|
非金属元素 |
一般≥4 |
易得 |
活泼 |
|
稀有气体元素 |
8或2(He) |
稳定 |
稳定 |
①元素的化学性质决定于原子的最外层电子数。
②原子最外层电子数为8(氦为2)的结构称为稳定结构。
【典型例题】
例1:根据钠原子的结构示意图  ,不能确定的是
,不能确定的是
A. 元素种类 B. 质子数 C. 相对原子质量 D.
电子层数
【解析】解答本题的关键是弄清原子结构示意图中各部分表示的含义。圆圈里面的数字表示原子核内的质子数,弧线表示电子层,弧线上的数字表示该电子层上的电子数。因此,从钠原子的结构示意图中,我们可以看出:钠原子的质子数为11,核外有3个电子层,最外层有1个电子,是金属元素。由于相对原子质量≈质子数+中子数,而中子数在原子结构示意图中没有反映,因此,仅凭钠原子的结构示意图,无法确定其相对原子质量。
【答案】C。
例2:下列叙述正确的是
A. 原子是不能再分的最小粒子
B. 同种元素的粒子,不一定具有相同的质子数
C. 混合物中不可能只含有一种元素
D. 元素的化学性质跟原子的最外层电子数关系非常密切
【解析】原子在化学反应中不能再分,但它并不是构成物质的最小粒子。原子是由原子核和核外电子构成的,在其他变化中还可以再分。元素的种类由质子数决定,即同种元素的质子数一定相同。混合物是由多种物质混合而成的,但组成元素却可能只有一种,如由O2和O3组成的混合物就只含有一种元素(即O元素)。元素的化学性质主要由该元素原子的最外层电子数决定。
【答案】D。
例3:已知溴的元素符号为Br,溴原子的结构示意图如图所示。
![]()
(1)x的值为________。
(2)溴元素的化学性质与下图中____(填序号)元素的化学性质最相似。
![]()
【解析】(1)任何元素的原子,核外电子总数一定等于核内质子数,因此x=35。
(2)元素的化学性质主要由该元素原子的最外层电子数决定。溴原子的最外层电子数为7,图中B选项的原子结构示意图表示的原子的最外层电子数也为7,所以二者的化学性质最相似。
【答案】(1)35(2)B
例4:某元素的原子最外层电子数为2,则该元素
A. 肯定是金属元素
B. 肯定是非金属元素
C. 肯定是稀有气体元素
D. 可能是金属元素或稀有气体元素
【解析】一般来说,金属元素的原子最外层电子数小于4个,非金属元素的原子最外层电子数大于或等于4个,稀有气体元素的原子最外层电子数是8个(当第一层是最外层时有2个电子,如He)。
【答案】D。
例5:元素周期表是我们学习和研究化学的重要工具。下表是元素周期表中1~18号元素原子的核外电子排布,我们对它进行研究:
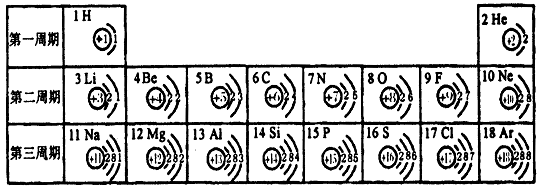
(1)第17号元素的名称是 ,它属于 元素(填“金属”或“非金属”),它在化学反应中容易 (填“得”或“失”)电子。
(2)从上表中我们还可以探究出以下规律:
①原子序数与原子核电荷数在数值上相等;
②
;
③
;
④
。
【解析】本题为原子结构与元素性质之间关系的发现规律式开放性试题。元素性质由原子最外层电子数决定,最外层电子数出现周期性的变化,则元素的性质也将呈现周期性的变化规律。原子中最外层电子数小于4的元素一般为金属元素,易失去电子;最外层电子数大于或等于4的元素一般为非金属元素;最外层电子数等于8(氦为2)的元素为稀有气体元素。
【答案】(1)氯 非金属 得
(2)②每周期中的原子核外电子层数都相等,都等于周期数
③每一周期元素原子的最外层电子数从左到右逐渐增大
④每一竖行(族)中元素原子的最外层电子数相等
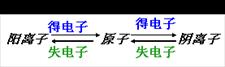
知识点2:离子的形成
1、定义:带电的原子或原子团叫离子. (原子团:常作为一个整体参加反应的原子集团)
2、分类:
(1)阳离子:带正电荷的离子(原子失电子)
(2)阴离子:带负电荷的离子(原子得电子)
3、离子的表示方法:
(1)离子符号:(离子符号歪戴帽,先写数字后写号)Na+、Cl-、O2-、2Mg2+
*离子符号表示的意义:表示离子(或一个离子),如:
Mg2+——表示镁离子(一个镁离子)
2Mg2+:小2表示每个镁离子带两个单位的正电荷,大2表示两个镁离子
离子符号前面的化学计量数(系数)表示离子的个数;
(2)离子结构示意图:(特点:最外层稳定结构)
阳离子:质子数>电子数
阴离子:质子数<电子数
①金属元素的原子容易失去最外层电子,失去m个电子就带m个单位正电荷,表示为Rm+. 如铝原子Al→铝离子![]() .
.

(13=2+8+3)原子结构示意图 阳离子结构示意图(13>2+8)
②非金属元素的原子容易得到电子,达到8电子稳定结构,得到n个电子,就带n个单位负电荷,表示为Rn-. 如氧原子O→氧离子O2-.

(8=2+6)原子结构示意图 (8<2+8![]() 阴离子结构示意图
阴离子结构示意图
4、原子和离子的区别与联系
|
|
原子 |
离子 |
|
|
数量关系 |
核电荷数=质子数=电子数 |
核电荷数=质子数>电子数 |
核电荷数=质子数<电子数 |
|
电性 |
中性 |
带正电荷 |
带负电荷 |
|
稳定性 |
不稳定 金属原子易失电子 非金属原子易得电子 |
稳定 |
|
|
符号 |
元素符号:H Al Cl |
阳离子符号 H+ Al3+ |
阴离子符号Cl- |
|
结构示意图特点 |
|
|
|
|
|
比对应原子少一个电子层 |
电子层数不变 |
|
|
与相同电子层数的惰性原子的核外电子排布相同 |
|||
|
相互转化 |
|
||
5、常见原子团离子:
(1)NH4+:铵根离子 (2)OH-:氢氧根离子 (3)NO3-:硝酸根离子
(4)SO42-:硫酸根离子 (5)CO32-:碳酸根离子
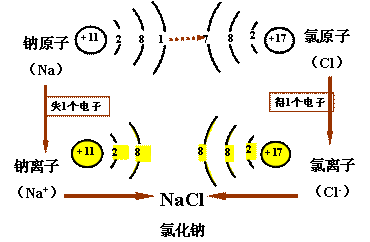
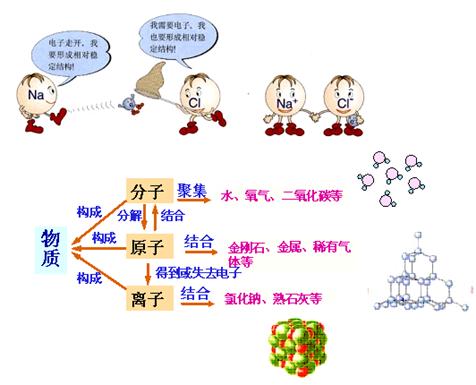
6、化合物的形成过程:
问题:钠原子和氯原子核外电子都未达到相对稳定结构,那么,它们在化学反应中是怎样达到相对稳定结构的呢?
【典型例题】
例1:钠原子和钠离子的结构示意图如下:
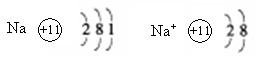
请回答:(1)由于它们的原子核内( )相同. 所以它们都属于钠元素。
(2)钠原子和钠离子的化学性质( )。(填“相同”或“不相同”)
【解析】钠原子和钠离子原子核内都是11个质子,所以它们都属于钠元素,钠原子最外层有一个电子,易失去。而钠离子最外层有8个电子,达到稳定结构,所以它们的化学性质不相同。
【答案】(l)质子数 (2)不相同
例2:根据结构示意图回答
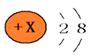
(1)如果该图表示的是原子,则X值为_____ 。
(2)如果该图表示的是带两个单位正电荷的阳离子,则X值为_____ 。
(3)如果该图表示的是带两个单位负电荷的阴离子,则X值为______ 。
【解析】(1)原子中质子数=核外电子数,x=2+8=10
(2)阳离子是原子失去电子后形成的,带2个单位正电荷说明失去了2个电子,则原子中的质子数=阳离子中的电子数+失去的电子数=2+8+2=12;
(3)阴离子是原子得到电子后形成的,带2个单位负电荷说明得到了2个电子,则原子中的质子数=阴离子中的电子数-得到的电子数=2+8-2=8;
【答案】(l)10 (2)12 (3)8
例3:1996年科学家在宇宙深处发现了H3+离子和H3分子。请回答:
(1)1个H3+离子中含有 个质子、 个电子;
(2)构成H3分子的原子的结构示意图是 ;(填序号)
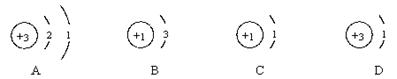
(3)H3属于 。(填“混合物”、“单质”或“化合物”)
【解析】本题是对科技新发现“H3+”“H3”的有关化学知识的考查。该题中,由于1个“H3+”离子中含有3个氢原子核,但又失去了1个电子,故有3个质子和2个电子。在“H3”分子中,氢原子的核内有一个质子,核外有1个电子,故C正确。由于“H3”是由同种元素组成的纯净物,故属于单质。
【答案】(l) 3、2, (2)C (3)单质
例4:科学家已研究出高能微粒N5+,关于它的说法正确的是
A. N5+是由5个氮原子构成的单质
B. N5+中只有质子没有中子和电子
C. 每个N5+中含有35个质子和34个电子
D. 每个N5+中含有35个质子和35个电子
【解析】N5+是带电的微粒,不是物质,所以A是错的。
N5+是离子符号,一个N5+离子中含有5个氮原子,5个氮原子共应有35个质子、35个电子,而此微粒带一个单位正电荷,应已失去1个电子,为35个质子、34个电子。
【答案】C
例5:在分子、原子、质子、中子、电子、原子核、离子这些微粒中:
(1)能直接构成物质的微粒有_________________;
(2)能保持物质化学性质的微粒有_____________;
(3)显示电中性的微粒有__________________;
(4)带正电的微粒有______________________;
(5)带负电的微粒有______________________;
(6)质量最小的微粒有_____________________;
(7)参加化学反应时,一定发生变化的微粒有__________;
(8)在同一原子里数目相等的是_____________;
【解析】本题综合考查微观粒子的性质,思考容量大,解题的关键在于把各种微粒性质的异同点搞清楚。(1)能直接构成物质的微粒有分子(如氧气)、原子(如金属铜)和离子(如食盐NaCl);(2)能保持物质化学性质的微粒当然也包括分子、原子、离子、而分子只是保持物质化学性质的一种微粒;(3)分子、原子不显电性,而中子本身就不带电;(4)质子和原子核带正电荷,离子有阴离子和阳离子之分,其中阳离子带正电荷;(5)电子和阴离子带负电荷;(6)质量最小的微粒应为电子;(7)化学变化时分子一定要解离成原子,再重新结合成其他物质的分子;(8)原子之所以不带电,是因为带正电的质子与带负电的电子数目相等。
【答案】(1)分子、原子、离子;(2)分子、原子、离子;(3)分子、原子、中子;
(4)原子核、质子、阳离子;(5)电子、阴离子;(6)电子(7)分子
(8)质子和电子。
例6:下图是1~18号元素原子最外层电子数与原子核电荷数的关系图。试回答:
(1)一个水分子共有 个原子核、 个质子。
(2)一个Mg2+核外共有 个电子;Cl_的最外层电子数和 原子的最外层电子数相同。
(3)通过对下图的分析,你能发现哪些规律? 。
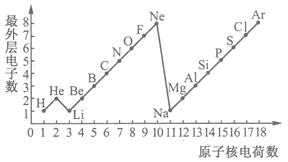
【解析】本题考查原子结构、最外层电子数与核电荷数之间的关系,一个水分子中含有两个氢原子和一个氧原子,所以有3个原子核,1个氢原子有1个质子,共有2个氢原子,1个氧原子有8个质子,故共有10个质子。
1个镁离子是在镁原子基础上失去2个电子而形成的,故有12-2=10个电子,氯离子的最外层应有8个电子,与Ar或Ne原子的最外层电子数相同。
图像呈现的规律是开放性的,元素的性质由原子最外层电子数决定,最外层电子数出现周期性的变化,则元素的性质也将呈现周期性变化规律。原子中最外层电子数小于4的元素一般为金属元素,易失去电子;最外层电子数大于或等于4的元素一般为非金属元素,易得电子;最外层电子数为8个(氦为2个)的元素为稀有气体元素。
【答案】(1)3 10 (2)10 Ne、Ar
(3)随着原子核电荷数的递增,元素原子的最外层电子数呈周期性变化
(其它合理答案均可)
四、应考锦囊
原子,分子,离子,元素这都是基本化学概念,准确的理解这些概念,记忆这些概念,特别是应用这些概念解决问题,是一名优秀的初中毕业生必备的化学素质,也是学好高中化学的前提。
提示:
1、粒子包括质子、中子、电子、离子、原子、分子、原子核等
2、注意以下几种对粒子认识的误区:
(1)电子层排布相同的粒子属于同种元素。如Na+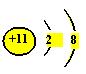 和Ne
和Ne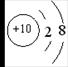 属于不同种元素。
属于不同种元素。
(2)质子数相同的粒子属于同种元素。如H2O和Ne,NH3和Ne原子,它们核内的质子数都为10。
(3)同种元素的粒子化学性质相同,如Na原子比Na+的化学性质活泼。
说明:最外层电子数相同其化学性质不一定都相同(Mg,He最外层电子数为2)
最外层电子数不同其化学性质有可能相似(He,Ne均为稳定结构)
3、怎样判断物质由分子、原子还是离子构成?
分子、原子、离子都是构成物质的基本微粒.
判断物质是由哪种微粒构成的,可
以从以下角度分析:
①从物质分类的角度:单质中金属、金刚石、石墨都是由原子构成的.
如,铁是由铁原子构成,金刚石、石墨是由碳原子构成的,大部分气体是由分子构成的,如氧气由氧分子构成,氮气由氮分子构成.
化合物中的碱、盐以及某些金属氧化物都是由离子构成的. 非金属氧化物如水、二氧化碳都是由分子构成的,气体化合物大多是由分子构成的.
②从物质组成的角度:金属元素组成的物质一般由原子构成,几种非金属元素组成的物质是由分子构成的,典型金属元素与典型非金属元素组成的化合物为离子化合物,由阴、阳离子构成.
4、怎样由结构示意图来判断一种微粒是原子,还是离子?
原子结构示意图能够简略表明核外电子排布的情况,要区别是原子、阳离子还是阴离子,需抓住它们在电性和结构上的主要区别.
|
微粒 |
电性 |
核外电子总数 |
|
原子 |
不显电性 |
等于核电荷数 |
|
阳离子 |
带正电 |
小于核电荷数 |
|
阴离子 |
带负电 |
大于核电荷数 |
五、本讲小结
了解核外电子排布,认识原子结构示意图,认识元素性质与原子结构的关系
会分析阴、阳离子与对应原子的关系,根据结构示意图判断原子、离子
运用原子核外电子分层排布知识认识元素周期表
会分析多原子核离子所含的质子总数、核外电子总数

六、超前思维(化学式与化合价)
1、化学式是用____________表示____________的式子。
化学式“H2O”的含义:
2、化合价规律:
①在化合物里,氢通常显_____价,氧通常显_____价;
②金属元素通常显_____价,非金属元素通常显____价。但在非金属氧化物里,氧显___价,另一非金属元素显_____价;
③单质中,元素的化合价为______;
④许多元素具有可变化合价;
⑤不仅元素表现出一定的化合价,某些_____也表现出一定的化合价,如硫酸根为 价,碳酸根为______价,铵根为______价,硝酸根为 价等;
⑥任何化合物中,其正、负化合价的代数和均为_________。
3、几种数字的含义
“系数”:
“脚标”:
“右上角”:
“正上方”:
【模拟试题】(答题时间:35分钟)
一、选择题
1、与元素的化学性质关系最密切的是
A. 核内质子数 B. 核外电子数 C. 电子层数 D.
最外层电子数
2、下列粒子结构示意图,代表原子的是
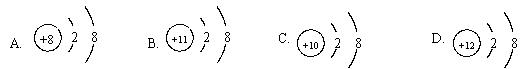
3、下列微粒结构示意图,表示阴离子的是
 4、下列微粒结构示意图中,具有稳定结构但不是原子的是
4、下列微粒结构示意图中,具有稳定结构但不是原子的是
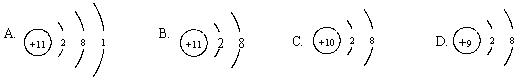
5、下列各组是元素的原子结构示意图,其中具有相似化学性质的一对元素是
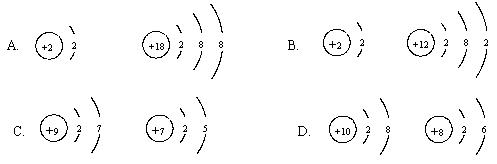
6、与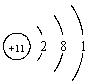 中数字“
中数字“
A. 元素的化学性质、化合价 B.
元素的种类、原子的质量
C. 元素的核电荷数、原子的数目 D. 物质的状态、原子的稳定性
7、关于氯离子与氯原子的认识中,不正确的是
A. 它们的质子数相同 B. 它们的电子数相同
C. Cl-的最外层电子数相对稳定 D. 它们的电子层数不同
8、关于Fe、Fe2+、Fe3+三种粒子,下列判断错误的是
A. 它们的质子数相同
B. 它们的核外电子数不同
C. 三者几乎质量相等
D.
三者都是稳定结构
9、下列说法不正确的是
A. 在多个电子的原子里,电子是分层排布的
B. 具有稳定结构的粒子一定是稀有气体元素的原子
C. 非金属元素的原子的最外电子层上电子一般多于4个
D. 原子结构示意图可简明、方便地来表示原子的结构
10、原子变成离子,一定发生变化的是
A. 核外电子的排布 B.
原子的核电荷数
C. 相对原子质量 D.
电子层数
11、一种元素的离子变成原子,下列叙述正确的是
A. 一定失去电子 B.
一定得到电子
C. 得失电子都有可能 D.
既不能得到电子,也不能失去电子
12、某元素的原子结构示意图为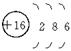 ,有关该元素的说法错误的是
,有关该元素的说法错误的是
A. 原子的核内质子数为16 B. 原子的核外有3个电子层
C. 原子的最外层电子数为6 D. 属于金属元素
13、核内有19个质子和20个中子,核外有18个电子的粒子一定是
A. 原子 B.
分子 C.
阴离子 D.
阳离子
14、下列说法正确的是
A. 分子是保持物质性质的一种粒子 B. 原子是不能再分的粒子
C. 离子是带电荷的原子或原子团 D. 不同种离子的核外电子数一定不相同
*15、下列说法中,不正确的是
A. 同一元素的原子和离子电子层数可能相同,也可能不同
B. 分子、原子、离子都能构成物质
C. 元素的化学性质主要取决于原子的最外层电子数
D. 氯化钠是通过阴、阳离子的静电作用形成的化合物。因此,氯化钠带有一定的电荷
16、下列说法正确的是( )
A. 钠原子失去一个电子就变成稀有气体元素氖的原子
B. 原子最外层电子数少于4个的元素,一定是金属元素
C. 非金属原子最外层电子数多于或等于4个,一般不易得到或失去电子
D. 氯原子得到一个电子后,就变成了与氩原子电子层结构相似的阴离子
*17. 已知M2-离子核外有n个电子,则该元素的原子核内质子数为( )
A. n B.
n-
**18、X、Y、Z、Q四种元素的核电荷数分别为a、b、c、d(均小于18),若它们的离子Xm+、Yn+、Zm-、Qn-的电子层数相同,则下列关系中,正确的是 ( )
A. a-b=n-m B. b-d=2n C. c-d=m+n D. a-c=0
二、填空题:
1、构成物质的微粒有_________ _________ __________。下列物质:①水②二氧化碳③氧气④汞⑤稀有气体⑥氯化钠,由分子构成的是________;由原子构成的是__________;由离子构成的是__________.
2、某元素的原子结构示意图为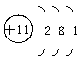 ,该原子的质子数为__________,核外共有__________个电子,分为______个电子层,第二层上有______个电子,最外电子层上有__________个电子,在化学反应中,该原子易________电子,变成______离子,其离子符号为______。
,该原子的质子数为__________,核外共有__________个电子,分为______个电子层,第二层上有______个电子,最外电子层上有__________个电子,在化学反应中,该原子易________电子,变成______离子,其离子符号为______。
3、写出下列离子的符号
带一个单位正电荷的氢离子 ,带两个单位正电荷的铜离子 。
带三个单位正电荷的铝离子 ,带一个单位负电荷的氯离子 。
带两个单位负电荷的氧离子 。
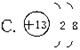
4、根据下列粒子结构示意图回答:
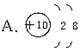
![]()
![]()
(1)表示原子的粒子是(填序号)__________;
(2)表示具有稳定结构的粒子是(填序号)____;
(3)表示同一种元素的不同粒子的是(填粒子的化学符号)__________。
5、Al和Al3+属于同一种元素,因为它们的__________________相同。Al和Al3+属于(相同或不同)________的粒子,两者的性质______________________,因为它们核外的电子总数____________同。
**6、已知四种元素A、B、C、D,其中A- 离子核外电子排布与氩原子相同;B原子比D原子多两个电子层,B原子的最外层电子数与其电子层数相同;
C原子核外电子数比B原子多3个;D+离子的核外没有电子。这四种元素的元素名称为:
A:________________B:______________C:________________D:____________
*三、简答题:
下表列出了四种金属元素的原子结构及单质的性质等具体情况:
|
元素 名称 |
元素 符号 |
原子结构示意图 |
密度 g/cm3 |
熔点/℃ |
沸点/℃ |
与冷水反应 |
|
锂 |
Li |
|
0.534 |
180.5 |
1347 |
剧烈 |
|
钠 |
Na |
|
0.97 |
97.81 |
882.9 |
剧烈 |
|
钾 |
K |
|
0.86 |
63.65 |
774 |
剧烈 轻微爆炸 |
|
铷 |
Rb |
|
1.532 |
38.39 |
688 |
剧烈 轻微爆炸 |
根据以上资料分析,你发现了哪些规律?
(1)
;
(2)
;
(3)
;
(4)上表所列规律中,有一种规律是决定其他规律的,该规律是:
。
![]()
【试题答案】
一、选择题:
|
题号 |
1 |
2 |
3 |
4 |
5 |
6 |
|
答案 |
D |
C |
C |
BD |
A |
A |
|
题号 |
7 |
8 |
9 |
10 |
11 |
12 |
|
答案 |
B |
D |
B |
A |
C |
D |
|
题号 |
13 |
14 |
15 |
16 |
17 |
18 |
|
答案 |
D |
C |
D |
D |
B |
B |
二、填空题:
1、分子、原子、离子 ①②③ ④⑤ ⑥
2、11 11
3 8 1 失 阳 Na+
3、H+ Cu2+ Al3+ Cl- O2-
4、(1)ABD(2)AC(3)Al Al3+
5、质子数(核电荷数) 不同 不同 不
6、A 氯 B铝 C硫 D氢
三、简答题:
1)对同一族元素随着核电荷数的增大,电子层数逐渐增加
(2)对同一族元素随着核电荷数的增大,一般说来单质的密度逐渐增大,溶、沸点逐渐降低
(3)对同一族元素随着核电荷数的增大,单质的化学活泼性逐渐增强
(4)随着核电荷数的增大,电子层数逐渐增加