![]()
【本讲教育信息】
一、教学内容
单元复习《海水中的化学》
二、学习目标
1、运用图示、列表等方式认识海洋中蕴藏着丰富的资源,认识合理开发海洋资源与保护海洋环境的辩证关系。通过对海水淡化的实验探究,学会蒸馏法分离物质,认识海水淡化的可行性,进一步树立资源意识。(热点)
2、了解海水“晒盐”的过程,认识饱和溶液、结晶等概念。认识溶解度的含义,绘制溶解度曲线。探究哪些因素影响固体物质在水中的溶解限量,初步学会合理控制实验条件。(重点、难点)
3、学会粗盐提纯的实验方法(重点)。了解食盐在生产、生活中的重要用途。
4、学习氨碱法制纯碱的简单原理和主要流程,探究纯碱的性质,了解纯碱的主要用途,初步理解盐类的含义。(重点、难点)
三、全面突破
知识专题(一):海水淡化
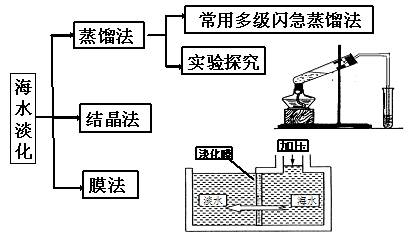
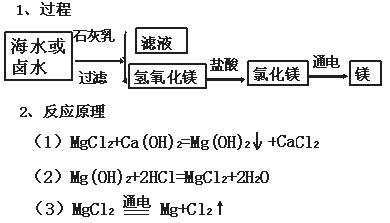
知识专题(二):海水提镁
知识专题(三):海水“晒盐”
1、原理:
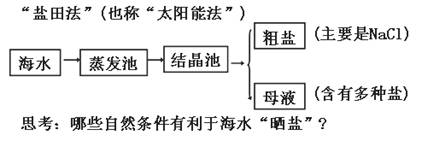

2、粗盐的提纯:

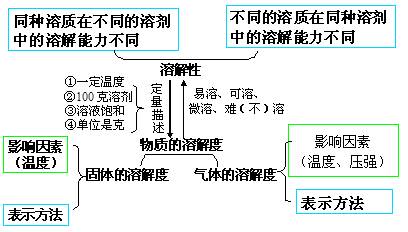
知识专题(四):饱和溶液与不饱和溶液、结晶、溶解度
1、饱和溶液与不饱和溶液相互转化

2、结晶:在一定条件下,固体物质从它的饱和溶液中以晶体形式析出的过程。
(1)晶体:具有天然规则几何外形的固体。



3、溶解度
知识专题(五):氨碱法制纯碱
原理:在食盐水中通入氨气变成饱和的氨盐水,然后在氨盐水中通入足量的CO2生成NaHCO3,由于NaHCO3在该状态下溶解度很小,呈晶体析出,同时NaHCO3不稳定,受热后生成纯碱、水和二氧化碳。
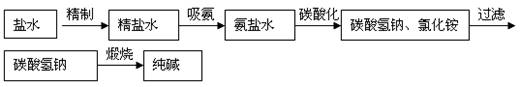
相关反应的化学方程式:
NaCl+NH3+ CO2+H2O=NaHCO3+NH4Cl
2NaHCO3![]() Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑
知识专题(六):纯碱的性质、盐的性质
1、纯碱的性质
(1)物理性质:白色固体,易溶于水。
(2)化学性质:
①与指示剂的作用
②与酸反应:Na2CO3
+2HCl=2 NaCl+ H2O+CO2↑
③与氢氧化钙反应:Na2CO3 +Ca(OH)2= CaCO3↓+ 2NaOH
2、盐的性质
(1)盐的溶解性:
口诀:钾钠硝铵盐溶快,硫酸盐中除钡钙,盐酸盐不溶氯化银,碳酸盐中大都沉。
(2)盐的化学性质
①盐跟酸反应生成另一种盐和另一种酸。例如:AgNO3+HCl=AgCl↓+HNO3
②盐跟碱反应,生成另一种盐和另一种碱。例如:CuSO4+2NaOH=Cu(OH)2↓+Na2SO4
③盐与盐反应,生成另两种盐。例如: BaCl2+Na2SO4=BaSO4↓+2NaCl
④盐与金属反应(以后学习)
【典型例题】
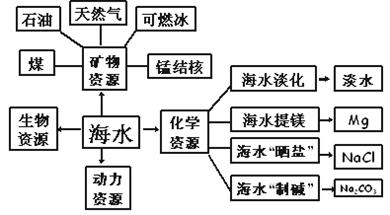
例1、海水是一种重要的自然资源。以下是烟台市对海水资源的部分利用。
(1)从海水中获取淡水。常用的操作方法是 。
(2)从海水中获得氯化钠。将海水进行 可得到粗盐;为除去粗盐中含有的![]() 、Ca2+、Mg2+等杂质,有如下操作:①溶解;②加过量的Na2CO3溶液; ③加过量的BaCl2溶液;④加适量的盐酸;⑤加过量NaOH溶液;⑥蒸发结晶;⑦过滤。正确的操作顺序是
。(用序号填一种合理组合)。
、Ca2+、Mg2+等杂质,有如下操作:①溶解;②加过量的Na2CO3溶液; ③加过量的BaCl2溶液;④加适量的盐酸;⑤加过量NaOH溶液;⑥蒸发结晶;⑦过滤。正确的操作顺序是
。(用序号填一种合理组合)。
(3)从海水中得到金属镁。下图是从海水中提取镁的简单流程。
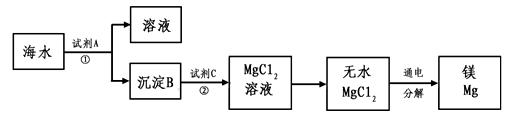
上述过程中,沉淀B与试剂C发生的是中和反应,则沉淀B的化学式为 ,由无水MgCl2制取Mg的化学方程式为
。海水本身就是含有MgCl2的溶液,它与通过步骤①、②得到的MgCl2溶液有何不同: 。
(4)海水“制碱”。下图是海水“制碱”的部分简单流程。
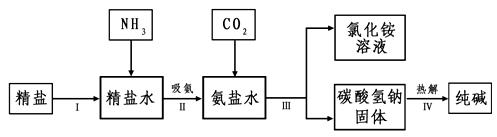
步骤Ⅲ、步骤Ⅳ反应的化学方程式为: 、 。
制氨盐水的过程中要先通入氨气,再通入二氧化碳。如果反过来,二氧化碳的吸收率会降低。这是因为
。
解析:(1)从海水中获取淡水的方法有蒸馏法、结晶法、膜法等,但最常用的是蒸馏法。
(2)由于氯化钠的溶解度受温度的影响不大,所以从海水中获得氯化钠的方法是:蒸发结晶。除去粗盐中含有的SO42-、Ca2+、Mg2+等杂质的方法是:①溶解;③加过量的BaCl2溶液;②加过量的Na2CO3溶液;⑤加过量NaOH溶液;⑦过滤;④加适量的盐酸;⑥蒸发结晶。(只要③在②的前面即可)。
(3)沉淀B与试剂C发生的是中和反应,则沉淀B应为Mg(OH)2;由无水MgCl2制取Mg的化学方程式为MgCl2
通电 Mg+Cl2↑。
(4)步骤Ⅲ是向氨盐水中通入二氧化碳,所以其反应方程式为:
NaCl+NH3+H2O+CO2=NaHCO3+NH4Cl;
步骤Ⅳ为热解碳酸氢钠的反应方程式:2NaHCO3△ Na2CO3+ H2O+CO2↑
答案:(1)蒸馏法
(2)蒸发结晶 ①③②⑤⑦④⑥(或①⑤③②⑦④⑥或①③⑤②⑦④⑥)
(3)Mg(OH)2 MgCl2 通电 Mg+Cl2↑ 后者是经过富集和分离后的溶液(或海水中含有氯化钠等多种溶质,氯化镁的浓度很低)
(4)NaCl+NH3+H2O+CO2=NaHCO3+NH4Cl 2NaHCO3△ Na2CO3+
H2O+CO2↑
氨气溶于水形成碱性溶液,更易于吸收二氧化碳
例2、海洋是个巨大的资源宝库,它不仅孕育着无数的生命,还含有大量的化学物质。
I .海水提溴。从海水中提取的溴约占世界溴产量的![]() ,工业上常用“吹出法”制溴,其工艺流程如下:
,工业上常用“吹出法”制溴,其工艺流程如下:

试回答:
(1)步骤②中的化学方程式为2NaBr+C12=2NaCl+Br2,其反应类型是
,
(2)非金属单质也具有类似金属与盐溶液之间的反应规律,如在溶液中可发生下列反应:C12+2KBr=2KCl+Br2 Br2+2KI=2KBr+I2
由此可判断C12、I2、Br2活动性由强到弱的顺序是_______
。
Ⅱ. 食盐制碱。我国著名化学家侯德榜发明的联合制碱法的主要过程是:①向浓氨水中通入足量的二氧化碳生成碳酸氢铵溶液;②然后向溶液中加入食盐细粒充分搅拌,控制条件,利用物质的性质不同,两者发生反应生成碳酸氢钠,便有晶体析出;③将析出的碳酸氢钠加热制得碳酸钠、二氧化碳和水。
四种盐在不同温度下的溶解度表:
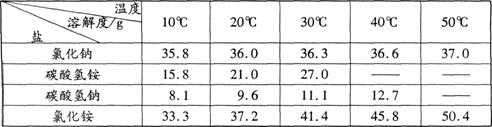
请回答:
(1)碳酸氢铵的化学式是
。
(2)由上表分析过程②中能发生反应的原因是
。
(3)过程③中发生反应的化学方程式是
。
解析:Ⅰ步骤②中的化学方程式2NaBr+C12=2NaCl+Br2,属于置换反应;在C12+2KBr=2KCl+Br2中,C12能置换出Br2 来,说明C12比Br2 活泼,同样Br2能置换出I2,说明Br2比I2活泼,因此,C12、I2、Br2活动性由强到弱的顺序是Cl2、Br2、I2。
向浓氨水中通入足量的二氧化碳生成碳酸氢铵溶液:NH3+H2O+CO2== NH4HCO3;向溶液中加入食盐细粒充分搅拌,则溶液中存在:NH4+、HCO3-、Na+、NO3-四种离子,由上表可知,在相同温度下氯化钠、碳酸氢铵的溶解度都大于碳酸氢钠的溶解度,所以HCO3-和Na+ 结合生成碳酸氢钠而析出。
答案:Ⅰ(1)置换反应 (2)Cl2、Br2、I2或Cl2>Br2>I2
Ⅲ (1)NH4HCO3 (2)在同温度下碳酸氢钠的溶解度小
(3)![]()
例3、一同学用某种粗盐进行提纯实验,步骤见下图。
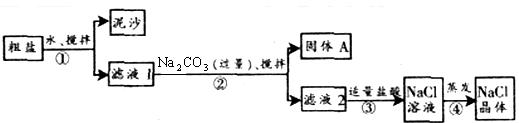
请回答:
(1)步骤①和②的操作名称是____________。
(2)步骤③判断加入盐酸“适量”的方法是____________;步骤④加热蒸发时要用玻璃棒不断搅拌,这是为了防止____________,当蒸发皿中有较多量固体出现时,应__________,用余热使水分蒸干。
解析:本题是过滤和结晶以及提纯的综合应用。除去粗盐中不溶性的泥沙用过滤;用盐酸将滤液2中含有的剩余的碳酸钠除去,盐酸与碳酸钠反应有气泡产生,当溶液中不再产生气泡时表明碳酸钠已除去;由于氯化钠的溶解度受温度的影响变化不大,应采用蒸发结晶的方法。同学们在答此类题时要把握过滤、蒸发等操作要领及加入其他试剂除去可溶性杂质的目的是解决此题的关键。
答案:(1)过滤 (2)不再产生气泡 液体温度过高造成液滴飞溅 停止加热
例4、下图是甲、乙、丙、丁四种物质的溶解度曲线,温度为t℃时,将等质量甲、乙、丙、丁四种物质分别加入到
A. 甲 B.
乙 C. 丙 D. 丁
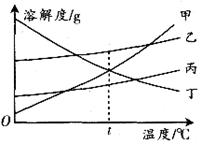
解析:同一温度下将等质量的四种不同物质分别加入到
答案:C
例5、下图为三种固体物质的溶解度曲线,根据该图信息可知:b的溶解度受温度影响不大。此外,你还能获得的信息有:(1)___________;(2)___________;(3)___________。
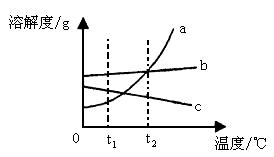
解析:这是考查对溶解度曲线解读能力的一道开放性试题。答案不惟一,可从各物质溶解度随温度的变化情况;某一温度下,各物质溶解度大小的比较;某一温度范围内,各物质溶解度大小的比较;饱和与不饱和溶液之间转化方法;某一物质的结晶方法等多个角度进行思考。
答案:(1)t
例6、打开汽水瓶盖会有大量气泡冒出,产生这一现象的原因是CO2气体的溶解度随 ( )
A. 压强增大而增大 B. 压强减小而减小
C. 温度升高而升高 D. 温度降低而减小
解析:影响气体的溶解度的因素是温度和压强。气体的溶解度随着温度的升高而减小,随着压强的增大而增大。当打开汽水瓶盖后,压强减小,CO2气体的溶解度随压强的减小而减小,所以CO2气体从汽水中逸出,冒出大量气泡。
答案:B
例7、

根据上述实验推断该融雪剂组成可能是__________。
解析:因为该样品加水溶解得无色溶液,故应排除硫酸铜;无色溶液加氢氧化钠得白色沉淀,一定有氯化镁;无色溶液加硝酸银溶液得白色沉淀,只能说明含氯离子,氯离子可能从氯化镁中来,也可能从氯化钠溶液中来,无法判断为硝酸钠。
答案:氯化镁和氯化钠;或氯化镁和硝酸钠;或氯化镁、硝酸钠和氯化钠。
例8、松花皮蛋是我们喜爱的食品。某小组同学查阅资料得知,制皮蛋料泥的原料主要是:生石灰、纯碱、草木灰(含K2CO3)等。同学们对料泥进行了如下探究:
【猜想】猜想I:料泥的主要成分是Ca(OH)2、NaOH、KOH、CaCO3、灰分;
猜想Ⅱ:料泥的主要成分是NaOH、KOH、Na2CO3、CaCO3、灰分。
【实验与现象】实验过程与现象如下图:
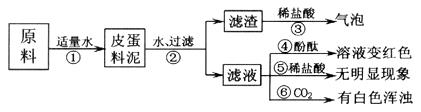
【问题与讨论】
(1)步骤②中所需要的玻璃仪器有:烧杯、玻璃棒、
,玻璃棒在步骤②中的一种作用
。
(2)步骤③的现象说明滤渣中含有:
(写化学式)。
(3)请写出步骤①发生的任意两个反应的化学方程式:
、 。
(4)由上述实验现象推断,猜想 是正确的,其理由是
。
解析:(1)在过滤操作中,需使用的玻璃仪器除烧杯、玻璃棒外,还有漏斗,玻璃棒有搅拌、加速溶解、引流等作用。(2)加稀盐酸产生气泡,证明滤渣中一定存在CaCO3。(3)加水后生石灰变成熟石灰:CaO+H2O=Ca(OH)2,熟石灰又和纯碱、草木灰反应:![]() +
Na2CO3= CaCO3↓+ 2NaOH Ca(OH)2+K2CO3=
CaCO3↓+ 2KOH 。(4)由于滤液加稀盐酸无明显现象,故料泥中一定无Na2CO3 ,通入CO2后有白色沉淀,其中一定有
+
Na2CO3= CaCO3↓+ 2NaOH Ca(OH)2+K2CO3=
CaCO3↓+ 2KOH 。(4)由于滤液加稀盐酸无明显现象,故料泥中一定无Na2CO3 ,通入CO2后有白色沉淀,其中一定有![]() ,故猜想Ⅰ正确.
,故猜想Ⅰ正确.
答案:(1)漏斗 搅拌,加速溶解(或引流) (2)CaCO3
(3)CaO+H2O=Ca(OH)2, Ca(OH)2+K2CO3=
CaCO3↓+ 2KOH
(4)Ⅰ滤液加稀盐酸无明显现象,通入CO2后有白色沉淀
四、考场清单
本单元内容与我们生产、生活密切相关,既是学习的重点,也是中考考查的热点内容。基本题型有:选择题、填空题、实验探究题及计算题等,通常结合生产生活实际考查学生学以致用的情况。
主要考点有:
1、海水中的物质、海底矿物、海洋资源开发、利用及保护
2、海水提镁
3、海水淡化
4、海水“晒盐”
5、海水“制碱”
6、饱和溶液、不饱和溶液、结晶、溶解度、溶解度曲线
7、粗盐的提纯(不溶性杂质、可溶性杂质)
8、纯碱等盐类物质的重要性质
五、本讲小结
知识结构:
学法指导:
1、知识学习与生产、生活实际密切联系。
本单元内容与我们生产、生活密切相关,从“应用——认识——再应用”的理念出发,学习新知识时要密切联系实际问题,吃透知识精髓;利用这些知识解决实际问题时,要把握考查意图,做到有的放矢。
2、善于提取、加工、整理信息。
本单元出现很多饼状图、图表、溶解度曲线等,要尝试去发掘、提取相关信息,并通过加工、整理,转化为自己的认知体系。
3、设计制备物质的方案、评价方案的优劣。
原则:经济利益;环境问题;操作、装置的简单方便;安全及短期利益、长期利益综合考虑,合理选择。
【模拟试题】(答题时间:40分钟)
一、选择题
1、下列关于海水晒盐原理的分析,正确的是
( )
A. 利用阳光照射使海水升温得到食盐
B. 利用阳光和风力将水分蒸发得到食盐
C. 利用机械动力搅拌得到食盐
D. 利用海水在阳光下发生分解反应制得食盐
2、下列物质中,既能跟石灰水反应,又能跟稀盐酸反应的是
( )
A. Na2CO3 B. CuO C. FeCl3 D. KNO3
3、对“
A.
B. 在
C.
D.
4、根据氨碱法用食盐制纯碱的反应原理:(1)NaCl+NH3+CO2+H2O=NaHCO3+NH4Cl
(2)2NaHCO3 △ Na2CO3+CO2↑+H2O下列对上述信息的有关理解中,错误的是 ( )
A. 用食盐制纯碱需要含碳、氧元素的物质
B. 纯碱属于盐类物质
C. 因生成气体,反应不遵循质量守恒定律
D. 副产品氯化铵是一种氮肥
5、氢氧化钾是我国古代纺织业常用的洗涤剂,古人将贝类(主要成分为碳酸钙)灼烧后的固体与草木灰(主要成分为碳酸钾)在水中相互作用,就生成了氢氧化钾。上述叙述中没有涉及到的化学反应类型是
( )
A. 化合反应 B. 分解反应 C. 置换反应 D. 复分解反应
6、嵊泗是个易旱缺水的海岛县. 现在依靠海水淡化技术,每天可生产6600吨淡水,解决了缺水问题。该技术(原理如图所示)采用对海水加压,海水中的溶剂分子可以通过半透膜,而溶质分子很难透过。下列说法正确的是
( )
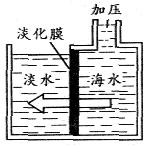
A. 浓海水中溶质质量增加
B. 水分子能透过半透膜
C. 浓海水的溶质质量分数减小
D. 解决了缺水问题,就可以不用节水了
*7、下图是甲、乙两种物质的溶解度曲线。在t
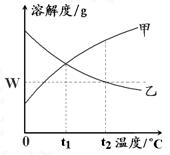
A. 甲物质的溶解度随温度升高而减小
B. 乙物质的溶解度随温度升高而增大
C. t
D. 温度降低到t
*8、下表列出了
|
实验序号 |
水的质量/g |
所加NaCl的质量/g |
所得溶液的质量/g |
|
① |
10 |
2 |
12 |
|
② |
10 |
3 |
13 |
|
③ |
10 |
4 |
13.6 |
|
④ |
10 |
5 |
13.6 |
下列叙述正确的是
( )
A. ①②所得溶液是
B. ①②③所得溶液是
C.
D. ①所得溶液的溶质的质量分数为20%
9、下列两种物质的溶液混合后,能发生反应,且溶液的总质量不会发改变的是( )
A. 氢氧化钠溶液和稀盐酸 B. 碳酸钠溶液和稀盐酸
C. 氯化钠溶液和稀硫酸 D. 碳酸钠溶液和氯化钙溶液
*10、有一包固体粉末,可能含有碳酸钠、硫酸钠、硝酸钡、氯化钾和氯化铜中的一种或几种。未确定其组成,进行如下实验:
(1)取该固体粉末少量,加足量水,搅拌,静置,得到白色沉淀,上层为无色溶液;
(2)过滤,在白色沉淀中加入足量稀硝酸,白色沉淀有一部分溶解,且有无色气体产生。依据上述实验对原固体粉末的判断正确的是
A. 一定含有碳酸钠、硫酸钠、硝酸钡、氯化钾,可能含有氯化铜
B. 一定含有碳酸钠、硫酸钠、硝酸钡,一定不含氯化铜,可能含有氯化钾
C. 一定含有碳酸钠、硫酸钠、硝酸钡,可能含有氯化铜;氯化钾
D. 一定含有碳酸钠、硝酸钡,一定不含硫酸钠、氯化铜,可能含有氯化钾
二、填空题
*11、下图甲是A、B、C三种固体物质的溶解度曲线图。
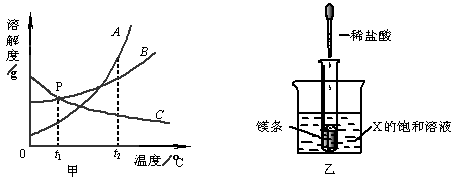
(1)甲图中,P点所表示的为
_________________________________________。
(2)如乙图所示,
12、据下图回答问题:
(1)
(2)
⑶若大量a与少量b混合时,可采用
法得到a物质。
13、下图是常见酸、碱、盐之间的相互转化关系。
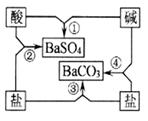
(1)写出图中相应物质的化学式:酸
、碱
。
(2)写出图中反应②和④的化学方程式:
②
④
14、鉴别物质时通常先用物理方法,后用化学方法。现需鉴别三包失去标签的白色固体粉末,它们分别可能是CaCO3、Na2CO3和Na2SO4,请按下表完成实验设计:
|
|
实验步骤 |
实验现象和结论 |
|
步骤一:(物理方法) |
|
|
|
步骤二:(化学方法) |
|
|
三、实验探究题
**15、⑴海水晒盐可得到粗盐和苦卤,其中苦卤是食盐的 (填“饱和”或“不饱和”)溶液,理由是
,利用苦卤、石灰乳、稀盐酸可制得应用于飞机制造业的金属镁。其中发生反应的化学方程式是:①
;②
;③
。
⑵一包从海水中获得的粗盐,其中含有少量的泥沙等不溶性杂质,可采用以下步骤除去 、 、 。课外活动小组对经过初步提纯的粗盐的成分进行探究,并将粗盐进一步提纯。
探究一:这包粗盐中还有什么杂质?
根据海水的成份和初步提纯的实验操作,估计粗盐中可能还有的杂质是CaCl2和MgCl2,现用实验验证这种推测:取样并溶解,加入数滴NaOH溶液,目的是检验有没有(化学式)
,相关的反应方程式为
;接着再加入数滴Na2CO3溶液,目的是检验其有没有(化学式)
,相关的反应方程式为
。实验证明,这包粗盐中含有的杂质是CaCl2。
探究二:这包粗盐中NaCl的质量分数是多少?
按下面步骤继续进行实验:①称取一定质量的样品;②将样品加水溶解制成粗盐溶液;③向粗盐溶液中加入过量某种试剂,过滤;④沉淀洗涤后小心烘干得到纯净固体A;⑤滤液在进行某一操作后,移入蒸发皿蒸发,得到纯净固体B;⑥称量实验中得到的某种固体。
②③⑤步骤中,都使用到同一仪器(填名称)
,在步骤②和⑤中使用这种仪器采用了相同操作,但目的不同,在步骤②中的目的是
,在步骤⑤中的目的是
。步骤③中加入的试剂是(化学式)
,相关反应方程式为
。步骤⑤进行的“某一操作”是
,目的是
,相关反应方程式为
。步骤⑥中,你认为需要称量的固体是A还是B? (填A或B)你不选择称量另一种固体的理由是
。
四、计算题
16、在“侯氏联合制碱法”的工艺流程中,最后一步是用加热碳酸氢钠的方法来制取纯碱。某纯碱生产厂制得的产品![]() 中混有少量
中混有少量![]() 。为了测定产品中
。为了测定产品中![]() 的质量分数,取
的质量分数,取![]() 受热不分解),反应过程中生成二氧化碳气体的质量与反应时间的关系如图所示。
受热不分解),反应过程中生成二氧化碳气体的质量与反应时间的关系如图所示。
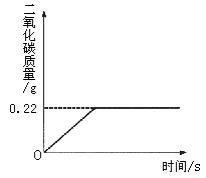
请解答下列问题:
(1)反应过程中生成二氧化碳的质量为_________g;
(2)![]() 的质量分数
。
的质量分数
。
![]()
【试题答案】
一、选择题:
|
题号 |
1 |
2 |
3 |
4 |
5 |
|
答案 |
B |
A |
D |
C |
C |
|
题号 |
6 |
7 |
8 |
9 |
10 |
|
答案 |
B |
C |
A |
A |
B |
二、填空题
11、(1)t
12、(1)
13、(1)H2SO4 Ba(OH)2
(2)②H2SO4 + BaCl2==BaSO4↓+2HCl ④Na2CO3+
Ba(OH)2==BaCO3↓+2NaOH
14、步骤一:分别取少量白色粉末于试管中,加水溶解 不能溶解的证明是CaCO3
步骤二:向另两种无色溶液中加入少量稀盐酸 有无色气泡产生的证明是Na2CO3,无明显现象的是Na2SO4(方法合理即可)
三、实验探究题
15、⑴饱和 里面有析出的食盐晶体 ①MgCl2﹢Ca(OH)2=Mg(OH)2↓﹢CaCl2
②Mg(OH)2﹢2HCl=MgCl2﹢2H2O
③MgCl2![]() Mg﹢Cl2↑
Mg﹢Cl2↑
⑵溶解 过滤 蒸发
探究一:MgCl2
MgCl2﹢2NaOH=Mg(OH)2↓﹢2NaCl CaCl2
CaCl2+Na2CO3=CaCO3↓+2NaCl
探究二:玻璃棒 加速粗盐的溶解 防止由于局部温度过高,造成液滴飞溅。
Na2CO3 CaCl2+Na2CO3=CaCO3↓+2NaCl
加入适量或过量的稀盐酸 除去过量的碳酸钠 Na2CO3+2HCl=2NaCl﹢H2O﹢CO2↑
A B中含有反应生成的氯化钠
四、计算题
16、(1)0.22 (2)99.16%