![]()
【本讲教育信息】
一、教学内容
人类对原子结构的认识
二、考点清单
(1)了解原子结构模型演变的历史;知道化学学科的主要研究对象,了解化学学科的发展趋势;
(2)了解钠、镁、氧等常见元素原子的核外电子排布情况;
(3)认识原子核结构,理解质量数和![]() 的含义;
的含义;
(4)掌握构成原子的微粒间的关系;
(5)知道元素、核素、同位素概念的含义。
三、全面突破
知识点1、原子结构模型的演变
1. 原子结构模型的演变
(1)道尔顿原子模型(1803年)“实心球式”原子结构模型→

思考:道尔顿的原子学说曾经起了很大的作用,他的学说中,包含下列四个论点:①所有物质都是由非常微小的物质粒子即原子组成的;②原子不能被分割;③同种原子具有相同的质量和性质,不同原子的质量和性质不同;④不同的原子结合形成化合物,在化学变化中,原子仅仅是重新排列,而不会被创造或消失 。从现代的观点看,你认为这四个论点中,不确切的是(D )
A.①②③④ B.只有①②
C.只有②③
D.只有①②③
(2)汤姆生原子模型(1904年)“葡萄干面包式”或“西瓜瓤式”原子结构模型→

(3)卢瑟福原子模型(1911年)
根据粒子散射现象,提出了“行星绕太阳式的”原子核式结构模型→

(4)玻尔原子模型(1913年)
根据氢原子光谱,引入量子力学观点,在“核式”结构模型的基础上,大胆提出新的原子结构模型:电子运动的分层结构模型→

(5)原子的量子力学模型(1927年—1935年)——电子云模型

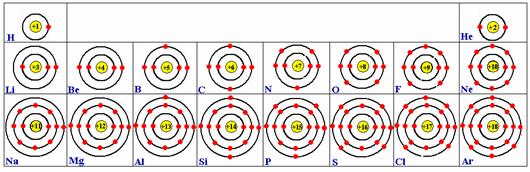
2.原子核外电子排布
现代理论认为,原子核外电子是分层排布的,我们通常用原子结构示意图来表示原子的核外电子排布。
排布规律:
(1)每层最多容纳电子数目为2n2(n表示电子层数)个
(2)最外层电子数目不超过8个(第一层不超过2个)
(3)次外层电子数目不超过18个,倒数第三层电子数目不超过32个。
原子结构示意图
为了形象地表示原子的结构,人们就创造了“原子结构示意图”这种特殊的图形
原子结构与元素性质的关系
结构决定性质
(1)金属元素原子最外层一般少于4个电子,在反应中易失去电子,形成与稀有气体元素原子相同的电子层排布的阳离子(稳定结构)。
(2)非金属元素原子最外层一般超过4个电子,在反应中易得到电子,形成与稀有气体元素原子相同的电子层排布的阴离子(稳定结构)。
(3)原子核在反应中不发生变化,原子的最外层电子数可能发生变化,元素的化学性质取决于原子的最外层电子。
元素化合价与得失电子数目的关系:
(1)金属元素为正化合价,失去电子的数目即为化合价的数值。
(2)非金属元素既可以为正化合价也可以为负化合价,活泼非金属元素的最低负化合价的数值即为得到电子的数目。
元素化合价与最外层电子数目的关系:
①活泼金属元素化合价=__原子最外层电子数
②非金属元素的最低价=_原子最外层电子数-8
【典型例题】
例1. 根据硫元素的原子结构,推测硫元素的最高正价和最低负价分别为( )
A. +2、-2
B. +6、-
解析:元素的最高正价一般为该元素的最外层电子数,非金属元素的最低价=_原子最外层电子数-8
答案:B
例2. 已知最外层电子数相等的元素的原子有相似的化学性质。氧元素原子核外电子分层排布示意图: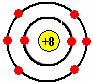 下列原子中,与氧原子的化学性质相似的是( )
下列原子中,与氧原子的化学性质相似的是( )
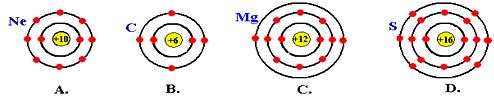
解析:由氧的原子结构示意图可知,氧原子最外层有6个电子,D选项最外层也有6个电子。
答案: D
例3. 某原子的核外M层上有3个电子,那么其L层上的电子数是
( )
A、2
B、
解析:根据核外电子的排布规律:内层电子排满后再排外层电子,所以L层为8个电子
答案:B
例4. 根据下列几种粒子的结构示意图,回答问题:(填编号)
(1)其中属于阴离子的是
,
(2)属于金属元素的是
,
(3)具有相似化学性质的是 。
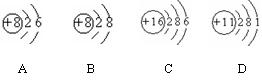
解析:在一个中性原子内,核外电子数等于核内质子数,在化学反应中阴离子得到电子,所以核外电子数大于核内质子数;阳离子失去最外层电子,核外电子数小于核内质子数;最外层电子数相等的原子化学性质相似;金属元素最外层电子数一般小于4
答案:(1)B (2) D (3) A C
知识点2:原子的构成
(一)原子的特点
①原子存在原子核和核外电子
②原子核体积很小
③原子核质量很大
④原子核带正电
(二)原子核 核素
1、原子核的构成:
原子是由原子核和核外电子构成的,绝大多数原子的原子核由质子和中子构成。质子、中子和电子是构成原子的三种微粒。

(1)质量数:原子核中质子数和中子数之和。
(2)组成原子各微粒数的关系:
①质量数(A)=质子数(Z)+中子数(N)
②核电荷数=质子数=核外电子数(中性原子)
(3)原子组成的表示方法为![]() ,其中X为元素符号,A为质量数,Z为质子数。
,其中X为元素符号,A为质量数,Z为质子数。
(4)构成原子或离子的各粒子之间的数量关系。
①核内质子数=核电荷数=原子的核外电子数=原子序数
②质量数(A)=质子数(Z)+中子数(N)
③阳离子核外电子数=核内质子数-电荷数
④阴离子核外电子数=核内质子数+电荷数
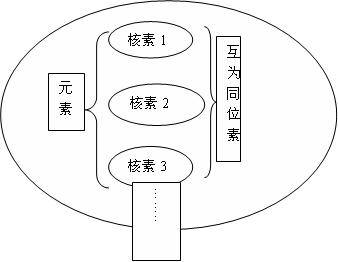
2、核素
概念:
(1)元素:具有相同质子数(核电荷数)的同一类原子的总称。
(2)核素:把具有一定数目质子和一定数目中子的一种原子称为核素。
(3)同位素:质子数相同而中子数不同的同一元素的不同核素互为同位素。
【典型例题】
例1. 我国“嫦娥工程”探月计划的一个重要目标是开发月球新能源![]() ,10t
,10t![]() 就能满足我国一年所有的能源需求。下列关于
就能满足我国一年所有的能源需求。下列关于![]() 说法正确的是(
)
说法正确的是(
)
A、质子数为3,电子数为3
B、质子数为2,电子数为2
C、质子数为2,电子数为3
D、质子数为3,电子数为2
解析:原子组成的表示方法为![]() ,其中X为元素符号,A为质量数,Z为质子数。
,其中X为元素符号,A为质量数,Z为质子数。
答案:B
例2. 填表
|
微粒 |
电子数 |
质子数 |
中子数 |
质量数 |
最外层电子数 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
解析:构成原子或离子的各粒子之间的数量关系。
(1)核内质子数=核电荷数=原子的核外电子数=原子序数
(2)质量数(A)=质子数(Z)+中子数(N)
(3)阳离子核外电子数=核内质子数-电荷数
(4)阴离子核外电子数=核内质子数+电荷数
答案:
|
微粒 |
电子数 |
质子数 |
中子数 |
质量数 |
最外层电子数 |
|
|
17 |
17 |
20 |
37 |
7 |
|
|
8 |
8 |
10 |
18 |
6 |
|
|
13 |
13 |
14 |
27 |
3 |
|
|
18 |
16 |
18 |
34 |
8 |
例3.有五种微粒![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() ,它们属于几种元素(
)
,它们属于几种元素(
)
A、2
B、
解析:元素:具有相同质子数(核电荷数)的同一类原子的总称
答案:B
例4. 某元素B的核电荷数为Z,已知Bn-和Am+的核外具有相同的电子数,则A元素的原子序数用Z、n、m来表示,应为( )
A、Z+n-m
B、Z-n+m
C、Z-n-m D、Z+m+n
解析:阳离子核外电子数=核内质子数-电荷数;阴离子核外电子数=核内质子数+电荷数。所以:Z+ n =
X–m,则X= Z+n+m。
答案:D
例5. 有相对原子质量均大于10的A、B两种元素,A和B的原子核内质子数都等于中子数,它们之间可形成化合物x和y。已知等物质的量的x和y的混合气体的密度是相同条件下H2密度的18.5倍,其中x和y的质量比为3:4.4,经测定x的组成为AB,y的组成为A2B,试通过计算确定A、B的原子量。
解析:设x的相对分子质量为3n,y的相对分子质量则为4.4n,则:
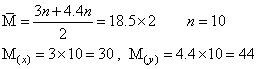
x与y在组成上相差一个A原子,A的相对原子质量则为:44-30=14
B的相对原子质量为30-14=16
则:A、B应分别为N元素和O元素,x、y分别为NO和N2O。
答案:14,16
四、应考锦囊
本单元的知识将在必修2与物质结构中继续涉及,如核外电子的排布规律等知识在《化学2》和《物质结构与性质》才有要求。所以本单元只要求了解原子核的构成、核外电子的分层排布、最外层电子与化学性质的关系等最基础的内容,而对原子结构方面的其他知识则在《化学2》和《物质结构与性质》等高中化学其他模块才进行教学。通过本单元的学习要求了解人类认识原子结构的历程,学习有关原子构成的基础知识,形成原子核外电子是分层排布的等初步概念,了解原子的构成,了解核素、同位素的概念,了解质子数、中子数和质量数之间的关系,了解原子核外电子分层排布、化学反应中原子外层电子排布的变化等,为后续单元、后续专题的学习打下理论基础。
五、本讲小结:
1、原子结构模型的演变
道尔顿原子模型(1803年)“实心球式”原子结构模型→汤姆生原子模型(1904年)“葡萄干面包式”或“西瓜瓤式”原子结构模型→卢瑟福原子模型(1911年)根据粒子散射现象,提出了“行星绕太阳式的”原子核式结构模型→玻尔原子模型(1913年)根据氢原子光谱,引入量子力学观点,在“核式”结构模型的基础上,大胆提出新的原子结构模型:电子运动的分层结构模型→原子的量子力学模型(1927年—1935年)——电子云模型
2、原子核外电子排布
排布规律:
(1)每层最多容纳电子数目为2n2(n表示电子层数)个
(2)最外层电子数目不超过8个(第一层不超过2个)
(3)次外层电子数目不超过18个,倒数第三层电子数目不超过32个。
3、原子核构成:
(1)
(2)质量数:原子核中质子数和中子数之和。
(3)组成原子各微粒数的关系:
①质量数(A)=质子数(Z)+中子数(N)
②核电荷数=质子数=核外电子数(中性原子)
4、核素:![]()
概念:
(1)元素:具有相同质子数(核电荷数)的同一类原子的总称。
(2)核素:把具有一定数目质子和一定数目中子的一种原子称为核素。
(3)同位素:质子数相同而中子数不同的同一元素的不同核素互为同位素。
六、超前思维:(专题二 第一单元 氯、溴、碘及其化合物(一)
)
1、氯气的物理性质:
色: ,态: ,味:
,密度比空气 ,易液化,有毒,
(填能或不能)溶于水, 溶于饱和食盐水。
2、实验室里闻Cl2的方法是
。
3、氯水的性质:
氯气的 称为氯水。氯水因溶有氯气而显 色。溶解在水中的部分氯气能跟水发生反应,生成 和 ,反应方程式为
。
4、次氯酸的性质和氯气的用途
(1)次氯酸 (填稳定或不稳定),容易分解放出 。在 条件下分解速率加快。反应方程式为
(2)次氯酸 (填能或不能)杀菌。自来水常用氯气来消毒(目前已逐步用ClO2代替氯气)。实质就是利用 的 性。
(3)次氯酸能使某些有机色素和染料 。因此,将Cl2通入石蕊试液中,看到的现象是
。氯气是一种重要的
,在生产和生活上应用十分广泛。比如①
②
③
写出Cl2与NaOH反应的方程式
氯气与石灰水反应的方程式
【模拟试题】(答题时间:30分钟)
1、提出近代原子学说的科学家是有“近代化学之父”美称的( )
A.道尔顿 B.拉瓦锡 C.汤姆生 D.卢瑟福
2、就原子结构模型的演变历史给我们的启迪的一些说法,错误的是( )
A.继承、积累、突破和革命是化学认识发展的形式
B.道尔顿的原子学说存在缺陷和错误,因而意义不大
C.实验手段的不断进步是化学发展的一个关键,没有科学实验,就没有科学发现
D.科学研究、科学发现是无止境的
3、不直接构成物质的是( )
A.原子 B.离子 C.分子 D.电子
4、在化学反应中不可能实现的是( )
A.一种原子变成另一种原子
B.一种分子变成另一种分子
C.一种离子变成另一种离子
D.一种单质变成另一种化合物
5、下列微粒中,电子层结构完全相同的是( )
A.S2-、Cl-、K+ B.Cl-、Br-、I-
C.Na+ 、Mg2+ 、F-
D.O2-、Mg2+ 、Cl-
6、核电荷数小于或等于18的元素中,原子的最外层电子数是其余电子总数一半的元素种
类有( )
A.1种 B.2种 C.3种 D.4种
7、下列微粒中,最外层是8个电子,并与Li+ 相差两个电子层的是 ( )
A.F- B.Mg2+ C.S2- D.Na +
8、有A、B两种原子,A原子的M层比B原子的M层少3个电子,B原子的L层电子数恰好为A原子L层电子数的2倍。A和B分别是 ( )
A.硅原子和钠原子 B.硼原子和氦原子
C.氯原子和碳原子 D.碳原子和铝原子
二、填空题:
9、在1—18号元素中,电子总数是最外层电子数两倍的元素是 ;最外层电子数是次外层电子数两倍的元素是 ;次外层电子数是最外层电子数两倍的元素是 ;内层电子总数是最外层电子数两倍的元素是 。
10、A元素原子M电子层有6个电子,B元素与A元素原子具有相同电子层数,B元素的原子最外层上只有1个电子。
(1)画出B元素的原子结构示意图: 。
(2)A、B两元素形成的化合物的名称是 ,该化合物在无色火焰上灼烧时,火焰呈 色。
11、与氖原子核外电子数相同的双原子分子是 ;与氖原子核外电子数相同的三原子分子是 ;与氖原子核外电子数相同的四原子分子是 ;与氖原子核外电子数相同的五原子分子是 ;
12、画出下列各微粒的结构示意图:
(1)与氖原子电子层结构相同的-2价阴离子: 。
(2)最外层电子数为次外层电子数2倍的原子: 。
(3)L层电子数为K层、M层电子数之和的原子: 。
(4)与氩原子电子层结构相同的+1价阳离子 : 。
13、某元素原子的核电荷数是电子层数的5倍,其质子数是最外层电子数的3倍,该元素的原子结构示意图为 。
三、计算题
14、某金属若干克,其原子核外共有2mol电子,核内共有1.204×1024个中子;同质量的该金属跟足量稀盐酸反应,有0.2mol电子发生转移,生成6.02×1022个阳离子,试回答:
(1)该金属元素的原子符号为 ,摩尔质量为 。
(2)原子核的组成中,中子有 个,质子有 个。
![]()
【试题答案】
1.A 2.B 3.D 4.A 5.AC 6.B 7.C
8.D
解析:由B原子的L层电子数为A原子L层电子数的2倍,可知A结构为![]() ,再根据A的M层比B的M层少3个电子得B结构
,再根据A的M层比B的M层少3个电子得B结构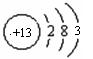 。
。
9.Be C
Li、Si P、Li
10.(1)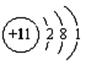
(2)硫化钠 黄
11.HF H2O NH3 CH4
12.(1)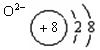 (2)
(2)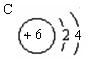 (3)
(3)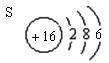 (4)
(4)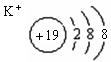
13.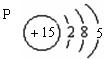
14.解:由题意知生成0.1mol的金属阳离子需转移0.2mol电子,且0.1mol金属共有20mol电子,所以该元素有20个质子,20个中子。
(1)Ca,