![]()
【本讲教育信息】
一、教学内容:
2.3 构成物质的微粒(二)
1、知道原子、离子也是构成物质的一种微粒,了解原子的结构。
2、理解相对原子质量的概念,会查相对原子质量。
3、初步学习通过“模型”来认识物质结构。
4、建立物质是无限可分的观点。
二、重点、难点:
知道原子、原子的结构,理解相对原子质量是重点。
原子结构的空间想象,相对原子质量的理解是难点。
三、教学程序
2.3 构成物质的微粒(二)
(一)分子很小,分子又是由什么构成的呢?分子还能不能分割呢?
分子还可以分成更小的微粒—原子!
【探究实验】 加热氧化汞
氧化汞的分解
现象:管壁上有银白色物质生成,在试管口试验的带火星的木条复燃
原理:氧化汞 ![]() 汞 +
氧气
汞 +
氧气
HgO Hg O2

结论:
在化学变化中,氧化汞分子本身发生了变化,分解成汞原子和氧原子,而汞原子和氧原子不能再分,它们只是重新组合。
(二)原子也是构成物质的一种微粒

1、原子也是构成物质的一种微粒
金属、稀有气体(氦气He等)、金刚石、硅等是由原子构成的
2、原子的质量—相对原子质量
原子的质量很小,使用很不方便,如氢原子:1.674×![]() kg
kg
氧原子:![]()
相对原子质量=![]()
用以上方法,代入具体数据,就可算出各种原子的相对原子质量,如:
H的相对原子质量=![]() (近似值)
(近似值)
O的相对原子质量=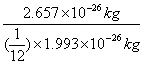 =16
=16
其它常见元素的相对原子质量的计算结果见课本P89表中(近似值)
注意:相对原子质量 = 质子数 + 中子数
3、原子的构成


4、原子内部的特点
原子的核内质子数=核外电子数=核电荷数=原子序数


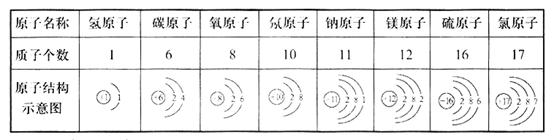
5、原子结构示意图
(三)离子是构成物质的又一种微粒
离子的形成:
化学变化中,中性的原子得到或失去电子成为带电荷的微粒,这种微粒就是离子。
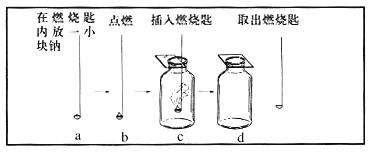
把点燃的钠放入氯气中
钠 + 氯气 ![]() 氯化钠(食盐的主要成分)
氯化钠(食盐的主要成分)
氯化钠的形成过程:
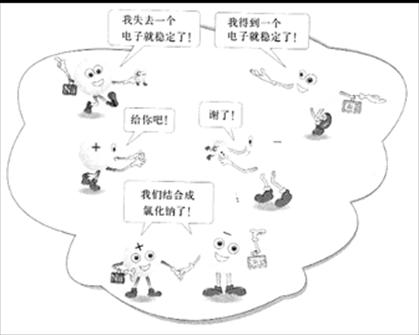
氯化钠生成的示意图
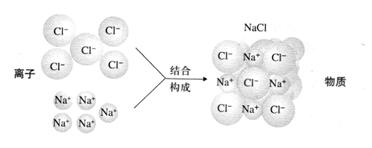
氯化钠由离子构成
本课总结:

具体实例:

铜 水 食盐 二氧化碳
这些物质是怎样由微粒构成的呢?

铜原子会聚在一起形成铜
水分子中氢、氧原子的个数比为2:1
氯化钠中的钠离子、氯离子的个数比为1:1
二氧化碳分子中碳、氧原子的个数比是1:2
【典型例题】
例1、火车道上的钢轨,钢轨与钢轨之间留有一条“缝隙”,这是为什么?
解析:这是一道生活题,灵活运用所学知识,那就是物质的热胀冷缩现象。
答案:钢轨是由铁原子构成的物质。铁原子之间有间隔,这种间隔受热膨胀,遇冷缩小。夏季气温高,铁原子的间隔受热膨胀,铁轨变长,为防止钢轨变长后“凸起”变形而破坏铁路,所以安装铁轨时,铁轨之间一定要留有一定的“缝隙”。
例2、下列是对原子的叙述:①原子是最小的微粒;②原子核都是由质子和中子构成的;③原子不显电性;④原子都在不停地运动着,正确的是( )。
A、① B、③ C、② D、③和④
解析:此题是考查我们对原子和原子结构的知识是否真正理解。①说法中原子并不是最小的微粒,质子、中子、电子比原子还要小得多。由于原子核和核外电子所带电量相等,但电性相反,故整个原子不显电性。因此③正确。原子核内一定含有质子,但不是任何原子都含有中子。如有一种氢原子的核内只有一个质子,而不含中子。原子和分子一样,不是静止不动的。
答案:D
【模拟试题】(答题时间:10分钟)
一、原子及其基本性质
1、下列物质由原子构成的是( )
A、纯净物 B、混合物 C、蒸馏水 D、铁丝
2、关于原子的说法正确的是( )
A、原子不显电性,说明原子内的质子数等于中子数
B、同种原子内的质子数相同
C、含有相同中子数的原子,一定是同一类的原子
D、原子是最小的粒子
二、原子结构
3、下列关于原子核的说法正确的是( )
A、任何原子核都由质子和中子构成
B、原子的核电荷数一定等于核内质子数
C、原子的质量主要集中在原子核上
D、原子核的体积占整个原子的大部分
4、据中央电视台
A、中子数为6 B、质子数为6
C、电子数为6 D、质子数和中子数之和为14
![]()
【试题答案】
1、D 2、B 3、B C 4、A