![]()
【本讲教育信息】
一. 教学内容:
复习第1~4节的有关“酸、碱、盐”的内容
二. 教学目标
1. 复习有关酸、碱、盐的基本知识
2. 初步掌握有关酸、碱、盐的较难题目的解答,如推断题
3. 掌握常见的化学问题的解答,如除杂问题,检验离子问题等
三. 重点和难点
重点:熟记并灵活应用几种沉淀的特征
难点:对酸、碱、盐的基本知识的引申和灵活应用
四. 知识总结
1. 常见的酸的物理性质和化学性质总结
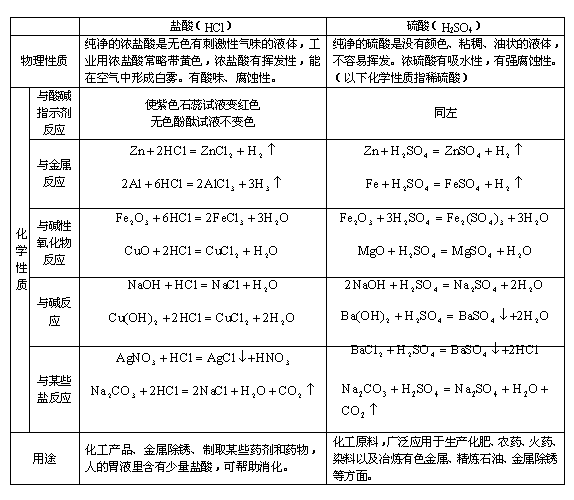 2. 常见的碱的物理性质和化学性质总结
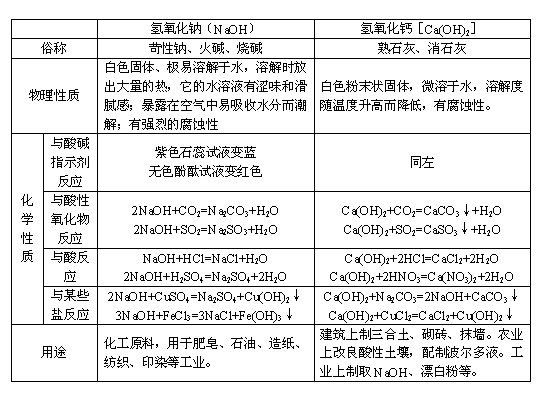
2. 常见的碱的物理性质和化学性质总结
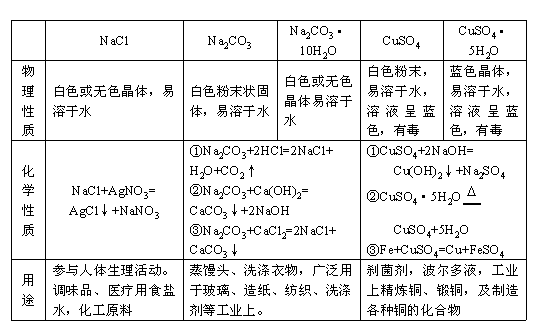
3. 常见的盐的物理性质和化学性质总结
4. 熟记7种常见的沉淀(并在推断题等各种题型中灵活地运用)
不溶于稀硝酸的沉淀:AgCl (白色)、BaSO4(白色)
溶于稀硝酸的沉淀:BaCO3(白色)、CaCO3(白色)、Mg(OH)2(白色)、Cu(OH)2(蓝色)、Fe(OH)3(红褐色)
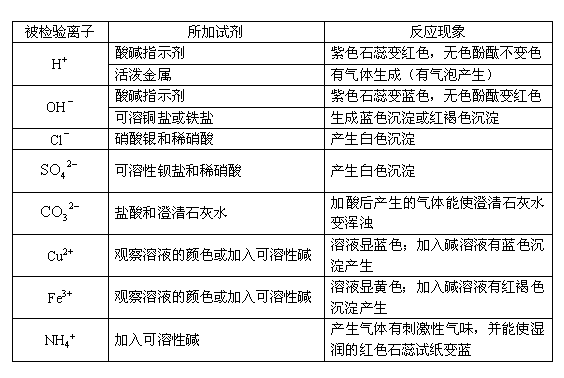
5. 几种常见离子的检验
【典型例题】
例1. 将下列物质长期放置在敞口容器中,质量增加,同时又生成其它物质的是( )
A. 碳酸钠晶体 B. 浓硫酸
C. 熟石灰 D.
食盐
答案:C
例2. 现有几种物质:(1)无水硫酸铜;(2)胆矾;(3)碳酸钠;(4)烧碱;(5)食盐;(6)NaNO2;(7)CO;(8)CH3OH;(9)熟石灰;(10)AgNO3;(11)浓硫酸,试选择适合物质的编号填写下列空白(编号可以重复使用)
①具有毒性的盐是____________,有毒性但不属于盐的物质是_______________;
②在人们日常生活中,用于调味,在工业上可用于制造烧碱、纯碱的物质是_________;
③改良酸性土壤用___________
④〈4〉农药“波尔多液”是用_______和________配制的;
⑤要证明某工业酒精中含有水,可向工业酒精中加入__________然后观察颜色的变化;
⑥若试管壁附有油脂,常用热的_______________溶液进行洗涤;
⑦要除去CO2气体中含有的水蒸气,可将气体通过_______________;
⑧容易潮解的物质是_______________;
⑨要确认并除去某气体(H2、O2、CO2等)中所含有的少量氯化氢气体,可将气体通过______溶液。
答案:①(6)、(8);②(5);③(9);④(3)、(9);⑤(1);⑥(3);⑦(11);⑧(4);⑨(10)
例3. 有一包粉末可能含有碳酸钙、碳酸钠、硫酸钠、硫酸铜、硝酸钠中的一种或几种,某学生为了确定其组成,做如下实验,请根据实验现象进行推断,把相应的物质的化学式填在表中的空格内。
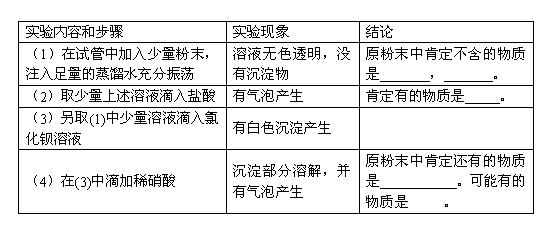
答案:硫酸铜、碳酸钙、碳酸钠、硫酸钠、硝酸钠
例4. 我市具有丰富的海洋资源,某校一研究性学习小组以“海洋资源与利用”为课题进行调查研究。请回答下列问题。
(1)该学习小组得出下列调查结论,你认为其中可能实现的有_______(填序号)。
(A)海水淡化 (B)海水养殖 (C)海洋捕捞 (D)海洋运输
(2)海水晒盐最初得到的是粗盐,含有许多杂质,经①溶解②沉淀③_____(填操作名称)④蒸发可制得精盐。
(3)该学习小组建议地方政府建一化工厂,利用海水中含有氯化镁、海边盛产贝壳(主要成分是CaCO3),制取无水氯化镁,生产的大致流程为:
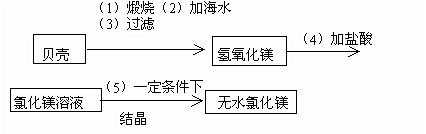
该生产过程中,没有涉及到的化学反应类型是_________(填序号)。
(A)化合反应 (B)分解反应 (C)置换反应 (D)复分解反应
解析:本题命题视角新颖,有两大特点:一是以研究性学习为背景,将研究性学习与当地的环境保护、资源的综合利用、社会发展有机地结合在一起;二是充分体现了地方特点,体现了化学的应用价值。
答案:(1)(A)、(B)、(C)、(D);(2)过滤;(3)(C)
分析:写出所发生反应的化学方程式,即可得出结论。
![]()
![]()
![]()
![]()
【模拟试题】(答题时间:80分钟)
一. 选择题,下列各题只有一个答案,请将正确选项填在后面括号里。
1. 下列叙述不正确的是( )
A. 组成中含有氢元素的化合物不一定是酸
B. 氧化物中一定含氧元素
C. 酸、碱、盐的溶液能导电,但不显电性,
是因为其中的阴离子个数与阳离子个数相等
D. 食盐是盐中的一种,所以不能说盐就是食盐
2. 以下物质能电离出氢离子但不属于酸类的是( )
A. H2S B. KHSO4 C. NH4Cl D. HNO3
3. 要除去NaCl溶液中所含少量Na2CO3,得到纯净的食盐水,可向溶液中加入适量的( )
A. Ba(OH)2 B.
CuSO4 C.
CaCl2 D.
盐酸
4. 酸、碱、盐三类物质,它们的共同点是( )
①都能溶于水
②它们的水溶液都能导电
③都含有金属离子
④都是化合物
A.①② B.②④ C.②③ D.②
5. Fe、稀H2SO4、CuCl2溶液、NaOH溶液、Fe2O3五种物质,两两相混合时,可能发生的反应共有( )
A.4个 B. 5个 C. 6个 D.7个
6. 某物质5克,放在95克水中充分搅拌,所得溶液的质量分数( )
A. 等于5% B. 大于5% C. 小于5% D. 以上都有可能
7. 稀硫酸和下列物质既能发生中和反应,又能产生白色沉淀的是( )
A. Mg(OH)2 B.
BaCl2
C. K2CO3 D. Ba(OH)2
8. 既不溶于水,又不溶于盐酸,但能与硝酸银溶液反应的是( )
A. BaCl2 B. MgO
C. Cu D. Zn
9. 下列各组金属中,金属活动顺序排列正确的是( )
①将甲投入稀H2SO4中,有气泡冒出
②将乙投入含甲的盐溶液中有甲析出
③将丙投入稀硫酸中,无现象
A. 甲>乙>丙 B. 乙>甲>丙
C. 甲>丙>乙 D.
乙>丙>甲
10. 定量测定溶液酸碱度反应选用( )
A. 无色酚酞 B. 紫色石蕊
C. pH试纸 D.
石蕊试纸
11. 要能证明碳酸盐中含有CO32-离子,需要的2种试剂常是( )
A. 盐酸、澄清的石灰水
B. 硫酸溶液、澄清的石灰水
C. 稀盐酸、饱和的食盐水
D. 硝酸溶液、透明的蒸馏水
12. 向下列溶液中分别插入一锌片,过一段时间取出烘干, 锌片质量增加的是( )
A. HCl B.CuCl2
C.Na2SO4 D.AgNO3
13. 用pH试纸测定溶液pH值的正确操作是( )
A. 用玻璃棒蘸取待测液滴在用蒸馏水润湿的pH试纸上,观察颜色变化
B. 将pH试纸浸在待测液中,片刻后取出观察颜色变化
C. 用玻璃棒蘸取待测液滴在pH试纸上,把试纸与比色卡对比
D. 用胶头滴管吸取待测液滴到pH试纸上,3分钟后将试纸与比色卡对比
14. 下列各组物质不能发生复分解反应的是( )
A.碳酸钙和盐酸
B.硝酸钾溶液和氯化纳溶液
C.氯化钡溶液和稀硫酸 D.硝酸银溶液和盐酸
15. 下列物质的转变,不能由一步反应实现的是( )
A.CuO─→Cu(OH)2
B. Ca(OH)2─→NaOH
C. SO2─→CaSO3
D.MgCl2─→Mg(NO3)2
16. 试用一种试剂将Ba(NO3)2、AgNO3、K2CO3三种溶液分开,该试剂可选用( )
A. 盐酸 B. 硝酸 C. 氢氧化钠 D. 硝酸钠
17. 下列各组物质中,加入适量的盐酸后过滤,不能将混有的杂质除净的是( )
A. Na2SO4中混有少量CaCO3
B. 铜粉中混有少量铁粉
C. NaCl中混有少量Na2CO3
D. 炭粉中混有少量镁粉
18. 某只含1种溶质的无色溶液与氯化钡溶液混合后,有不溶于稀硝酸的白色沉淀生成,则该溶质不可能是( )
A. H2SO4 B. AgNO3 C. MgSO4 D. K2CO3
19. 下列各组离子能大量共存的是( )
A. H+、K+、NO3-、OH-
B. Ba2+、Ca2+、Cl-、OH-
C. Na+、NH4+、SO42-、OH-
D. K+、H+、NO3-、CO32-
20. 向含CuCl、ZnCl、HCl的混合溶液中撒入过量铁粉,反应后溶液中的溶质是( )
A. ZnCl2、FeCl2
B. FeCl3、ZnCl2
C. CuCl2、ZnCl2
D. FeCl2、HCl
二. 简答题
1.有下列七种物质①—⑦,选择正确的答案填在题后的括号里(填序号即可;能写化学反应方程式的,也请一并写出)
七种物质:
①氧气 ②一氧化碳 ③氢气 ④甲烷 ⑤木炭 ⑥氯化氢气体 ⑦二氧化碳
(1)使澄清石灰水变浑浊的气体是
(2)能在空气中燃烧的是
①
②
③
④
(3)能使石蕊试液变红的气体是( )
(4)能够用排水法收集的气体是( )
2. 完成下列化学方程式并填空
(1)铝跟氯化铜溶液________________属_____________反应
(2)硫酸铜和苛性钠溶液________________现象为_______________
(3)氯化铁和氢氧化钡溶液________________现象为_______________
(4)氢氧化镁与硝酸________________属______________反应
(5)氯化钡和硝酸银溶液________________________。
3. 在检验纯碱中含有碳酸根离子的实验过程中,发生2个化学反应,这2个反应的化学方程式是____________________、_____________________。
4. 工业上以水、石灰石和碳酸钠这3种原料,可在一定条件下,通过3个反应制取少量的氢氧化钠。这3个反应的化学方程式是(按制取顺序书写)(1)________________;(2)________________;(3)________________。这3个反应依次属于________反应、________反应、________反应(按反应的基本类型回答)。
5. 今有AgNO3溶液、BaCl2溶液、Ba(NO3)2溶液、Ba(OH)2溶液、Na2CO3溶液和Zn粉供选用。若欲除去稀硝酸中混有的少量硫酸,以得到纯净的稀硝酸,应加入适量 ,发生反应的化学方程式为 。若欲除去氯化钠溶液中混有的少量盐酸,以得到纯净的氯化钠溶液,应加入适量 ,发生反应的化学方程式为 ,该反应的类型是 。
6. 有一包白色粉末,可能由氯化银、碳酸钠、氢氧化镁、氯化钡、硫酸钠和硝酸钾中的某几种组成。为了鉴定其成分,实验如下:
(1)将少量粉末放入足量水中,搅拌、静置、过滤,得白色沉淀和无色滤液。
(2)向所得沉淀中加入足量稀硝酸,沉淀全部溶解,但无气体产生。
(3)向滤液中滴加硝酸银溶液,有白色沉淀生成,加入足量稀硝酸,沉淀不溶解。试根据以上现象推断该白色粉末中一定含有
;一定没有
;可能含有
。
7. 某化工场排放的污水中,常溶有某些对人体有害的物质。通过目测,初步认为可能含有Fe3+、Ba2+、Na+、OH-、Cl-、CO32-、SO42-;为了进一步确认,进行实验检测:
(1)取污水仔细观察,呈无色、透明、均一状态。
(2)向取样的污水中,滴入稀硫酸,有大量白色沉淀产生,再加稀硝酸,白色沉淀不消失。
(3)用pH试纸测定污水的pH值,试纸显深蓝色。由此可知,该污水中,肯定含有的离子是 。肯定没有的离子是
,可能含有的离子是
。
(4)某学校化学课外活动小组,将一些可溶性化合物溶于水,配制成的甲、乙两溶液中,共含有H+、Ag+、K+、Ba2+、OH-、Cl-、NO3-、CO32-8种离子,两种溶液里所含离子各不相同,已知向甲溶液里滴入石蕊试液,石蕊试液变成蓝色,则乙溶液里含有的4种离子应该是
。
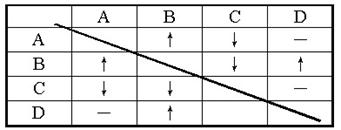
8. 现有稀盐酸、稀硫酸、氢氧化钡、碳酸钠4瓶失去标签的溶液,分别编号为A、B、C、D。每次取少量溶液两两混合,所观察到的现象记录在下表中(“—”表示无明显现象;“↓”表示有沉淀生成;“↑”表示有气体生成)。由此推断4瓶溶液中的溶质的分别为:
A. ;B. ;C. ;D.
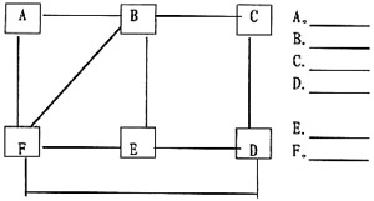
9. 下图中的A、B、C、D、E、F分别表示石灰水、硫酸铜溶液、碳酸钠溶液、氯化钡溶液、盐酸和金属铁,它们之间的连线表明相邻的两种物质之间能发生反应。试根据图中关系确定A、B、C、D、E、F各物质的化学式。
![]()
【试题答案】
一. 选择题
1.C 2.B 3.D 4.B 5.B 6.D 7.D 8.C 9.B 10.C
11.A 12.D 13.C 14.B 15.A 16.A 17.A 18.D 19.B 20.A
二. 简答题
1. (1)⑦
(2)②③④⑤
![]()
![]()
![]()
![]()
(3)⑥⑦
(4)①②③④
2. (1)2Al+3CuCl2=2AlCl3+3Cu;置换
(2)CuSO4+2NaOH=Cu(OH)2↓+Na2SO4;蓝色↓生成
(3)2FeCl3+3Ba(OH)2=2Fe(OH)3↓+3BaCl2;红褐色↓生成
(4)Mg(OH)2+2HNO3=Mg(NO3)2+2H2O;复分解
(5)BaCl2+2AgNO3=Ba(NO3)2+2AgCl↓
3. Na2CO3+2HCl=2NaCl+H2O+CO2↑;CO2+Ca(OH)2=CaCO3↓+H2O
4. (1)CaCO3![]() CaO+CO2↑;
CaO+CO2↑;
(2)CaO+H2O=Ca(OH)2;
(3)Ca(OH)2+Na2CO3![]()
分解;化合;复分解
5. Ba(NO3)2溶液,
![]()
Na2CO3溶液,
![]()
复分解反应。
6. 一定含有 氢氧化镁 氯化钡;一定没有氯化银 碳酸钠 硫酸钠 ;可能含有硝酸钾。
7. 一定有Ba2+、OH- 肯定没有Fe3+、CO32-、SO42- 可能有Na+、Cl-
乙溶液含H+、Ag+、Ba2+、NO3-
8. A、B、C、D分别为稀硫酸、碳酸钠、氢氧化钡、稀盐酸
9. A、B、C、D、E、F分别为:氯化钡,硫酸铜,金属铁,盐酸,石灰水,碳酸钠