![]()
【本讲教育信息】
一、教学内容:
单元复习《常见的酸和碱》
二、学习目标
1、了解酸和碱的性质,理解物质的酸碱性及中和反应的实质;初步学会测定溶液酸碱性的方法。
2、认识定量研究对于化学科学发展的重要作用。
3、增进对科学探究的理解,提高科学探究能力和分析问题、解决问题的能力。
4、了解酸和碱对生命活动的重要意义,进一步激发学习化学的兴趣。
5、初步认识中和滴定法测定酸、碱溶液浓度的原理和方法。
三、全面突破
知识专题(一):物质的分类

知识专题(二):常见酸(盐酸、硫酸)和碱(氢氧化钠、氢氧化钙)的比较
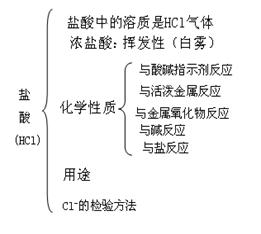


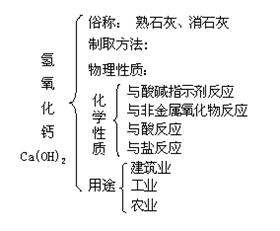
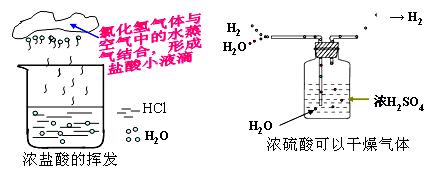
知识专题(三):酸和碱的化学性质比较
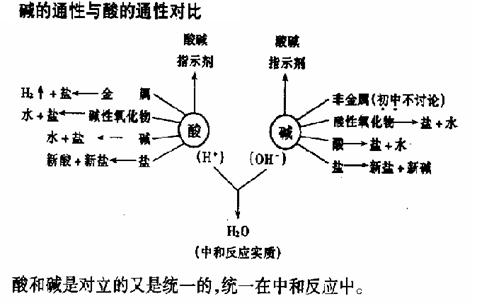
知识专题(四):复分解反应

【典型例题】
例1:完成下列物质分类表,并将下列物质的序号填入适当的位置。
⑴盐酸 ⑵石灰石 ⑶金刚石 ⑷冰水混合物 ⑸生石灰 ⑹磷酸 ⑺FeCl2 ⑻纯碱 ⑼Cu(OH)2 ⑽氢氟酸 ⑾氢氧化钾 ⑿Na2S ⒀NH4NO3 ⒁消石灰 ⒂氨水 ⒃铁粉 ⒄石油
解析:该题考查物质的分类、组成、命名及物质的俗名等,是中考的必考内容。关键是明确各类物质的概念、组成元素、命名方法以及分类的依据等。
例2:只用紫色石蕊试液就可将三种溶液区分开的有( )
A. NaCl、HCl、NaOH B.
NaOH、MgSO4、KNO3
C. Mg(NO3)2 、NaCl、HNO3 D.
BaCl2、Ba(OH)2、KNO3
分析:很多考生根据指示剂变色情况迅速作出判断,认为正确答案为A,而对隐含的答案B就不再深入思考了,造成漏选。造成这种错误的原因是学生对鉴别物质的方法考虑不全面,正确思路是:B项,利用紫色石蕊试液首先可鉴别出NaOH溶液,再由能与NaOH溶液反应产生白色沉淀的溶液是MgSO4,进而剩下的就是KNO3溶液了。故本题应选A、B两个答案。
答案:A、B
例3:前段时间,我国猪肉价格上涨幅度较大,有关猪肉的一些问题也引起人们的格外关注。有资料显示,肉类新鲜程度的变化会引起pH发生相应变化,变化关系如下表:
|
名称 |
新鲜肉 |
次鲜肉 |
变质肉 |
|
|
5.8~6.2 |
6.3~6.6 |
>6.7 |
则下列分析正确的是 ( )
A. 肉越新鲜,酸性越弱 B.
肉越新鲜,碱性越强
C. 肉变质过程中,酸性减弱 D.
肉变质过程中,碱性减弱
解析:以表格、图像等方式给出物质的pH,然后比较不同物质的酸碱性强弱,是最常见的考查形式。此类问题难度不大,只要理解pH的含义,便能正确解答。结合所学知识可知,pH的范围通常在0~14之间。pH<7,溶液呈酸性,且pH越小,酸性越强;pH=7,溶液呈中性;pH>7,溶液呈碱性,且pH越大,碱性越强。由上表中的信息知,由新鲜肉→次鲜肉→变质肉,pH逐渐增大,也就是说,肉在变质过程中酸性逐渐减弱。
答案:C
例4:现有下列气体①O2 ②H2 ③CO
④CO2 ⑤NH3 ⑥HCl ⑦SO2,其中既可用浓硫酸干燥,又能用烧碱干燥的是( )
A.①②③ B.①②③④
C.①②③④⑤ D.①②③④⑥

解析:浓H2SO4具有吸水性,能干燥气体,但要求被干燥的气体不能与浓硫酸反应。上述气体中NH3溶于水溶液显碱性,能与浓硫酸反应,所以NH3不能用浓硫酸干燥。
NaOH固体也能吸收水分,能用于干燥气体。但同样要求不能跟被干燥的气体反应。上述气体中CO2、HCl、SO2溶于水显酸性,能与NaOH反应,所以CO2、HCl、SO2气体不能用NaOH干燥。
既不跟浓硫酸反应,也不跟NaOH反应的气体为O2、H2、CO,所以这三种气体既能用浓H2SO4干燥,又能用NaOH干燥。
答案:A
例5:在家庭中进行的下列实验或做法可行的是( )
A. 用食醋区分食盐和纯碱
B. 将食盐经溶解、过滤、蒸发来制取纯净的氯化钠
C. 用加有铁强化剂的酱油与食醋反应制氢气
D. 用汽油洗掉白衬衫上的铁锈
分析:此题的关键词是“在家庭中进行”,实际上在给予的四个选项中的实验或做法有些是可行的,但是要注意解答此题的前提。食盐的提纯需要在实验室中进行,在家庭中并没有一些必要的仪器来对食盐进行提纯;酱油中虽然有铁强化剂,但是铁是以化合物的形式存在的,因此并不能用酱油与食醋反应来获得氢气;白衬衫上的铁锈,用汽油是不能洗掉的,因为铁锈并不能被汽油溶解。
答案:A
例6:下列对实验过程的评价正确的是( )
A. 某固体中加入稀盐酸产生无色气体,证明该固体中一定含有![]()
B. 某溶液中滴加![]() 溶液,生成不溶于稀硝酸的白色沉淀,该溶液中一定含有
溶液,生成不溶于稀硝酸的白色沉淀,该溶液中一定含有![]()
C. 某无色溶液中滴加无色酚酞试液,溶液变成红色,该溶液中一定显碱性
D. 某溶液中加入![]() 溶液有白色沉淀生成,该溶液中一定含有
溶液有白色沉淀生成,该溶液中一定含有![]()
解析:A选项中的固体不一定是碳酸盐,还可能是活泼金属,故A不正确。B选项中引入了![]() ,生成的白色不溶于稀硝酸的沉淀不一定是
,生成的白色不溶于稀硝酸的沉淀不一定是![]() ,还可能是
,还可能是![]() ,故B不正确。D选项若溶液中含有
,故B不正确。D选项若溶液中含有![]() ,会生成白色的
,会生成白色的![]() 沉淀,故D不正确。
沉淀,故D不正确。
答案:C
例7:下列离子能在pH=13的水溶液中大量共存的是( )
A. ![]() B.
B. ![]()
C. ![]() D.
D. ![]()
解析:由于溶液pH=13,可知溶液为强碱性,A中的![]() 、B中的
、B中的![]() 在强碱性环境中不能大量共存。D中
在强碱性环境中不能大量共存。D中![]() 反应生成沉淀不能大量共存,故应选C。
反应生成沉淀不能大量共存,故应选C。
答案:C
例8:除去下列物质中所含杂质(括号内为杂质),所选用试剂及操作方法均正确的一组是( )
|
选项 |
待提纯的物质 |
选用的试剂 |
操作方法 |
|
A |
|
水 |
溶解、过滤、结晶 |
|
B |
|
氧气 |
点燃 |
|
C |
|
稀盐酸 |
溶解、过滤、洗涤、干燥 |
|
D |
|
氢氧化钠溶液 |
过滤 |
解析:解答此题时要注意,选择试剂与相应的操作方法都要正确,保证杂质得以分离出去或转化后分离出去。A中![]() 难溶于水而
难溶于水而![]() 易溶,加水后利用溶解性差别即可分离,但操作中不需结晶,过滤
易溶,加水后利用溶解性差别即可分离,但操作中不需结晶,过滤![]() 即可获得;B中用氧气转化CO杂质是不可以的,即在
即可获得;B中用氧气转化CO杂质是不可以的,即在![]() 中不可能通过点燃
中不可能通过点燃![]() 实现
实现![]() 的转化;D中所选试剂氢氧化钠能与两种物质反应,无法提纯
的转化;D中所选试剂氢氧化钠能与两种物质反应,无法提纯![]() ;只有C中所选试剂和操作能除去Cu中的CuO,以获得干燥的Cu。故应选C。
;只有C中所选试剂和操作能除去Cu中的CuO,以获得干燥的Cu。故应选C。
答案:C
例9:同学们在学习碱的化学性质时,进行了如图所示的实验。
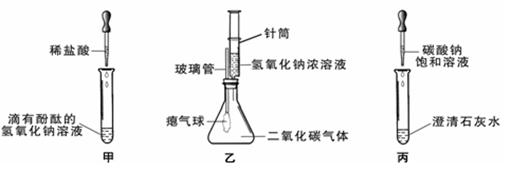
(1)写出甲实验中盐酸和氢氧化钠反应的化学方程式 。
(2)乙实验中滴加氢氧化钠溶液后,可观察到的现象是
。
(3)丙实验中观察到试管内有白色沉淀产生。
(4)实验结束后,同学们将甲、乙、丙三个实验的废液倒入同一个干净的废液缸中,最终看到废液浑浊并呈红色,产生疑问。
【提出问题】废液中含有哪些物质?
【交流讨论】
①一定含有的物质:碳酸钙、指示剂、水和
(写物质名称) 。
②还含有能使废液呈碱性的物质。能使废液呈碱性的物质是什么?
同学们有如下猜想:
小云认为:只有碳酸钠
小红认为:只有氢氧化钙
小林认为:是氢氧化钠和碳酸钠
你认为还可能是
。(写一种猜想)
【实验设计】小方想用氯化钙溶液来验证小云、小红、小林的猜想。查阅资料获悉氯化钙溶液呈中性,并设计如下实验。请你将小方的实验设计补充完整。
|
实验内容 |
预计现象 |
预计结论 |
|
取少量废液缸中上层清液于试管中,加入过量氯化钙溶液,静置。 |
①有白色沉淀,溶液呈红色。 |
的猜想正确。 |
|
②
。 |
的猜想正确。 |
|
|
③
。 |
的猜想正确。 |
【反思拓展】 在分析化学反应后所得物质的成分时,除了考虑生成物外还需考虑
。
解析:乙实验中滴加氢氧化钠溶液后,氢氧化钠吸收二氧化碳并与之反应,使锥形瓶内压强减小,所以外界空气沿导气管进入气球,使气球逐渐涨大。
由于甲实验中氢氧化钠与盐酸反应,生成了氯化钠,所以废液中一定含有氯化钠。
将甲、乙、丙三个实验的废液倒入同一个干净的废液缸中,最终看到废液浑浊并呈红色,说明废液中一定有不溶于水的物质生成,且溶液呈碱性,含有碱溶液或呈碱性的盐溶液。分析题意可知,该废液中呈碱性的物质除了上面三位同学的猜想外,还可能是“只有氢氧化钠”或“氢氧化钠和氢氧化钙”。
小方取少量废液缸中上层清液于试管中,加入过量氯化钙溶液,有白色沉淀且溶液呈红色。说明一定生成了钙盐的沉淀,即碳酸钙,说明废液中有碳酸钠;溶液呈红色,而氯化钙溶液呈中性,说明一定有氢氧根离子存在,即有氢氧化钠。故小林的猜想正确。
若有白色沉淀且溶液由红色变为无色,则说明废液中只有碳酸钠,小云的猜想正确。若没有白色沉淀,溶液呈红色,则溶液中没有碳酸根离子,只有氢氧根离子,说明废液中有氢氧化钙,或氢氧化钠,或既有氢氧化钠也有氢氧化钙。
答案:(1)NaOH+HCl=NaCl+H2O (2)气球胀大
(4)【交流讨论】① NaCl ②氢氧化钠(合理答案均可)
【实验设计】 ①小林 ②有白色沉淀,溶液由红色变为无色 小云 ③ 没有白色沉淀,溶液呈红色 小红
【反思拓展】 反应物是否有剩余 (合理答案均可)
例10:复分解反应是我们学过的化学基本反应类型之一。学习时,应注意将知识进行归纳、总结,深刻理解复分解反应发生的条件,形成完整的知识体系。
(1)写出下列反应的化学方程式:
①氯化钡溶液与硫酸钠溶液混合:_____________。
②碳酸钾溶液与稀盐酸混合:_____________。
③氢氧化钡溶液与稀硝酸混合:_____________。
(2)你想过上述复分解反应为什么能够发生吗?是因为在这些反应物中含有一些“特殊”的阴、阳离子,它们能相互结合。如上述反应①中,实际参加反应的离子是![]() 和
和![]() ,而
,而![]() 、
、![]() 则是“旁观者”,并没有参加反应。请你分析上述反应②中实际参加反应的离子是_____________;上述反应③中实际参加反应的离子是_____________。
则是“旁观者”,并没有参加反应。请你分析上述反应②中实际参加反应的离子是_____________;上述反应③中实际参加反应的离子是_____________。
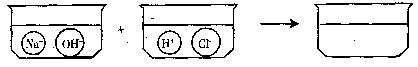
(3)请根据你的想象,在下图右边的容器中画出体现NaOH溶液和稀盐酸反应产物的示意图。
分析:复分解反应是指两种化合物相互交换成分,生成两种新的化合物的反应。生成物中要有水、气体、沉淀三者之一才可发生复分解反应。此外盐与盐、盐与碱反应,反应物必须可溶,复分解反应才能发生。书写化学方程式时,要准确使用化学用语。
答案:(1)①![]()
②![]()
③![]()
(2)![]()
(3)
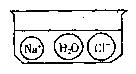
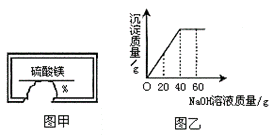
例11:某同学在实验室发现一瓶标签残缺(如图甲所示)的溶液。为了测定此溶液的溶质质量分数,他取出
解析:计算溶液中某种溶质的质量分数,一般思路是利用以下公式来求解“溶质的质量分数=![]() ”
”
因此,解决此类题目的要点是抓住两个要素:①溶液的质量;②溶液中溶质的质量。一切思考和分析都要以这两个要素为中心。由图甲可知,标签残缺的溶液为硫酸镁溶液。图乙所示的内容是:向
答案:解:设
MgSO4+2NaOH = Mg(OH)2↓+Na2SO4
120 80
x
120:80=x:(
![]()
答:此溶液的溶质质量分数为24%。
四、考场清单
本单元知识系统性比较强,涉及的化合物种类和化学反应比较多,既是学习的重点,又是学习的难点,是对元素化合物知识的整合、总结,在中考中所占比重较大。基本题型有:选择题、填空题、实验探究题及计算题等,通常结合生产生活实际考查学生学以致用的情况。
主要考点有:
1、酸碱指示剂、酸碱试纸、pH试纸
2、溶液的酸碱性、酸碱度及对生命活动的重要意义
3、酸、碱、盐的定义、组成、分类、命名及判断
4、几种常见的酸(盐酸、硫酸)的物理性质、特性、使用方法及用途
5、几种常见的碱(氢氧化钠、氢氧化钙)的俗名、物理性质、特性、使用方法及用途。
6、中和反应实质及应用
7、酸、碱的化学性质,有关化学方程式的书写、现象及有关的实验探究
8、复分解反应及其判断
五、本讲小结
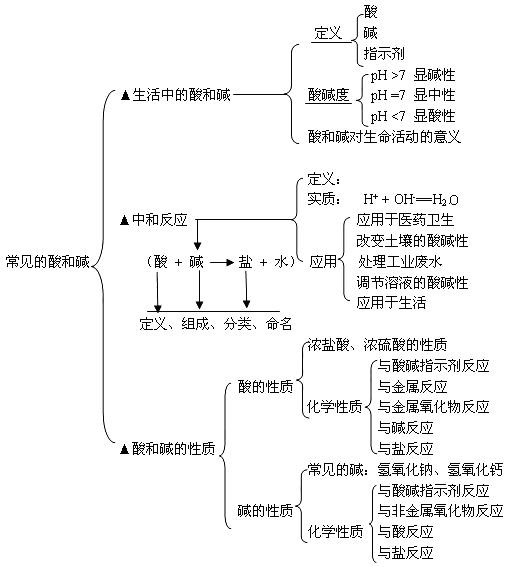
知识结构:
学法指导:
本单元知识系统性比较强,涉及的化合物种类和化学反应比较多。学好本单元知识是学好初中化学的关键,也为继续学好化学知识铺平道路。
学习时要注意以下几点:
1、注重实验探究,勤动手实验。从直观实验中进行深入分析,做到既明了实验现象,又知其中的“所以然”。
2、领悟概念本质,以利于知识迁移。本单元内的多个概念都是从已知事实,经过实验、逻辑推理、分析得出,善于抓住其本质,是提高运用化学知识解决实际问题的关键。
3、适时进行知识的系统化。对所学知识进行及时梳理,自主建构,形成网络体系,以应对各种开放性、探究性问题。
【模拟试题】(答题时间:60分钟)
一、选择题
1、在生活、生产和科学研究中,常用pH试纸测定溶液的pH。以下测定操作正确的是( )
A.将被测液滴到放在玻璃片上的pH试纸上,显色后,与标准比色卡比较
B.将pH试纸直接投入被测液中,显色后取出,与标准比色卡比较
C.先用少量水湿润试纸,后滴上被测液,显色后,与标准比色卡比较
D.先用蒸馏水清洗滴管,随后吸取被测液滴到试纸上,显色后,与标准比色卡比较
2、下列各组物质的反应中,需要借助酸碱指示剂才能判断出反应发生的是 ( )
A.铁屑和稀盐酸 B.氢氧化镁和稀盐酸
C.石灰浆和稀盐酸 D.烧碱溶液和稀硫酸
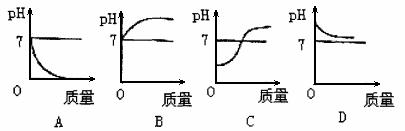
3、向某盐酸溶液中逐滴加入氢氧化钠溶液,所得溶液的pH与加入氢氧化钠溶液的质量关系曲线图合理的是( )
4、下图所示装置在化学实验中常用于洗气、储气、收集气体等,若让其用于下面所列实验,其中可行的是( )
①收集![]() ;②收集
;②收集![]() ;③干燥
;③干燥![]() (瓶内装浓硫酸);④测量生成CO的体积(瓶内装水,并配备量筒等)
(瓶内装浓硫酸);④测量生成CO的体积(瓶内装水,并配备量筒等)
A.①②③④ B.②③④ C.①②③ D.②③
5、下列物质暴露在空气中,溶质的质量不变而溶质质量分数减小的是 ( )
A.浓盐酸 B.浓硫酸 C.浓硝酸 D.食盐水
6、对物质进行分类,是研究物质的基本方法。在下面的四种化合物中,与另外三种不属于同一类别的物质是( )
A.CuSO4 B.FeSO
7、下列两种物质的溶液混合后,能发生反应,且溶液的总质量不会发生改变的是( )
A.氢氧化钠溶液和稀盐酸 B.碳酸钠溶液和稀盐酸
C.氯化钠溶液和稀硫酸 D.碳酸钠溶液和氯化钙溶液
8、有四种物质的溶液:①Ba(OH)2、②Na2SO4、③HNO3、④FeCl3,不用其他试剂就可将它们逐一鉴别出来,其鉴别顺序是( )
A.④③②① B.④①②③ C.①③④② D.①④②③
9、下列各组括号内除杂质的方法或试剂错误的是
( )
A.Cu粉中混有铁粉(用磁铁吸引) B.NaNO3溶液中混有NaCl(AgNO3溶液)
C.C粉中混有CuO(稀硫酸)
D.CaO中混有CaCO3(稀盐酸)
10、为提高染发剂染色效果,一般先用碱剂等对头发预处理。某碱剂在染发时可闻到刺激性气味,该气体能使湿润的红色石蕊试纸变蓝。则该气体为 ( )
A.CO2
B.O
11、下列物质俗名、化学名称、化学式表示同一种物质的是
( )
A. 干冰 二氧化碳 CO2 B. 生石灰 熟石灰
Ca(OH)2
C. 纯碱 氢氧化钠 NaOH D. 盐酸
氯化氢 HCl
**12、有一混合溶液是由盐酸、碳酸钠、硝酸钾、硫酸和氯化铜中的两种溶液混合而成。向该混合溶液中滴加氢氧化钡溶液,溶液体积的变化与生成沉淀质量的关系如下图所示,那么,这两种溶液是( )
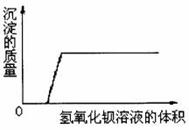
A. 盐酸、硫酸 B. 碳酸钠、硝酸钾
C. 硝酸钾、盐酸 D. 盐酸、氯化铜
*13、学校研究性学习小组选择探究“CuSO4溶液显蓝色与什么离子有关”作为研究课题,以下是他们提交的实验方案,其中不需要做的实验是( )
A.观察Na2SO4、K2SO4溶液的颜色
B.观察CuCl2、Cu(NO3)2溶液的颜色
C.向CuSO4溶液中滴加适量的NaOH溶液,静置后观察溶液的颜色
D.加水稀释后观察CuSO4溶液的颜色
二、填空题
14、按要求从①烧碱、②盐酸、③浓硫酸、④熟石灰、⑤氢氧化铝等物质中选择适当的物质,填在相应的空格里:(填序号)
(1)少量存在于人的胃液中,能帮助消化的是____________________。
(2)在医疗上,可用来制造中和胃酸过多的药物的是__________。
(3)可用做某些气体的干燥剂的是__________。
(4)可用做建筑材料的是__________。
15、在酸、碱、氧化物这三类物质中,一定含有氢、氧两种元素的是__________,一定只含有两种元素的是__________,酸、碱中含有的相同元素是__________。
16、实验室久置的氢氧化钠溶液中滴入盐酸后发现有气泡产生,出现这一现象的原因是(用化学方程式表示)____________________、____________________。要使pH=5的溶液的pH升高,可在此溶液中加入__________,要使pH=9的溶液的pH降低,可在此溶液中加入__________。(填物质的化学式)
17、酒厂用发酵法生产白酒时,需加入适量硫酸来控制速度,发酵后进行蒸馏,即可得到白酒,在该过程中不能用盐酸代替硫酸是因为_____________________________。
18、用化学方程式解释下列事实:
(1)电镀厂常用盐酸来除铁锈______________________。
(2)露天堆放的生石灰逐渐变质______________,________________。
(3)在滴有石蕊试液的蒸馏水中通入二氧化碳溶液显红色___________________。
(4)在清洗盛浓硫酸的铁槽时要远离火源的原因是___________,___________。
19、对于稀硫酸而言,溶质的质量分数越大,溶液的酸性越强。常温下,10%的稀硫酸的pH_____________(填“大于”、“小于”、“等于”)2%的稀硫酸的pH。如果要使稀硫酸的pH升高,你采取的方法有:
(1)不发生化学反应的方法:
、
。
(2)有化学反应发生的方法(要求各种方法中所选的物质类别不同):
; ; 。
三、实验探究题
*20、程明和王刚不小心将纯碱洒到白醋(其有效成分为醋酸,可用HAc表示)里,发现有大量气泡产生,这使他们对醋酸产生了新认识:醋酸像盐酸一样,能与纯碱反应;此外,他们通过查阅相关资料,还检索到以下信息:①醋酸与盐酸都具有较强挥发性;②醋酸是一种有机酸,具有酸的通性,且其钠盐(NaAc)受热不易分解;③盐酸与纯碱的反应分以下两步进行:
I.Na2CO3+HCl=NaHCO3+NaCl;Ⅱ.NaHCO3+HCl=NaCl+H2O+CO2↑
试根据以上信息回答下列问题:
(1)醋酸可以使紫色石蕊试液变 ;
(2)根据信息①可知醋酸应置于阴凉处 保存;
(3)试写出醋酸与纯碱第一步反应的化学方程式: ;
(4)他们向纯碱溶液中滴加醋酸到不再产生气泡后,将所得溶液蒸发结晶,获得了少量白色固体。王刚认为这就是纯净的NaAc,而程明则认为里面含有HAc。你认为 的观点正确,理由是:
。
**21、端午节后,小丽带着快乐的心情返回学校。当她来到实验室时,意外地发现实验桌上有瓶敞口放置已久的NaOH溶液,由此,激发了她的探究欲望。
【提出问题】这瓶NaOH溶液一定变质了,其变质程度如何呢?
【提出猜想】小丽的猜想:NaOH溶液部分变质。你的新猜想:
。
【实验探究】小丽设计如下实验来验证自己的猜想,请根据表中内容填写小丽实验时的现象
|
实验步骤 |
现象 |
结论 |
|
取少量NaOH溶液样品于试管中,先滴加足量的CaCl2溶液,然后再滴加酚酞试液。 |
|
NaOH溶液部分变质 |
假设你的猜想正确,并按小丽的实验方案进行实验,则你观察到的实验现象为_______。
【实验反思】(1)下列物质①BaCl2溶液、②Ca(NO3)2溶液、③Ca(OH) 2溶液、④Ba(OH)2溶液,不能替代小丽实验中CaCl2溶液的是________(填序号)。
(2)小丽第二次滴加的试剂除用指示剂外,还可以用________________替代。
【拓展应用】保存NaOH溶液的方法是
。
四、计算题
**22、小明家购买了一瓶白醋,标签上注明醋酸的质量分数≥5%。小明想,这瓶白醋中醋酸的含量是否与标签的标注相符?请你与小明一起,用有关酸碱的知识,定量测定白醋中醋酸的含量。
【实验原理】
①用已知浓度的氢氧化钠溶液和醋酸反应,反应的化学方程式为:
![]()
②在混合溶液中,当醋酸和氢氧化钠完全中和时,再增加一滴氢氧化钠溶液,溶液就呈碱性,而一滴氢氧化钠溶液约为0.05mL,对测定结果的影响很小,可忽略不计。
【实验步骤】
①用___________量取12.0mL白醋(密度近似为
②量取45.0mL溶质质量分数为1.0%的氢氧化钠溶液(密度近似为
【交流反思】
①在实验步骤①中,加适量水稀释白醋,对实验结果有无影响?为什么?
②在实验步骤②中,小明如何确定醋酸和氢氧化钠已完全中和?
【数据处理】根据实验数据,通过计算判断白醋中醋酸的含量是否与标签的标注相符。
![]()
【试题答案】
一、选择题:
|
题号 |
1 |
2 |
3 |
4 |
5 |
|
答案 |
A |
D |
C |
A |
B |
|
题号 |
6 |
7 |
8 |
9 |
10 |
|
答案 |
C |
A |
B |
D |
C |
|
题号 |
11 |
12 |
13 |
|
|
|
答案 |
A |
D |
D |
|
|
12、解析:首先分析图象,注意曲线的起点和拐点,坐标原点记为O点,曲线拐点记为B点,将曲线分成几段来分析:
OA段,消耗了一定量的Ba(OH)2溶液未有沉淀生成,说明原混合溶液显酸性并且不能为H2SO4。因为若有H2SO4,则很容易产生沉淀,曲线应从原点O出发,而不会从A点出发。故原混合溶液含有盐酸,不含H2SO4。又因为Na2CO3不能与盐酸在溶液中共存,故不含Na2CO3。
AB段,消耗了一定量的Ba(OH)2溶液,沉淀量从零增加到最大,说明一种物质能与Ba(OH)2溶液反应生成沉淀,在排除了H2SO4和Na2CO3后,这种物质只能为CuCl2,反应为CuCl2+Ba(OH)2=Cu(OH)2↓+BaCl2。
综合题意和图象,可得出正确答案为D。
13、分析:“CuSO4溶液显蓝色与什么离子有关”的可能性有两种:一种可能是Cu2+,另一种可能是![]() 。探究这一问题,要求设计的实验能够说明Cu2+、
。探究这一问题,要求设计的实验能够说明Cu2+、![]() 是否显蓝色。A、B实验的目的是,观察Cu2+和
是否显蓝色。A、B实验的目的是,观察Cu2+和![]() 是否显蓝色;C溶液中Cu2+从有到无,说明溶液显蓝色与溶液中是否含有Cu2+有关;D实验只能说明Cu2+、
是否显蓝色;C溶液中Cu2+从有到无,说明溶液显蓝色与溶液中是否含有Cu2+有关;D实验只能说明Cu2+、![]() 浓度的变化引起溶液颜色的变化。本题答案为D。
浓度的变化引起溶液颜色的变化。本题答案为D。
二、填空题
14、(1)② (2)⑤ (3)
③ (4)④
15、碱; 氧化物; 氢元素。
16、![]() 、Na2CO3+2HCl=2 NaCl+ H2O+
CO2↑。
、Na2CO3+2HCl=2 NaCl+ H2O+
CO2↑。
NaOH;HCl
17、因为浓盐酸有很强的挥发性
18、(1)Fe2O3+6HCl=2 FeCl3+3 H2O
(2)CaO+ H2O=Ca(OH) 2、Ca(OH) 2+CO2=CaCO3↓+H2O
(3)CO2+ H2O=H2CO3
(4)Fe+ H2SO4 = FeSO4+H2↑ 2H2+ O2![]() 2H2O
2H2O
19、小于;(1)加水 、加入中性的盐溶液。
(2)加碱,如氢氧化钠;加金属,如锌;加盐,如碳酸钠
三、实验探究题
20、解析:(1)红
(2)密封
(3) Na2CO3+HAc==NaHCO3+NaAc
(4)王刚 由于HAc具有挥发性,在蒸发过程中已经挥发掉
21、解析:【提出猜想】NaOH溶液全部变质
【实验探究】产生白色沉淀,酚酞试液变红 ;产生白色沉淀,酚酞试液不变色
【实验反思】(1) ③④ (2)硫酸铜溶液或氯化铁溶液等
【拓展应用】密封保存
四、计算题
22、解析:【实验步骤】①量筒
【交流反思】①无影响,因为溶液稀释过程中溶质的质量不变。②在白醋中先滴入几滴酚酞试液,当滴加最后一滴氢氧化钠溶液,溶液颜色由无色变为红色时,说明二者完全中和。
【数据处理】
解:参加反应的氢氧化钠的质量为(45mL-5mL)×
设
![]()
60:x=40:
则白醋中醋酸的质量分数为![]()
答:该白醋中醋酸的含量与标签的标注相符。