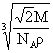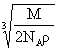![]()
【本讲教育信息】
一. 教学内容:
离子晶体
二. 教学目标
1、掌握离子晶体的概念,能识别氯化钠、氯化铯、氟化钙的晶胞结构。
2、学会离子晶体的性质与晶胞结构的关系。
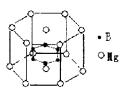
3、通过探究知道离子晶体的配位数与离子半径比的关系。
4、通过分析数据和信息,能说明晶格能的大小与离子晶体性质的关系。
三. 教学重点、难点
1、离子晶体的物理性质的特点;离子晶体配位数及其影响因素
2、晶格能的定义和应用
四. 教学过程:
(一)离子晶体的结构与性质:
电负性较小的金属元素原子和电负性较大的非金属元素原子相互接近到一定程度而发生电子得失,形成阴阳离子,阴阳离子之间通过静电作用而形成的化学键称为离子键。由离子键构成的化合物称为离子化合物。
阴阳离子间通过离子键相互作用,在空间呈现有规律的排列所形成的晶体叫做离子晶体。离子晶体以紧密堆积的方式排列,阴阳离子尽可能接近,向空间无限延伸,形成晶体。阴阳离子的配位数(指一个离子周围邻近的异电性离子的数目)都很大,故晶体中不存在单个的分子。
离子晶体中,阴、阳离子间有强烈的相互作用,要克服离子间的相互作用(离子键)使物质熔化或沸腾,就需要很高的能量。离子晶体具有较高的熔沸点,难挥发、硬度大,易脆等物理性质。离子晶体在固态时不导电,在熔融状态或水溶液中由于电离而产生自由移动的离子,在外加电场的作用下定向移动而导电。大多数离子晶体易溶于水等极性溶剂,难溶于非极性溶剂。
离子晶体的性质还取决于该晶体的结构,下面是几种常见的离子晶体的结构:
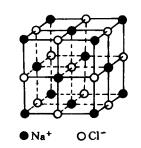
(1)NaCl型晶体结构(面心立方)
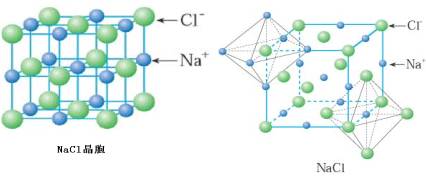
每个Na+周围最邻近的Cl-有6个,每个Cl-周围最邻近的Na+有6个,则Na+、Cl-的配位数都是6。因此整个晶体中, Na+、Cl-比例为1:1,化学式为NaCl,属于AB型离子晶体。同时,在NaCl晶体中,每个Cl-周围最邻近的Cl-有12个,每个Na+周围最邻近的
Na+也有12个。
(2)CsCl型晶体结构(体心立方)
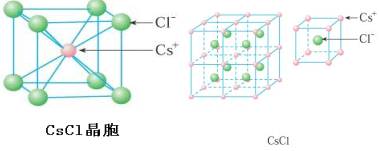
每个Cs+周围最邻近的Cl-有8个,每个Cl-周围最邻近的Na+有8个,则Cs+、Cl-的配位数都是8。因此整个晶体中, Cs+、Cl-比例为1:1,化学式为CsCl也属于AB型离子晶体。在NaCl晶体中,每个Cl-周围最邻近的Cl-有8个,每个Cs+周围最邻近的Cs+也有8个。
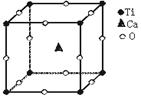
(3)CaF2型晶体结构:
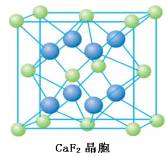
每个Ca 2+周围最邻近的F-有8个,表明Ca 2+的配位数为8。每个F-周围最邻近的
Ca 2 +有4个,表明F-的配位数是4。由此可见,在CaF2晶体中,Ca 2 +和F-个数比为
1:2,刚好与Ca 2 +和F-的电荷数之比相反。
说明:
1、离子键的实质是阴阳离子间的静电作用,它包括阴、阳离子间的静电引力和两种离子的核之间以及它们的电子之间的静电斥力两个方面,当静电引力与静电斥力之间达到平衡时,就形成了稳定的离子化合物,它不再显电性。离子键不具有方向性和饱和性。
2、离子化合物中不一定含金属元素,如铵盐;含金属元素的化合物也不一定是离子化合物,如氯化铝、氯化铍等。
3、离子键只存在于离子化合物中,离子化合物中一定含有离子键,也可能含有共价键,如强碱、含氧酸盐等,共价化合物中肯定不含离子键。
4、离子化合物受热熔化或溶于水时离子会被破坏,从水溶液中结晶形成离子化合物时会形成离子键,但它们都属于物理变化。因此,破坏化学键或形成化学键不一定发生化学变化,但化学变化过程一定有旧的化学键断裂和新的化学键的形成。
5、离子键的强弱与阴、阳离子所带的电荷成正比,与半径成反比。
6、含有阳离子的晶体不一定是离子晶体,如金属晶体中含有金属阳离子;但含有阴离子的晶体肯定是离子晶体。
7、离子晶体在水溶液中或熔融状态下由于电离产生自由移动的阴、阳离子,在外加电场的作用下而导电;而金属晶体则是晶体中的自由电子在外加电场作用下定向移动形成电流。
8、离子晶体的结构有面心立方(如NaCl型)、体心立方(如CsCl型)等结构,决定离子晶体结构的因素有几何因素和电荷因素,除此以外还有键性因素。
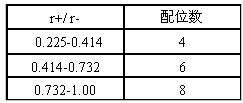
(1)几何因素:晶体中正负离子的半径比
如下表中是AB型离子晶体的几何因素与配位数的关系
(2)电荷因素:晶体中阴、阳离子电荷比
(3)键性因素:离子键的纯粹程度
9、离子晶体的熔沸点,取决于构成晶体的阴、阳离子间离子键的强弱,而离子键的强弱,又可用离子电荷和离子半径衡量。通常情况下,同种类型的离子晶体,离子半径越小,电荷越大,离子键越强,熔沸点越高。
10、碳酸盐的分解温度与金属离子所带电荷和离子半径的大小有关。
(二)晶格能
晶格能是指气态离子形成1mol离子晶体释放的能量,或是指1mol离子化合物中,由相互远离的阴、阳离子结合成离子晶体时所放出的能量。放出的能量越多,晶格能的绝对值越大,表示离子键越强,晶体越稳定。
如:1mol气态钠离子和1mol气态氯离子结合生成1mol氯化钠晶体释放的能量为氯化钠晶体的晶格能。
Na+ (g) + Cl-(g) === NaCl (s); △H
对晶体构型相同的离子化合物,离子电荷数越多,核间距越小,晶格能越大;晶格能越大,离子键越强,晶体越稳定,熔点越高,硬度越大。
说明:
1、晶格能是离子晶体中离子间结合力大小的一个量度。晶格能越大,表示离子晶体越稳定,破坏其晶体耗能越多。我们知道离子晶体间存在着离子间的静电引力,因此,晶格能本质上是离子间静电引力大小的量度。
2、晶格能与阴、阳离子所带电荷的乘积成正比,与阴、阳离子的核间距离成反比。
3、离子化合物的晶格能一般都比较大,这是由于离子间有强烈的静电引力之故。较大的晶格能意味着离子间结合紧密,这样的离子化合物其熔点和硬度必定很高。事实上,高熔点、高硬度就是离子化合物的显著特征。
4、既然是静电引力,可以想象,正负离子的电荷越高,核间距离越小,静电引力就越大,晶格能就越大。相应地,其熔点、硬度就越大,这就是如MgO、CaO以及Al2O3常被用来作高温材料和磨料的原因。
5、晶格能也影响了岩浆结晶析出的次序,晶格能越大,岩浆中的矿物越易结晶析出
【典型例题】
例1. 下列性质中,可以证明某化合物内一定存在离子键的是
A. 可溶于水 B.
具有较高的熔点
C. 水溶液能导电 D.
熔融状态能导电
解析:本题考查对化学键——离子键的判断。只要化合物中存在离子键必为离子晶体,而离子晶体区别其它晶体的突出特点是:熔融状态下能导电,故D正确;至于A可溶于水,共价化合物如:HCl也可以;B具有较高熔点,也可能为原子晶体,如SiO2;C水溶液能导电,可以是共价化合物,如硫酸等。
答案: D
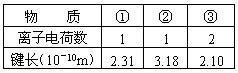
例2. ①NaF ②NaI ③MgO 均为离子化合物,根据以下数据,推知这三种化合物的熔点的高低顺序是:
A. ①>②>③ B.
③>①>②
C. ③>②>①
D.
②>①>③
解析:离子晶体熔点的高低主要取决于离子键的相对强弱(或晶格能的大小),而离子键的强弱(或晶格能的大小)与离子所带电荷的乘积成正比,与离子间距离成反比。③中镁离子和氧离子的电荷大,半径小,所以晶格能最大,熔点最高,①②中离子所带电荷相同,但②中碘的半径大于①氟的半径,故NaI的晶格能小于NaF的晶格能,熔点最低。
答案:B
例3. 参考下表中物质的熔点,回答下列问题。
|
物 质 |
NaF |
NaCl |
NaBr |
NaI |
NaCl |
KCl |
RbCl |
CsCl |
|
熔点(℃) |
995 |
801 |
755 |
651 |
801 |
776 |
715 |
646 |
|
物 质 |
SiF4 |
SiCl4 |
SiBr4 |
SiI4 |
SiCl4 |
GeCl4 |
SbCl4 |
PbCl4 |
|
熔点(℃) |
-90.4 |
-70.2 |
5.2 |
120 |
-70.2 |
-49.5 |
-36.2 |
-15 |
(1)钠的卤化物及碱金属的氯化物的熔点与卤离子及碱金属离子的__ 有关,随着_________增大,熔点依次降低.
(2)硅的卤化物及硅、锗、锡、铅的氯化物熔点与 有关,随着 增大,增强,熔点依次升高.
(3)钠的卤化物的熔点比相应的硅的卤化物的熔点高得多,这与 有关,因为一般_________比 熔点高.
解析:本题主要考查物质熔沸点的高低与晶体类型和晶体内部微粒之间作用力的关系以及分析数据进行推理的能力。
(1)表中第一栏的熔点明显高于第二栏的熔点,第一栏为IA元素与ⅦA元素组成的离子晶体,则第二栏为分子晶体。
(2)分析比较离子晶体熔点高低的影响因素:
物质熔化实质是减弱晶体内微粒间的作用力,而离子晶体内是阴、阳离子,因此离子晶体的熔化实际上是减弱阴、阳离子间的作用力——离子键,故离子晶体的熔点与离子键的强弱有关。从钠的卤化物进行比较:卤素离子半径是r(F-)<r(Cl-)<r(Br-)<r(I-),说明熔点随卤素阴离子半径的增大而减小。又从碱金属的氯化物进行比较:碱金属阳离子半径是
r(Na+)<r(K+)<r(Rb+)<r(Cs+),说明熔点随碱金属阳离子半径的增大而减小。
(3)分析比较分子晶体熔点高低的影响因素:
分子晶体内的微粒是分子,因此分子晶体的熔点与分子间的作用力有关。
从硅的卤化物进行比较:硅的卤化物分子具有相似的结构,从SiF4到SiI4相对分子量逐步增大,说明熔点随化学式的式量的增加而增大。
由从硅、锗、锡、铅的氯化物进行比较:这些氯化物具有相似的结构,从SiCl4到PbCl4相对分子质量逐步增大,说明熔点随化学式的式量的增加而增大。
答案 :(1)半径,半径;(2)相对分子质量,相对分子质量,分子间作用力;
(3)晶体类型,离子晶体,分子晶体
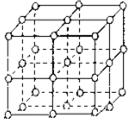
例4. (1)中学化学教材中图示了NaCl晶体结构,它向三维空间延伸得到完美晶体。NiO(氧化镍)晶体的结构与NaCl 相同,Ni2+与最临近O2-的核间距离为a×10-8cm,计算NiO晶体的密度(已知NiO的摩尔质量为74.7g/mol)。
(2)天然和绝大部分人工制备的晶体都存在各种缺陷,例如在某氧化镍晶体中就存在如图所示的缺陷:一个Ni2+空缺,另有两个Ni2+被两个Ni3+所取代。其结果为晶体仍呈电中性,但化合物中Ni和O的比值却发生了变化。某氧化镍样品组成Ni0.97O,试计算该晶体中Ni3+ 与Ni2+的离子个数之比。
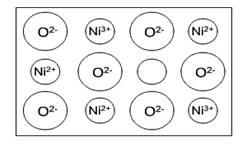
解析:(1)如图所示,以立方体作为计算单元,此结构中含有Ni2+——O2-离子对数为:4×![]() =
=![]() (个),所以1mol NiO晶体中应含有此结构的数目为6.02×1023÷
(个),所以1mol NiO晶体中应含有此结构的数目为6.02×1023÷![]() =12.04×1023(个),又因一个此结构的体积为a×10-8cm3,所以1mol NiO的体积为12.04×1023×(a×10-8cm)3 ,NiO的摩尔质量为74.7g/ mol,所以NiO晶体的密度为
=12.04×1023(个),又因一个此结构的体积为a×10-8cm3,所以1mol NiO的体积为12.04×1023×(a×10-8cm)3 ,NiO的摩尔质量为74.7g/ mol,所以NiO晶体的密度为
![]()
(2)解法一(列方程):设1mol Ni0.97O中含Ni3+为x
mol, Ni2+为y mol , 则得
x+y=0.97 (Ni原子个数守恒)
3x+2y=2 (电荷守恒)
解得x=0.06 ,
y=0.91 故n (Ni3+) :n(Ni2+) = 6 :91
解法二(十字交叉):由化学式Ni0.97O求出Ni的平均化合价为2/0.97,则有
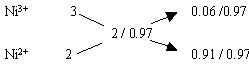
故 n (Ni3+) :n(Ni2+) = 6 :91。
解法三 直接分析法
依题意,一个Ni2+空缺,另有两个Ni2+被两个Ni3+取代。由Ni0.97O可知,每100个氧离子,就有97个镍离子,有三个Ni2+空缺,也就有6个Ni2+被Ni3+所取代,所以Ni3+有6个,Ni2+为97-6=91个。即Ni3+与Ni2+之比为6:91。
解法四 鸡兔同笼法
从Ni0.97O可知,假如有100个氧离子,就有97个镍离子,假设这97个镍离子都是+2价,那么正价总和为194价,负价总和为200价。为什么还差+6价呢?
这是因为多假设了6个+2价的镍离子。实际上有Ni3+6个、Ni2+91个。所以Ni3+与Ni2+的个数比为6:91。
说明:求解晶体结构计算题,空间三维立体想象是关键。要运用分割、增补等手段。解此类题的中心思想是把化学问题抽象成数学问题来解决。
答案:NiO晶体的密度为62.3/a3(g/cm3)Ni3+与Ni2+之比为6:91
【模拟试题】(答题时间:30分钟)
1. 由钾和氧组成的某种离子晶体中含钾的质量分数为78/126,其阴离子只有过氧离子
(O22-)和超氧离子(O2-)两种。在此晶体中,过氧离子和超氧离子的物质的量之比为
A. 2︰1 B.
1︰1 C.
1︰2 D.
1︰3
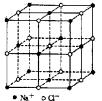
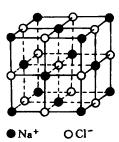
2, 食盐晶体如右图所示。在晶体中,· 表示Na+,o 表示Cl-。已知食盐的密度为r g / cm3,NaCl摩尔质量M g / mol,阿伏加德罗常数为N,则在食盐晶体里Na+和Cl-的间距大约是
A. ![]() cm B.
cm B.
![]() cm C.
cm C.
![]() cm D.
cm D.
![]() cm
cm
3. 下列物质中,含有共价键的离子晶体是
A. NaCl B. NaOH C. NH4Cl D. I2
4. 实现下列变化,需克服相同类型作用力的是
A. 石墨和干冰的熔化 B. 食盐和冰醋酸的熔化
C. 液溴和水的汽化 D. 纯碱和烧碱的熔化
5. 下列性质中,能较充分说明某晶体是离子晶体的是
A. 具有高的熔点 B. 固态不导电,水溶液能导电
C. 可溶于水 D. 固态不导电,熔化状态能导电
6. 下列叙述中正确的是
A. 离子晶体中肯定不含非极性共价键
B. 原子晶体的熔点肯定高于其他晶体
C. 由分子组成的物质其熔点一定较低
D. 原子晶体中除去极性共价键外不可能存在其他类型的化学键
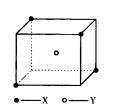
7. 某物质的晶体中,含A、B、C三种元素,其排列方式如右图所示(其中前后两面心上的B原子不能画出),晶体中A、B、C的原子个数比为
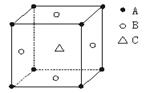
A. 1:3:1 B. 2:3:1 C. 2:2:1 D. 1:3:3
8. 实现下列变化,需克服相同类型作用力的是
A. 碘和干冰升华 B. 二氧化硅和生石灰熔化
C. 氯化钠和铁熔化 D. 苯和乙烷蒸发
9. 下列各组物质的晶体中,化学键类型相同,晶体类型也相同的是
A. SO2和SiO2 B. CO2和H2O C. NaCl和HCl D. CCl4和KCl
10. 如下图所示,是一种晶体的晶胞,该离子晶体的化学式为
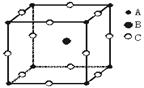
A. ABC B. ABC3 C. AB2C3 D. AB3C3
11. 实现下列变化时,需克服相同类型作用力的是
A. 水晶和干冰的熔化 B. 食盐和冰醋酸的熔化
C. 液溴和液汞的汽化 D. 纯碱和烧碱的熔化
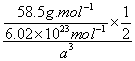 =2.2g/cm3
=2.2g/cm3