![]()
【本讲教育信息】
一、教学内容
丰富多彩的物质世界(一)
二、考点清单
1、能根据物质的组成和性质对常见物质进行分类
2、了解比较和分类对化学研究的作用
3、掌握单质、氧化物、酸、碱、盐之间的转化关系
三、全面突破
知识点1:物质的分类与转化
物质的分类
对物质分类的依据有很多,比如根据物质存在的状态,可以将物质分为气态物质,液态物质和固态物质;根据物质的导电性,可以将物质分为导体,半导体,绝缘体;根据物质在水中的溶解性,可以将物质分为可溶性物质,微溶性物质和难溶性物质。
而我们比较常用的是根据物质的组成对物质进行分类。
按照物质组成的分类
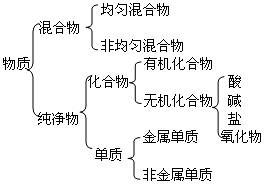
1、混合物:是由两种或多种物质混合而成的
2、纯净物:是由一种物质组成的
3、单质:是由同种元素组成的纯净物
【辨析】由同种元素组成的物质一定是单质吗?(不一定)
同一种元素可以形成几种不同的单质,如磷元素可以形成白磷、红磷、黑磷三种单质;碳元素可以形成金刚石、石墨、C-60三种单质,氧元素可以形成氧气和臭氧两种单质。由同种元素组成的不同单质互称“同素异形体”。
4、酸:电离出的阳离子都是氢离子的化合物。
【辨析】
根据是否含有氧元素分为含氧酸,如:H2SO4和无氧酸,如HCl;也可根据电离程度分为强酸,如HCl、H2SO4、HNO3和弱酸,如H2SO3、H2CO3、HClO;又可根据电离出的氢离子数目分为:一元酸,如HCl、HNO3;二元酸,如H2SO4、H2CO3和三元酸,如H3PO4等。还可根据是否有挥发性分为挥发性酸HCl、HNO3和难挥发性酸H2SO4等,或根据成酸元素是否有氧化性,分为氧化性酸,如HNO3、H2SO4和非氧化性酸,如HCl、H2CO3等
5、碱:电离出的阴离子都是氢氧根离子的化合物。
【辨析】我们仿照酸的分类,也可以把它分成强碱、弱碱,或者分成一元碱、二元碱、三元碱
6、盐:一类组成中含有金属离子(或铵根离子)和酸根离子的化合物.
【辨析】根据组成盐的阴阳离子的不同,分为正盐,酸式盐、碱式盐,可以根据酸根中是否含有氧元素分为含氧酸盐和无氧酸盐,还可以根据溶解度不同,分为可溶性盐、微溶性盐和难溶性盐。
7、氧化物:
酸性氧化物:和碱反应得到盐和水的氧化物。如:SO2、CO2、SO3等
碱性氧化物:和酸反应得到盐和水的氧化物。如:Na2O 、CuO、Fe2O3等
两性氧化物:既可与酸反应又可与碱反应的氧化物。如:Al2O3
【典型例题】
例1、某物质经分析只含有一种元素,则该物质( )
A、一定是纯净物 B、一定是混合物
C、可能是化合物 D、可能是纯净物、也可能是混合物
【解析】一种元素可形成不同的单质,如:磷元素可以形成白磷、红磷、黑磷三种单质;碳元素可以形成金刚石、石墨、C-60等单质;氧元素可以形成氧气和臭氧两种单质。由同种元素组成的不同单质互称“同素异形体”。
【答案】D
例2、下列物质,肯定为纯净物的是( )
A、只由一种元素组成的物质
B、只由一种原子组成的物质
C、只由一种分子组成的物质
D、只由一种元素的阳离子跟另一种元素的阴离子组成的物质
【解析】A B 解析同例1,选项D同一种元素可以有不同种离子,如Fe2+ Fe3+
【答案】C
例3、下列关于氧化物的叙述正确的是( )
A、非金属氧化物一定是酸性氧化物
B、金属氧化物一定是碱性氧化物
C、酸性氧化物均可以跟碱反应
D、不能跟酸反应的氧化物一定能跟碱反应
【解析】碱性氧化物一定是金属氧化物,但金属氧化物不一定是碱性氧化物,有的是过氧化物(如Na2O2),有的是两性氧化物(如BeO、Al2O3),某些金属(过渡元素)氧化物甚至可以是酸性氧化物(如CrO3、Mn2O7);非金属氧化物大多有对应酸,但有的为不成盐氧化物;即不能与酸反应,又不能与碱反应。
【答案】C
例4、下列物质中:A. 6mol·L-1H2SO4 B. NaCl C. 碱石灰 D. Ca(OH)2,哪种物质可与NaOH固体、P2O5固体、无水CaCl2归为一类?并说明理由。
。
【解析】碱石灰、NaOH固体、P2O5固体、无水CaCl2 均是常见的干燥剂
【答案】C
理由见解析
例5、单晶硅是制作电子集成电路的基础材料。科学家预计,到2011年一个电脑芯片上将会集成10亿个晶体管,其功能远比我们想象的要大得多,这对硅的纯度要求很高。用化学方法可制得高纯度硅,其化学方程式为:
①SiO2
+ ![]() Si + 2CO↑
②Si + 2Cl2
Si + 2CO↑
②Si + 2Cl2![]() SiCl4
③SiCl4 + 2H2
SiCl4
③SiCl4 + 2H2![]() Si + 4HCl,
Si + 4HCl,
其中,反应①和③属于( )
A. 化合反应 B. 分解反应 C.
置换反应 D. 复分解反应
【解析】由一种单质和一种化合物反应,生成另一种单质和另一种化合物的反应称为置换反应。
【答案】C
知识点2:物质的转化
一)物质的性质
1. 酸的通性
①使酸碱指示剂显示不同的颜色
②与多种活泼金属反应,生成氢气和盐
③与某些金属氧化物反应,生成盐和水
④与碱反应,生成盐和水
⑤与某些盐反应 ,生成新的盐和新的酸(强酸制弱酸)
2. 碱的通性
①使酸碱指示剂显示不同的颜色
②与某些非金属氧化物反应,生成盐和水
③与酸反应,生成盐和水
④与某些盐反应,生成新的盐和新的碱
3. 盐的通性
①可与某些金属反应(置换反应)
②与酸反应(强酸制弱酸)
③与碱反应(强碱制弱碱)
④两种盐之间的反应(复分解反应)
4. 氧化物的通性
酸性氧化物①与碱反应生成盐和水
②与水反应生成酸
③与碱性氧化物反应
碱性氧化物①与酸反应生成盐和水
②与水反应生成碱
③与酸性氧化物反应
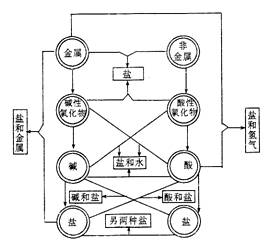
二)物质间的转化关系
无机物之间的转化〔七类物质反应的相互关系表,便于书写化学方程式〕
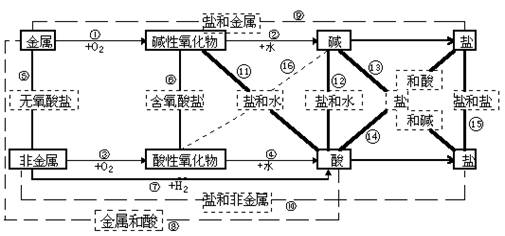
化学反应类型
1. 四类基本反应
化合反应:由两种或两种以上的物质生成另一种物质的反应。A+B+…=C
分解反应:由一种物质生成两种或两种以上新物质的反应。A=B+C+…
置换反应:一种单质与一种化合物反应生成另外一种单质和另外一种化合物的反应。AB+C=A+CB
复分解反应:两种化合物相互交换成分,生成另外两种化合物的反应。AB+CD=AD+CB
2. 氧化还原反应
氧化还原反应:凡是有元素的化合价发生变化的反应即为氧化还原反应。
非氧化还原反应:凡是化学反应中元素的化合价没有发生变化的化学反应即为非氧化还原反应。
【辨析】氧化还原反应与四类基本反应类型的关系:置换反应一定是氧化还原反应,复分解反应一定不是氧化还原反应;化合反应与分解反应不一定是氧化还原反应。
【典型例题】
例1. 下列关于化学反应类型的叙述中,正确的是 ( )
A. 凡是生成盐和水的反应都是中和反应
B. 分解反应一定没有单质参加
C. 生成一种单质和一种化合物的反应一定是置换反应
D. 分解反应的生成物一定有单质
【解析】生成盐和水的反应不一定是中和反应,可以是酸性氧化物与碱的反应,也可以是碱性氧化物与酸的反应等;分解反应是指一种化合物分解成两种或两种以上较简单的单质或化合物的反应;生成一种单质和一种化合物的反应不一定是置换反应,如:SO2 +2H2S =
3S↓+2H2O;分解反应的生成物不一定有单质生成,如:H2CO3 = CO2↑ + H2O
【答案】B
例2. 在下列溶液中分别放入铁棒,过一会儿再把铁棒取出后(1)能使铁棒质量增加的溶液是( );(2)溶液质量不变的是( );(3)溶液质量增加的是( )
A. 稀硫酸 B. 食盐水 C. 硫酸铜溶液 D.
盐酸
【解析】略
【答案】(1)C (2)B (3)A D
例3. A是废铁表面上红色固体的主要成分,B、C、F都是单质,D、F都是无色无味的气体,它们之间的相互转化关系如下图:
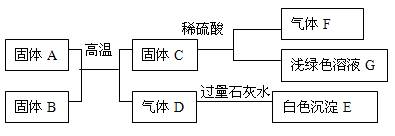
试写出下列各物质的化学式:A______________ B_______________ C_____________
D_______________
E________________ F_________________
【解析】A是废铁屑表面上红色固体的主要成分,则A为Fe2O3,由关系式得:B为C ,C为Fe,D为CO2 ,E为CaCO3,F为H2
【答案】见解析
例4. 写出通过不同物质间反应获得MgCl2的反应的化学方程式,写的越多越好。
【解析】根据各类物质间反应生成盐的规律可知:
(1)金属单质 + 非金属单质:Mg + Cl2 ![]() MgCl2
MgCl2
(2)金属单质 + 酸:Mg + 2HCl = MgCl2 +H2↑
(3)金属单质 + 盐:Mg + ZnCl2 = MgCl2 + Zn
(4)碱性氧化物 + 酸性氧化物:MgCl2为无氧酸盐,不可行
(5)碱性氧化物 + 酸:MgO + 2HCl = MgCl2 + H2O
(6)酸性氧化物 + 碱:MgCl2为无氧酸盐,不可行
(7)盐+ 酸:MgCO3 + 2HCl = MgCl2 + H2O + CO2↑
(8)碱+ 酸:Mg(OH)2 + 2HCl = MgCl2 + 2H2O
(9)碱+ 盐:因为Mg(OH)2难溶,不可行
【答案】见解析
四、应考锦囊
本讲兼顾两个任务,一是对初中化学的小结,二是体验化学研究的一般过程:进行化学研究首先是对物质进行分类,判断其可能的化学性质,其次是通过物质之间的转化,得出其可能发生的一些化学反应,同学们应学会用分类的方法学习化学,熟练掌握物质之间相互转化的原理,为今后高中化学的学习打下基础。
五、本讲小结
一)物质的分类
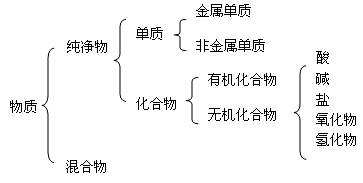
二)单质、氧化物、酸、碱、盐等物质之间的相互转化关系注意:复分解反应的条件:有沉淀、气体、水生成。金属与盐溶液的置换条件:活泼性强的金属置换活泼性弱的金属。
六、超前思维(丰富多彩的物质世界(二))
一)物质的量及其单位-—摩尔
1、物质的量是一种基本物理量,它以物质所含基本粒子的多少来衡量物质的多少。通过它可以把物质的 质量与其所含的
等微观粒子的数量联系起来。物质的量的单位是
,简称
,符号为 。
2、国际上规定,质量为 kg
[思考]
1、0.5molH2SO4约含有
个硫酸分子。
2、10molNa+中约含有
个钠离子。
3、物质的量(n)、物质所含的微粒数(N)与阿伏加德罗常数(NA)的关系:
1个O2分子有___个O原子,100个O2分子有___个O原子,
1molO2分子有_____ molO原子,_____个O原子.
2molO2分子有_____
molO原子,_____个O原子.
二)摩尔质量
1、摩尔质量定义
符号:
;表示:
,单位:
思考:
1molH2O的质量为
1molH2的质量为
1molH的质量为
1molMg2+的质量为
2molH2SO4的质量为 。
2、摩尔质量与物质式量的关系:
0.5molSO42-的质量为
36gH2O的物质的量为
【模拟试题】(答题时间:45分钟)
一、选择题(每小题只有一个正确答案)
1、下列叙述中,正确的是( )
A、由同种元素组成的物质肯定属于纯净物
B、一种元素可形成多种离子,但只能是带同种电荷的离子
C、含金属元素的离子不一定都是阳离子
D、有相同质子数的微粒都属于同种元素
2、民族英雄于谦的《石灰吟》:“千锤万凿出深山,烈火焚烧若等闲。粉身碎骨浑不怕,要留清白在人间。”请你从化学的视角,找出符合诗句中物质变化顺序的选项( )
A、CaCO3→Ca(OH)2 →CaO→CaCO3
B、CaCO3→CaO→Ca(OH)2→CaCO3
C、CaO→Ca(OH)2→CaO→CaCO3
D、Ca(OH)2→CaCO3→CaO→CaCO3
3、下列物质属于碱的是( )
A、纯碱:Na2CO3
B、烧碱:NaOH
C、生石灰:
4、将下列物质按酸、碱、盐分类排列,正确的是( )
A、硫酸,纯碱,食盐 B、氢氯酸,烧碱,胆矾
C、碳酸,乙醇,醋酸钠 D、磷酸,熟石灰,苛性钾
5、下列各组物质中都属于纯净物的一组是( )
A、液态氧 汽水
B、洁净的空气 纯净的盐酸
C、冰水混合物 干冰
D、铁矿石 金刚石
6、下列说法错误的是( )
A、化合反应一定是氧化还原反应 B、分解反应可能是氧化还原反应
C、置换反应一定是氧化还原反应 D、复分解反应一定不是氧化还原反应
7、下列说法正确的是( )
A、纯净物是指由同种元素组成的物质
B、由同种元素组成的纯净物叫单质
C、由不同种分子组成的物质叫化合物
D、一种元素只能组成一种单质
8、Na2CO3俗名纯碱,下面是对纯碱采用不同分类法的分类,不正确的是( )
A、Na2CO3是碱 B、Na2CO3是盐
C、Na2CO3是钠盐 D、Na2CO3是碳酸盐
9、下列物质的分类正确的是( )
|
|
碱 |
酸 |
盐 |
碱性氧化物 |
酸性氧化物 |
|
A |
Na2CO3 |
H2SO4 |
NaOH |
SO2 |
CO2 |
|
B |
NaOH |
HCl |
NaCl |
Na2O |
CO |
|
C |
NaOH |
CH3COOH |
CaF2 |
CO |
SO2 |
|
D |
KOH |
HNO3 |
CaCO3 |
CaO |
SO2 |
二、填空题:
10、现有生石灰、食盐、高锰酸钾、铜片、硝酸银和水六种物质,请选用其中部分物质为反应物,按下列要求各写一个化学方程式。
(1)化合反应
;
(2)分解反应
;
(3)置换反应
;
(4)复分解反应
;
11、今有下列三组物质,每组中都有一种物质跟其他三种物质属于不同的类。将挑出的物质(写化学式)和挑选依据(挑出的物质与其他物质不同之处)列在下面相应的表格内。三组物质分别为:(1)O2、H2、C、N2;(2)Fe、Na、Al、Si;(3)CO、CO2、SO2、Fe3O4。
|
组别 |
被挑出的物质 |
挑选依据 |
|
第(1)组 |
|
|
|
第(2)组 |
|
|
|
第(3)组 |
|
|
12、将符合下列反应类型的化学方程式的序号填在下列分类方法后的横线中:
A、Fe3O4+4CO![]() 3Fe+4CO2 B、2KMnO4
3Fe+4CO2 B、2KMnO4![]() K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
C、Zn+H2SO4=ZnSO4+H2↑
D、CaCO3+2HCl=CaCl2+H2O+CO2↑
E、C2H5OH(酒精)+3O2![]() 2CO2+3H2O
2CO2+3H2O
F、3Fe+2O2![]() Fe3O
Fe3O![]() Cu+H2O
Cu+H2O
(1)属于化合反应的是
;(2)属于分解反应的是
;
(3)属于复分解反应的是
;(4)属于置换反应的是
;
(5)属于氧化还原反应的是
;
13、把下列物质按要求进行分类:Fe、Cu、S、H2、HCl、NaOH、H2SO4、Ba(OH)2、NaHCO3、K2O、CuO、NaCl溶液、空气。
(1)混合物
;(2)非金属单质
;
(3)氧化物
;(4)碱
;
(5)盐
。
14、同学们吃的零食的包装袋中经常有一个小纸袋,上面写着“干燥剂”,其主要成分是生石灰(CaO)。
(1)生石灰属于哪种类别的物质?
(2)生石灰可做干燥剂的理由是什么?(用化学方程式表示)
(3)生石灰还可以跟哪些类别的物质发生化学反应?列举两例,并写出化学方程式。
(4)小纸袋中的物质能否长期持续地做干燥剂?为什么?
(5)在你所认识的化学物质中,还有哪些可以用作干燥剂?列举一例。
【试题答案】
1、C 2、B 3、B 4、B 5、C 6、A 7、B 8、A 9、D
10、(1)CaO + H2O
= Ca(OH)2
(2)2KMnO4
![]() K2MnO4 + MnO2 +
O2↑
K2MnO4 + MnO2 +
O2↑
(3)Cu + 2AgNO3
= 2Ag + Cu(NO3)2 (4)NaCl +
AgNO3 = AgCl↓+ NaNO3
11、
|
组别 |
被挑出的物质 |
挑选依据 |
|
第(1)组 |
C |
C常温下为固态,其余物质为气态 |
|
第(2)组 |
Si |
Si为非金属,其余为金属 |
|
第(3)组 |
Fe3O4 |
Fe3O4为金属氧化物,其余为非金属氧化物 |
12、(1)F (2)B (3)D (4)CG (5)ABCEFG
13、(1)NaCl溶液、空气 (2)S、H2 (3)K2O、CuO (4)NaOH、Ba(OH)2
(5)NaHCO3
14、(1)化合物、金属氧化物、固态物质等。
(2)CaO + H2O
= Ca(OH)2
(3)与酸反应:CaO + 2HCl = CaCl2 + H2O;与非金属氧化物反应:CaO + H2O = ![]()
(4)不能,因为生石灰全部变为Ca(OH)2后,就不能再起干燥作用了。
(5)浓硫酸、CaCl2、P2O5
、碱石灰等。