![]()
【本讲教育信息】
一. 教学内容:
晶体的常识
二. 教学目标
了解晶体与非晶体的本质区别和性质上的差异
了解晶胞的概念及晶胞中微粒个数的计算
三. 教学重点、难点
晶体与非晶体的本质区别和性质上的差异;晶胞中微粒个数的计算
四. 教学过程:
(一)晶体与非晶体:
晶体是具有规则的几何外形的固体,而非晶体则没有规则的几何外形。
晶体与非晶体的本质差异
|
|
自范性 |
微观结构 |
|
晶体 |
有(能自发呈现多面体外形) |
原子在三维空间里呈周期性有序排列 |
|
非晶体 |
没有(不能自发呈现多面体外形) |
原子排列相对无序 |
晶体的特点:
(1)有固定的几何外形;
(2)有固定的熔点;
(3)有各向异性。
晶体形成的一段途径:
(1)熔融态物质凝固;
(2)溶质从溶液中析出;
(3)气态物质冷却不经液态直接凝固(凝华)。
说明:
1、晶体可以认为是内部粒子(原子、离子、分子)在空间按一定规律周期性重复排列构成的固体物质,如食盐、干冰、金刚石等;而非晶体则是内部原子或分子的排列呈杂乱无章的分布状态的固体物质,如:橡胶、玻璃、松香等。
2、晶体的自范性是指:在适宜的条件下,晶体能够自发地呈现封闭的规则和凸面体外形的性质。晶体自范性的本质:是晶体中粒子微观空间里呈现周期性的有序排列的宏观表象。 晶体自范性的条件是:生长速率适当。
3、由于晶体各个方向排列的质点的距离不同,而导致晶体各个方向的性质也不一样。对于晶体来说,许多物理性质:如硬度、导热性、光学性质等,因研究角度不同而产生差异,即为各向异性。
4、加热晶体,温度达到晶体熔点时即开始熔化,在没有完全熔化之前,继续加热,温度不会升高,完全熔化后,温度才会升高,即晶体具有固定的熔点;加热非晶体,温度达到一定程度后开始软化,流动性很强,最后变为液体,从软化到熔化,中间经过一段很长的温度范围,即非晶体没有固定的熔点。
5、当单一波长的X-射线通过晶体时,可发生衍射,会在记录仪上看到分立的斑点或谱线。说明晶体可使X-射线产生衍射,而X-射线通过非晶体时只能产生散射。因此,利用晶体的这一性质,来鉴别晶体与非晶体。
6、熔融态物质凝固以及溶质从溶液中析出时,在适宜的生长速率下可以形成晶体,但如果生长速率不当,则形成的晶体外形很不规则。
7、晶体按其构成微粒可分为:原子晶体、离子晶体、分子晶体、金属晶体以及过渡型晶体等五类。
8、晶体有规则的几何外形,但有规则的几何外形的物质不一定是晶体。
9、同一物质有时是晶体,有时也是非晶体。
10、鉴别晶体与非晶体时可以从晶体的各向异性和X-射线衍射角度进行鉴别,晶体具有各向异性以及能使X-射线发生衍射,而非晶体不具有这些性质
(二)晶胞:
晶胞:晶体中重复出现的最基本的结构单元。晶胞都是平行六面体,整块晶体可看作是数量巨大的晶胞“无隙并置”而成。所谓“无隙”,是指相邻晶胞之间没有任何间隙。所谓“并置”,是指所有晶胞都是平行排列的,取向相同。
三种典型立方晶体结构
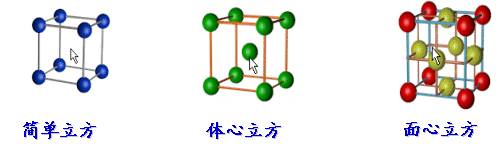
在立方晶体结构中:
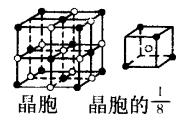
顶点同为8个晶胞共有,平均每个晶胞占有1/8;每个面同为2个晶胞共有,平均占有1/2;每条棱同为4个晶胞共有,平均占有1/4;而体心(内部)只为一个晶胞所拥有,平均占有1。
说明:
1、晶胞的本质特征:晶胞是晶体中最小的结构重复单元;晶胞一定是平行六面体,其三条边的长度不一定相等,也不一定互相垂直。晶胞的形状和大小由具体晶体的结构决定,晶胞不能是八面体或六棱柱等其他形状;整个晶体就是晶胞按其周期性在三维空间重复排列而成的。
2、所谓“并置堆砌”是指平行六面体之间没有任何空隙,同时,相邻的八个平行六面体均能共顶点相连接。
3、晶胞中微粒个数的计算,其重要问题是正确分析晶胞中任意位置上的一个原子被几个晶胞所共用。如立方晶胞中顶点、棱、面上和体内依次被8、4、2、1个晶胞所共用;而六棱柱晶胞中,顶点、侧棱、底面上的棱、面上,依次被6、3、4、2个晶胞所共用。
【典型例题】
例1. 下列叙述正确的是
A、固态物质一定是晶体
B、晶体一定有固定的熔点
C、晶体内部微粒按一定规律周期性排列
D、凡有规则几何外形的固体一定是晶体
解析:固体分为晶体和非晶体,晶体有自范性、固定的熔点、各向异性,正是由于晶体内部微粒按一定周期性排列的结果,晶体有规则的几何外形,但有规则的几何外形的固体却不一定是晶体。所以本题的答案为BC
答案:BC
例2. 2001年曾报道,硼镁化合物刷新了金属化合物超导温度的最高记录。该化合晶体结构中的晶胞如右图所示。镁原子间形成正六棱柱,六个硼原子位于棱柱内。则该化合物的化学式可表示为
A. Mg14B6 B.
Mg2B C.
MgB2 D.
Mg3B2
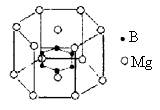
解析:晶胞中微粒个数的计算,其重要问题是正确分析晶胞中任意位置上的一个原子被几个晶胞所共用。六棱柱晶胞中,顶点、侧棱、底面上的棱、面上,依次被6、3、4、2个晶胞所共用,则有:B原子位于内部,B原子个数=6;Mg位于顶点和上下两个面上,则Mg原子个数=12×1/6+2×1/2=3,再根据B原子和Mg原子的个数比可以得出两者的化学式:MgB2。则本题的答案为:C
答案:C
例3. 碘元素有多种价态,可以形成多种含氧阴离子IxOyn-。由2个IO62-正八面体共用一个面形成IxOyn-的化学式为:
A. I2O94- B. I2O106-
C. I2O118- D. I2O1210-
解析:本题主要考查离子组成与空间结构的关系。正八面体是由八个正三角形构成,则IO62-的结构应为:I在正八面体的中心,六个O原子在正八面体的六个顶点上,即由2个IO62-正八面体共用一个面形成的IxOyn-的化学式应该拥有2个I原子和9个O原子。
答案:A
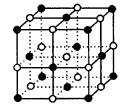
例4. 食盐晶体是由钠离子(图中的“·”)和氯离子(图中的“。”)组成的,且均为等距离的交错排列。已知食盐的密度为
C. 4.0×10-
解析:在立方晶体结构中:顶点同为8个晶胞共有,平均每个晶胞占有1/8;每个面同为2个晶胞共有,平均占有1/2;每条棱同为4个晶胞共有,平均占有1/4;而体心(内部)只为一个晶胞所拥有,平均占有1。食盐晶体属于立方晶体结构,所以食盐的一个晶胞中有:Na+:8×1/8+6×1/2=4;Cl-:12×1/4+1=4。即每个晶胞中含有4个Na+和Cl-,即4个NaCl,晶胞的体积就是4个NaCl的体积。设上述晶胞的边长为:2a cm,其体积为8a3 cm3;又已知:阿伏加德罗常数个氯化钠的体积为:58.5/2.2cm3。则有:
4:
根据晶胞结构图可知,距离最近且相等的钠离子为晶胞的一个面的面心和顶点之间的距离,设为x,则有:
2x2=
答案:C
【模拟试题】(答题时间:40分钟)
1. 下列关于晶体与非晶体的说法正确的是( )
A. 晶体一定比非晶体的熔点高 B. 晶体有自范性但排列无序
C. 非晶体无自范性而且排列无序 D. 固体SiO2一定是晶体
2. 区别晶体与非晶体最可靠的科学方法是:
A. 熔沸点 B. 硬度 C. 颜色 D. x-射线衍射实验
3. 下列过程可以得到晶体的有:
A. 对NaCl饱和溶液降温,所得到的固体
B. 气态H2O冷却为液态,然后再冷却成固态
C. 熔融的KNO3冷却后所得到的固体
D. 将液态的玻璃冷却后所得到的固体
4. 晶体具有各向异性。如蓝晶石(Al2O3·SiO2)在不同方向上的硬度不同;又如石墨在与层垂直的方向上的导电率和与层平行的方向上的导电率之比为1∕104。晶体的各向异性主要表现在( )
①硬度 ②导热性 ③导电性 ④光学性质
A. ①③ B. ②④ C. ①②③ D. ①②③④
5. 最近发现一种由钛(Ti)原子和碳原子构成的气态团簇分子,分子模型如图所示,其中圆圈表示钛原子,黑点表示碳原子,则它的化学式为( )
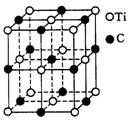
A. TiC B. ![]() C.
C. ![]() D.
D. ![]()
6. 水分子间可通过一种叫“氢键”的作用(介于化学键和分子间作用力之间),彼此结合而形成(H2O)n,在冰中n值为5。即每个水分子都被其他4个水分子包围形成变形四面体,如图所示为(H2O)5单元,由无限个这样的四面体通过氢键相互连接成一个庞大的分子晶体,即冰。下列有关叙述正确的( )
A. 1mol冰中有4mol氢键
B. 1mol冰中有4×5mol氢键
C. 平均每个水分子只有2个氢键
D. 平均每个水分子只有5/4个氢键
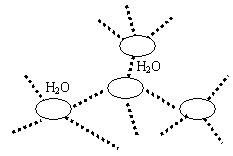
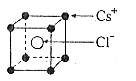
7. 已知CsCl晶体的密度为![]() ,NA为阿伏加德罗常数,相邻的两个
,NA为阿伏加德罗常数,相邻的两个![]() 的核间距为a cm,如图所示,则CsCl的相对分子质量可以表示为( )
的核间距为a cm,如图所示,则CsCl的相对分子质量可以表示为( )
A. ![]() B.
B.
![]()
C. ![]() D.
D.
![]()
8. 第28届国际地质大会提供的资料显示,海底有大量的天然气水合物,可满足人类1000年的能源需求。天然气水合物是一种晶体,晶体中平均每46个水分子构成8个笼,每个笼可容纳1个CH4或1个游离的水分子。若晶体中每8个笼只有6个容纳了CH4分子,另外2个笼被游离的水分子填充,则天然气水合物的平均组成可表示为
A. CH4·14H2O B. CH4·8H2O
C. CH4·23/3H2O D. CH4·6H2O
9. 白磷分子P4(内空的正四面体结构)中P-P键易断裂,若一个白磷分子中每个P-P键均断开插入一个氧原子,则一共可结合 个氧原子,这样就得到一种磷的氧化物,其分子式为 。由C、N、H三种元素组成的某化合物,其分子内含4个N原子,且4个氮原子排成内空的正四面体(同白磷),每两个氮原子间都有一个碳原子,且分子内无C-C和C=C,则该化合物的分子式为 。
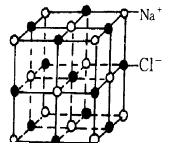
10. 下图为氯化钠晶体结构。
(1)晶体中,每个Na+周围有____个Cl-,每个Cl-周围与它最接近且距离相等的Cl-共有_____个。
(2)NaCl晶体中,与Na+距离等同且最近的几个Cl-所围成的空间构型为___ __(填序号)
A. 正四面体 B. 正六面体 C. 正八面体 D. 正十二面体
11. A、B、C、D、E都是元素周期表中前20号元素,原子序数依次增大,B、C、D同周期,A、D同主族,E和其它元素既不在同周期也不在同主族,B、C、D的最高价氧化物的水化物两两混合均能发生反应生成盐和水。根据以上信息回答下列问题:
(1)A和D氢化物中,沸点较低的是 (选填“A”或“D”);A和B的离子中,半径较小的是 (填离子符号)
(2)元素C在元素周期表中的位置是 。
(3)A和E可组成离子化合物,其晶胞(晶胞是在晶体中具有代表性的最小重复单元)结构如下图所示,阳离子(用“●”表示)位于该正方体的顶点或面心;阴离子(用“○”表示)均位于小正方体中心。该化合物的电子式是 。
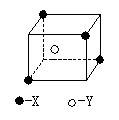
12. 某离子晶体部分结构如图
(1)晶体中每个Y同时吸引着最近的________个X,每个X同时吸引着最近的________个Y,该晶体的化学式为________。
(2)晶体中每个X周围与它最近且距离相等的X共有________个。
(3)晶体中距离最近的2个X与一个Y形成的夹角∠XYX的角度为_______。
(4)设该晶体的摩尔质量为Mg![]()
![]() ,晶体密度为
,晶体密度为![]() ,阿伏加德罗常数为NA,则晶体中两个距离最近的X中心间距离为_____cm。
,阿伏加德罗常数为NA,则晶体中两个距离最近的X中心间距离为_____cm。
![]()
【试题答案】
1. C 2.
D 3.
AC 4.
D 5.
D
6. C 7.
A 8.
B
9. 6 P2O
10. (1)6,12 (2)C
11. (1)D 、Na+
(2)第三周期ⅢA族
(3)CaF2
12. (1)从图中可知,Y位于立方体中心,X位于立方体相向的四个顶点,故一个Y同时吸引着最近的X有4个,每个X同时吸引着最近的8个Y,由此确定其化学式.:XY2。
(2)由于顶点X是8个立方体共有,每个面是两个立方体共有,故晶体中每个X周围与它最近且距离相等的X应有8×3×![]() =12(个)。
=12(个)。
(3)可将图中4个X分别与Y连线,形成的构型类同于CH4分子,∠XYX=109°28’。
(4)略