![]()
【本讲教育信息】
一. 教学内容:
第3节 饮食中的化学(乙醇、乙酸)
教学目的:
1. 认识教材所涉及的乙醇、乙酸等重要有机化合物的组成、主要性质和主要应用。
2. 激发学习有机化学的兴趣,提高科学素养。
二. 教学重点、难点
乙醇、乙酸的性质
知识分析:
(一)乙醇
1. 物理性质
乙醇俗称酒精,从颜色、状态、气味、密度、熔沸点、溶解性等方面上归纳其物理性质:无色、透明、具有特殊香味的液体;比水轻;沸点为
思考:
①为什么酒精灯用完后要盖上灯帽?
②什么是无水酒精?工业如何制取无水酒精?
③如何检验酒精中是否含水?
④举例说明酒的度数表示什么意义?
(解答:①酒精易挥发。②含乙醇99.5%以上的酒精;将工业酒精与生石灰混合,加热蒸馏,可以制得无水酒精。③加入硫酸铜固体,如果变蓝说明有水。④酒中乙醇的体积分数;如:1°表示100ml酒中含有1ml乙醇。)
2. 分子结构
(1)分子式:C2H6O;结构简式:CH3CH2OH。
(2)官能团-羟基
乙醇分子可以看成是乙烷分子中的一个氢原子被羟基原子团取代而形成的。
羟基和氢氧根的区别:
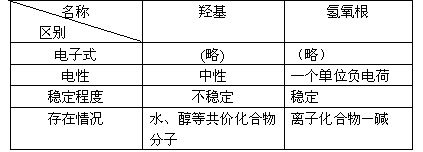
3. 乙醇的化学性质
(1)与钠反应
结合教材实验,分析实验现象,归纳实验结论。反应方程式表示如下:
2CH3CH2OH+2Na→2CH3CH2ONa+H2
特别提示:
①反应机理:在乙醇分子中,由于氧原子的吸电子能力比碳、氢强,使得C-O键、O-H键在一定条件下均有可能断裂。当乙醇与活泼金属反应时,O-H键断裂,氢原子相互结合生成氢气。
②回忆水与钠反应的现象,对比乙醇与钠的反应现象可得如下结论:
水、乙醇、钠的密度大小为:水>钠>乙醇
水分子中的羟基氢与乙醇分子中的羟基氢相比,更活泼的是水。
(2)氧化反应
①燃烧氧化:乙醇在空气中燃烧,火焰为淡蓝色,并放出大量热,且产物对大气无污染,因此乙醇和甲烷一样被人们称为“绿色能源”。燃烧的化学方程式为:
C2H6O+3O2→2CO2+3H2O
②催化氧化:特别注意相关的几个问题
实验名称、实验步骤、实验现象、实验原理(反应方程式):
2CH3CH2OH+O2![]() 2CH3CHO+2H2O
2CH3CHO+2H2O
特别提示:上述反应的过程是(从断键、成键角度考虑)断开羟基中的氢氧键,形成碳氧双键;在上述整个实验中,铜的作用是催化剂;
乙醛:物理性质:无色有刺激性气味的液体,密度比水小,沸点
结构简式:CH3CHO;官能团:-CHO。
③强氧化剂氧化:乙醇具有还原性,可以被三氧化铬或重铬酸钾或高锰酸钾等强氧化剂氧化。
归纳:以乙醇的催化氧化为例,分析:氧化反应去氢或加氧;
还原反应加氢或去氧。
思考:将一束铜丝在酒精灯外焰上烧,现象为铜丝变黑;然后再将该铜丝伸到酒精灯的焰芯中,过一会拿出铜丝,现象是铜丝由黑变红_。发生变化的原因为铜丝在外焰上烧时被氧化为氧化铜,移至焰心时,氧化铜被乙醇蒸气还原为铜。
4. 乙醇的主要用途
(1)燃料:(原因)易燃、放热多。
(2)饮料:(在体内的一系列变化)。
(3)医用:(浓度、作用)75%。
(4)科研:是重要溶剂、试剂和化工原料。
思考:
①各种酒都含有一定量的乙醇,乙醇进入人体后,经过哪些变化?
②为什么说少量饮酒有益身体健康,而长期过量饮酒有害健康呢?
③哪些人不宜饮酒?
(解答:①先氧化为乙醛、乙酸,最终氧化为二氧化碳、和水。②略,见教材。③青少年、司机等)
(二)乙酸
1. 物理性质
乙酸俗名醋酸,是食醋的主要成分(质量分数为3%~5%)。常温下,乙酸是一种无色、有刺激性气味的液体,沸点
乙酸在自然界中分布很广,在动物的组织内、排泄物中、血液中都存在乙酸。此外,许多微生物可以将有机物通过发酵转化为乙酸。
思考:
①生活中我们常用乙酸做什么用?
②实验室中,当我们发现某试剂瓶中的醋酸已凝固成晶体时,如何将其取出?
(解答:①做调味品、除水垢等。②将试剂瓶放入热水,待晶体熔化后倒出。)
2. 分子结构
分子式C2H4O2;结构简式CH3COOH。
官能团是-COOH,叫做羧基,可以看作是由羰基和羟基组成,它决定了乙酸的化学性质。
3. 化学性质
(1)酸性:乙酸具有酸性,在水溶液中部分电离产生H+,是一种弱酸,但酸性强于碳酸,电离方程式可表示为:CH3COOH![]() CH3COO-+H+。具备酸的5条通性:
CH3COO-+H+。具备酸的5条通性:
①与酸碱指示剂作用:可以使紫色石蕊试液变红。
②与活泼金属反应:完成2CH3COOH+Zn=Zn(CH3COO)2+H2。
③与碱中和:完成2CH3COOH+Cu(OH)2=Cu(CH3COO)2+2H2O。
④与碱性氧化物反应,生成盐和水
⑤与盐反应:完成2CH3COOH+Na2CO3=2CH3COONa+CO2+H2O。
CH3COOH+NaHCO3=CH3COONa+CO2+H2O。
(2)酯化反应:乙酸与乙醇的反应
反应的化学方程式:
![]()
该实验应注意的问题:
药品:
①乙酸、乙醇、浓硫酸混和的顺序:先加乙醇,再缓缓加入浓硫酸和乙酸。
②浓硫酸的作用:催化剂、吸水剂。
③饱和碳酸钠溶液的作用:除去乙醇和乙酸,使酯便于析出。
装置:
①盛放反应液的试管要上倾45°角,原因主要是为了增大液体的受热面积。
②导管口不能插入饱和碳酸钠溶液中,原因:防止倒吸。
操作:
①实验开始,用酒精灯小火、均匀的加热,而不能用大火的原因主要是:防止大量的乙醇、乙酸挥发。
②实验结束后,生成的乙酸乙酯主要存在于盛饱和碳酸钠溶液的试管中,此时其中含有少量杂质乙酸、乙醇,因此闻酯的气味前,要振荡试管,解释这样做的原因:使乙酸与碳酸钠充分反应,乙醇充分溶解。
归纳:
酯化反应的定义:酸与醇生成酯和水的反应。
反应实质:“酸脱羟基,醇脱氢”。
反应特点:①反应速度较慢。②该反应为可逆反应。
反应的基本类型:取代反应。
4. 制法和用途
工业制法:
(1)发酵法:
淀粉![]() C6H12O
C6H12O![]() C2H5OH
C2H5OH![]() CH3CHO
CH3CHO![]() CH3COOH
CH3COOH
(2)乙烯氧化法:2CH2=CH2+O2![]() 2CH3CHO
2CH3CHO
2CH3CHO+O2![]() 2CH3COOH
2CH3COOH
此法优点是原料来源丰富。
用途:重要的化工原料。用于生产醋酸纤维、香料、染料、医药和农药等。
【典型例题】
例1. 下列物质不能用于从碘水中提取碘的是( )
A. 乙醇 B. 苯
C. 四氯化碳 D. 汽油(烷烃、环烷烃、芳香烃的混合物)
答案:A
解析:乙醇与水互溶,不能分层,故A不可以;而苯、四氯化碳、汽油都不与水互溶,混和时分层,并且碘在这些有机溶剂中溶解度大于在水中,故常用苯、四氯化碳、汽油等提取碘水中的碘。
点评:萃取要求萃取剂不与原溶液中的溶剂混溶。
例2. 将等质量的铜片在酒精灯上加热后,分别插入下列溶液中,铜片质量增加的是( )
A. 硝酸 B. 稀盐酸 C. Ca(OH)2溶液 D. 乙醇
答案:C
解析:铜片在酒精灯上加热,发生反应:2Cu+O2![]() 2CuO,使铜片质量增加,当遇到硝酸和盐酸后,分别溶解氧化铜,使铜片质量减少;当遇到乙醇时,发生反应:CuO+CH3CH2OH
2CuO,使铜片质量增加,当遇到硝酸和盐酸后,分别溶解氧化铜,使铜片质量减少;当遇到乙醇时,发生反应:CuO+CH3CH2OH![]() Cu+CH3CHO+H2O,CuO被还原为Cu,前后质量不变。当遇到Ca(OH)2溶液时,CuO不反应,所以加热后的铜片比原铜片质量增加。
Cu+CH3CHO+H2O,CuO被还原为Cu,前后质量不变。当遇到Ca(OH)2溶液时,CuO不反应,所以加热后的铜片比原铜片质量增加。
点评:本题考查无机、有机综合知识,重点是乙醇的催化氧化。
例3. 现有一瓶物质,为甲和乙的混合物,已知甲和乙的某些性质如下表。据此,将甲和乙分离的最佳方案是:
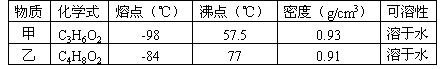
A. 萃取法 B.
升华法 C.
分馏法 D.
分液法
答案:C
解析:从给出的性质分析,其溶解性相似,排除了D选项,没有升华性质,即不可能选B又不知其它的性质,无法选择萃取剂,排除A选项,但其沸点差异较大。
点评:本题重点考查分析能力和应用知识解决问题的能力,解题时要考虑仔细全面,从题给信息直接解答较困难,可采用排除法。
例4. 下列物质中可一次性鉴别乙酸、乙醇、苯及氢氧化钡溶液的是( )
A. 金属钠 B.
溴水 C.
碳酸钠溶液 D.
紫色石蕊试液
答案:CD
解析:一次性鉴别题要求所加试剂分别加入被检对象中所产生的现象要各不相同。鉴别不仅要注意化学变化现象,还要对一些物理变化产生的现象加以注意。如下表所示:

通过比较可知,当加入碳酸钠溶液或紫色石蕊试液时,现象各不相同,符合题意,所以答案为CD。
点评:本题着重考查了乙酸具有酸的通性。
【模拟试题】(答题时间:40分钟)
一. 选择题
1. 用分液漏斗可以分离的一组混合物是( )
A. 碘和乙醇 B. 乙醇和水 C. 苯和水 D. 乙醇和醋酸
2. 某温度下,由乙炔(C2H2)和乙醛(C2H4O)组成的混和气体,经测定其中含碳的质量分数为72%,则混和气体中氧的质量分数为( )
A. 32% B. 22.65% C. 19.56% D. 2.14%
3. 某有机物的蒸气,完全燃烧时需要3倍于其体积的氧气,产生2倍于其体积的二氧化碳,该有机物可能是( )
A. C2H4 B. C2H5OH C. CH3CHO D. CH3COOH
4. 一定量的乙醇在氧气不足的情况下燃烧,得到CO、CO2和水的总质量为27.6g,若其中水的质量为10.8g,则CO的质量为( )
A. 4.4g B. 2.2g C. 1.4g D. 2.2g~4.4g之间
5. 炒菜时,加酒加醋可使菜变得味香可口,原因是( )
A. 有盐类物质生成 B. 有酸类物质生成
C. 有醇类物质生成 D. 有酯类物质生成
6. 可以说明CH3COOH是弱酸的事实是( )
A. CH3COOH与水能以任意比混溶
B. CH3COOH能与Na2CO3溶液反应,产生CO2 气体
C. 1mol/L的CH3COOH溶液的pH值比1mol/L HCl溶液的pH值大
D. 1mol/L的CH3COOH水溶液能使紫色石蕊试液变红
7. 某有机物CnHxOy完全燃烧时需O2 的物质的量是该有机物的n倍,生成CO2和H2O的物质的量之比为1:1 ,该有机物分子中的n、x、y的关系是( )
A. n=2x=y B. n=x/2=y C. n=x=2y D. x=2n=y
8. 当乙酸分子的氧都是18O,乙醇分子中的氧都是16O,二者在一定条件下反应达到平衡时,在平衡混合物中生成的水相对分子质量为( )
A. 16 B. 18 C. 20 D. 22
9. 实验室用乙酸,乙醇,浓H2SO4制取乙酸乙酯,加热蒸馏后,在饱和Na2CO3 溶液的上面得到无色油状液体,当振荡混和时,有气泡产生,原因是( )
A. 产品中有被蒸馏出的H2SO4
B. 有部分未反应的乙醇被蒸馏出来
C. 有部分未反应的乙酸被蒸馏出来
D. 有部分乙醇跟浓H2SO4作用生成乙烯
10. 胆固醇是人体必需的生物活性物质,分子式为C27H46O;一种胆固醇酯是液晶材料,分子式为C34H50O2,合成这种胆固醇酯的酸是( )
A. C6H13COOH B. C6H5COOH
C. C7H15COOH D. C6H5CH2COOH
二. 填空题
11. 乙醇分子中不同的化学键可表示为:
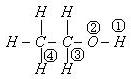
在乙醇和钠反应时,键________断裂;在Cu催化和加热条件下和O2 反应时,键_______断裂。
12. 要除去每组括号中的少量杂质,在横线上写出所用试剂和操作方法:
(1)乙酸乙酯(乙酸)____________________________________;
(2)乙醛(乙酸)________________________________________
13. 酒后驾车的司机,可通过对其呼出的气体进行检验而查出,所利用的化学反应如下:
2CrO3 (红色) +3C2H5OH +3H2SO4=Cr2(SO4)3(绿色) +3CH3CHO +6H2O被检测的气体成份是__________,上述反应的氧化剂是____________,还原剂是______。
三. 计算题
14. 有0.2mol某有机物和0.5mol氧气在一密闭容器中燃烧,所得的产物为CO2、CO、H2O(g),产物依次通过浓硫酸时,浓硫酸增重10.8g;再通过灼热的氧化铜,氧化铜质量减轻了3.2g;又通过碱石灰时,碱石灰的质量增加了17.6g。求有机物的化学式,并写出其的结构简式。
![]()
【试题答案】
一.
1. C 2.
C 3.
AB 4.
C 5.
D 6.
C 7.
B
8C 9.
C 10.
B
二. 11、①;①③
12. (1)饱和碳酸钠溶液;分液。 (2)NaOH溶液;蒸馏。
13. 乙醇;CrO3;乙醇。
三. 14. C2H6O;CH3CH2OH