![]()
【本讲教育信息】
一. 教学内容:
羧酸、酯和油脂的性质
二. 教学过程
(一)羧酸的结构与性质:
羧酸官能团的名称:羧基—COOH;结构式:R—COOH,饱和一元羧酸的分子,通式:![]() 或
或![]() 。
。
受羰基影响,—COOH易电离产生少量的![]() :
:![]()
![]()
![]() ,显弱酸性。同时,-COOH属于强极性基团,易形成氢键,因此,羧酸的熔沸点相对于同碳原子的烃而言,熔沸点高,低碳原子羧酸与水之间形成分子间氢键,使其在水中的溶解度增大。
,显弱酸性。同时,-COOH属于强极性基团,易形成氢键,因此,羧酸的熔沸点相对于同碳原子的烃而言,熔沸点高,低碳原子羧酸与水之间形成分子间氢键,使其在水中的溶解度增大。
羧酸的性质主要由-COOH决定,主要体现为:酸性和与醇等物质发生酯化反应,与—![]() 发生成肽反应等。
发生成肽反应等。
说明:
1、有机酸和无机含氧酸与醇作用发生酯化反应生成酯,而无机无氧酸与醇发生卤代反应生成卤代烃。
2、酯化反应(或成肽反应)中酸脱羟基,醇(胺基)脱氢。可用同位素原子示踪法进行反应机理的测定:用含![]() 的乙醇参与反应,生成的乙酸乙酯(
的乙醇参与反应,生成的乙酸乙酯(![]() )分子中含有
)分子中含有![]() 原子即①式,表明反应物羧酸分子中羧基上的羟基与乙醇分子中羟基中的氢原子结合生成水,其余部分生成酯(即水中的氧原子来自于羧酸)
原子即①式,表明反应物羧酸分子中羧基上的羟基与乙醇分子中羟基中的氢原子结合生成水,其余部分生成酯(即水中的氧原子来自于羧酸)

从而证明。
3、酸和醇之间可发生酯化反应生成酯,二元酸与二元醇之间可以通过酯化反应生成环状化合物,也可以通过酯化反应生成聚酯等有机高分子化合物;同样,同一有机物中若既含有-OH(![]() ),又含有
),又含有![]() ,则也可以发生酯化反应生成环状化合物或聚合物。如:乙二酸和乙二醇酯化生成乙二酸乙二酯、环酯和聚酯等,乳酸脱水生成环酯和聚酯等。
,则也可以发生酯化反应生成环状化合物或聚合物。如:乙二酸和乙二醇酯化生成乙二酸乙二酯、环酯和聚酯等,乳酸脱水生成环酯和聚酯等。
(1)链状小分子酯
![]()
(2)环酯
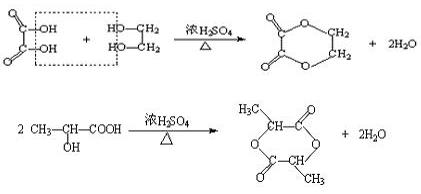
(3)聚酯(羧酸和醇通过缩掉小分子(例如水)形成的高分子化合物)
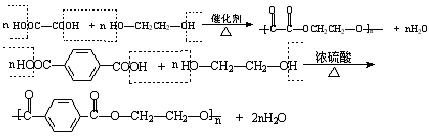
(4)内酯(同一分子中的![]() 和-OH脱水而形成的)
和-OH脱水而形成的)
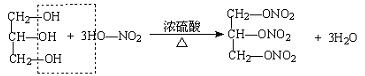
(5)无机酸酯(例如硝酸和甘油反应形成的三硝酸甘油酯又叫硝化甘油)
(6)高级脂肪酸甘油酯(油脂)
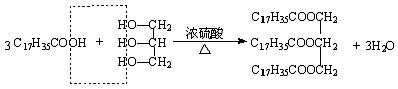
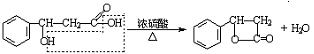
(7)酚酯(苯酚和酸形成的酯)

4、硝基化合物与硝酸酯的区别:硝基化合物是![]() 取代烃分子中的H所生成的一系列有机化合物,形成C—N键,而硝酸酯则是硝酸与醇发生酯化反应所形成的一系列酯类物质,所形成的化学键为:C—O—N键。
取代烃分子中的H所生成的一系列有机化合物,形成C—N键,而硝酸酯则是硝酸与醇发生酯化反应所形成的一系列酯类物质,所形成的化学键为:C—O—N键。
5、甲酸俗称蚁酸,是最简单的饱和一元羧酸,其分子结构为:
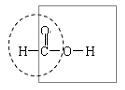
甲酸分子中既含有羧基,又含有醛基,因而甲酸既表现出羧酸的性质,也能表现出醛类物质的性质。如具有酸性,能发生酯化反应还能与新制的银氨溶液和氢氧化铜悬浊液反应。
6、乙酸的制取
发酵法:
丁烷直接氧化法:![]()
(二)酯和油脂:
1、酸与醇作用生成酯,酯的结构为:![]() (R可相同,也可不同),饱和一元羧酸酯与饱和一元羧酸互为同分异构体,通式为
(R可相同,也可不同),饱和一元羧酸酯与饱和一元羧酸互为同分异构体,通式为![]() 。酯类物质都难溶于水,易溶于乙醇、乙醚等有机溶剂,密度一般比水小,含碳原子数较少的低级酯具有特殊香味。高级脂肪酸(含碳原子数较多)与甘油相互作用所生成的酯称为油脂,其中:饱和的高级脂肪酸甘油酯称为脂肪,不饱和的高级脂肪酸甘油酯称为油。
。酯类物质都难溶于水,易溶于乙醇、乙醚等有机溶剂,密度一般比水小,含碳原子数较少的低级酯具有特殊香味。高级脂肪酸(含碳原子数较多)与甘油相互作用所生成的酯称为油脂,其中:饱和的高级脂肪酸甘油酯称为脂肪,不饱和的高级脂肪酸甘油酯称为油。
酯类物质的官能团是酯基:—COO—,具有相似的化学性质的,如在一定的条件下可以水解等。
2、酯类物质易发生水解反应,生成相应的醇和羧酸;
(1)在有酸存在的条件下,酯能发生水解反应生成相应的酸和醇。
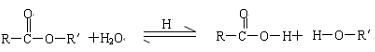
在酸性条件下,酯的水解不完全,在碱性条件下,由于生成的酸可以与碱反应生成盐,降低了生成物的浓度,使平衡正向移动,有利于水解反应进行完全,因此,在碱性条件下水解反应趋于完全:
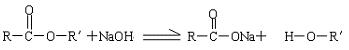
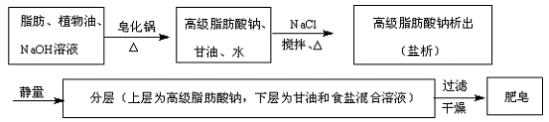
(2)油脂在酸性条件下水解生成高级脂肪酸和甘油,在碱性条件下水解生成高级脂肪酸钠和甘油。
油脂在碱性条件下的水解反应称为皂化反应:由于高级脂肪酸钠的微粒直径较大,达到胶体的微粒大小,在煮沸的条件下加入食盐细粒,可使高级脂肪酸钠析出,这一过程称为盐析。
3、油的氢化(硬化):由不饱和高级脂肪酸和甘油作用生成的油脂,常温下呈液态,称为油,由于其结构中含有不饱和键(C=C),易被空气中的![]() 所氧化,不易保存和运输。工业上常通过与
所氧化,不易保存和运输。工业上常通过与![]() 的加成反应来制得硬化油,便于贮藏和运输。
的加成反应来制得硬化油,便于贮藏和运输。
说明:
1、酯化反应和酯的水解反应是一对可逆反应,浓硫酸作催化剂时有利于酯化的进行,而在碱性条件下,由于碱中和了产物酸,从而降低了生成物的浓度,使平衡正向移动,所以在碱性条件下酯的水解反应可以进行完全。
2、含有相同碳原子数的饱和一元羧酸和酯互为同分异构体。下面,我们一起来分析![]() 的同分异构体的书写:
的同分异构体的书写:
3、酯在一定条件下还可以与醇发生醇解反应:
![]()
【典型例题】
例1、甲酸的下列性质中,可以证明它是弱电解质的是( )
A、1mol/L甲酸溶液的pH值约为2
B、甲酸能与水以任何比例互溶
C、10mL 1mol/L甲酸恰好与10mL 1mol/L NaOH溶液完全反应
D、在相同条件下,甲酸溶液的导电性比强酸溶液弱
解析:弱电解质在水溶液中不能完全电离,因此1mol/L甲酸溶液的pH值大于0,相同条件下(温度、浓度相同时)甲酸溶液电离产生的离子总数小于强酸电离产生的离子总数,导电能力弱,故A、D可以证明甲酸属于弱酸。而B是由于甲酸可以与水形成氢键,使其在水中的溶解度增大,而C属于酸碱中和反应,是酸、碱等物质的量中和,与酸、碱的相对强弱无关。
答案:AD
例2、已知丁基共有4种,不必试写,立即可推断分子式![]() 的羧酸的同分异构体的数目是( )
的羧酸的同分异构体的数目是( )
A、3种 B、4种 C、5种 D、6种
解析:根据羧酸的结构特点,-COOH只能在末位,则分子式![]() 属于羧酸的结构可写成:
属于羧酸的结构可写成:![]() ,即其同分异构体就是
,即其同分异构体就是![]() 的同分异构体,而
的同分异构体,而![]() 的同分异构体有4种,则
的同分异构体有4种,则![]() 的羧酸的同分异构体也是4种。
的羧酸的同分异构体也是4种。
答案:B
例3、某有机物的结构简式为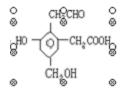 ,取Na、NaOH、新制
,取Na、NaOH、新制![]() 分别与等物质的量的该物质恰好反应(反应时可加热煮沸),则Na、NaOH、新制
分别与等物质的量的该物质恰好反应(反应时可加热煮沸),则Na、NaOH、新制![]() 三种物质的物质的量之比为( )
三种物质的物质的量之比为( )
A、6:4:5 B、1:1:
解析:本题考查的是醇羟基、酚羟基和羧酸羟基的性质比较。该物质中有醇羟基、酚羟基和羧酸羟基各1个,分别可以与3mol金属钠、2mol氢氧化钠反应,而该物质结构中还存在1个-CHO,可还原2mol的新制的![]() 悬浊液。故等物质的量的该物质所消耗的Na、NaOH、新制
悬浊液。故等物质的量的该物质所消耗的Na、NaOH、新制![]() 三种物质的物质的量之比为:3:2:2。
三种物质的物质的量之比为:3:2:2。
答案:C
例4、有机物A是一种含溴的酯,分子式为![]() 。已知A有如下的转化关系:
。已知A有如下的转化关系:
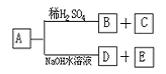
其中B、C含相同数目的碳原子,B既能使溴水褪色,又能与![]() 溶液反应放出
溶液反应放出![]() 气体,C进行氧化反应后,不可发生消去反应,经测定E是一种二元醇。
气体,C进行氧化反应后,不可发生消去反应,经测定E是一种二元醇。
(1)写出A、B、C、D的结构简式:
A___________________;B___________________;
C___________________;D___________________。
(2)写出A在NaOH水溶液中水解的化学方程式:
_________________________________________________________。
解析:B、C含相同数目的碳原子,说明B、C中各有三个碳原子,再由B既能使溴水褪色,又能与![]() 溶液反应放出
溶液反应放出![]() 气体,说明B中含有双键和羧基,则推出B为丙烯酸。C则为含溴原子的饱和一元醇,C进行氧化反应后,不可发生消去反应,说明羟基在中间的碳原子上,溴原子在边碳原子上,从而推出C的结构。
气体,说明B中含有双键和羧基,则推出B为丙烯酸。C则为含溴原子的饱和一元醇,C进行氧化反应后,不可发生消去反应,说明羟基在中间的碳原子上,溴原子在边碳原子上,从而推出C的结构。
答案:
例5、乙酸跟乙醇在浓硫酸存在并加热的条件下发生的酯化反应(反应A),其逆反应是水解反应(反应B)。反应可能经历了生成中间体(I)这一步。
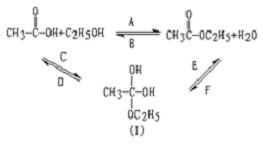
(1)如果将反应按加成、消去、取代反应分类,则A—F个反应中(将字母代号填入下列空格中),属于取代反应的是________;属于加成反应的是________;属于消去反应的是________。
(2)如果使原料![]() ,用
,用![]() 标记,则生成物乙酸乙酯中是否有
标记,则生成物乙酸乙酯中是否有![]() ?如果使原料
?如果使原料![]() 的羰基
的羰基![]() 或羟基中的氧原子用
或羟基中的氧原子用![]() 标记,则生成物H2O中氧原子是否有
标记,则生成物H2O中氧原子是否有![]() ?试简述你判断的理由。
?试简述你判断的理由。
答:____________________________________________________________。
(3)在画有圈号的3个碳原子中,哪一个(或哪些)碳原子的立体构型更接近甲烷分子中的碳原子?试述其理由。
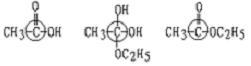
答:____________________________________________________________。
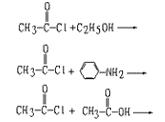
(4)请模仿上题,写出下列3个反应的产物(不必写中间体),反应是不可逆的。
解析:(1)根据取代反应的概念可得A、B发生的是取代反应;再根据加成反应和消去反应的原理可知:C、F属于加成反应,D、E属于消去反应。
(2)因为反应中间体在消去一分子H2O时,有两种可能,而乙氧基(![]() )是保留的。故都有
)是保留的。故都有![]() 标志。
标志。
(3)CH4中的C是四面体构型,即C原子上连有四个原子(原子团),则只有中间体连有4个原子团。
(4)它们所发生的反应均为取代反应,分别为R—CO—取代醇、苯胺和羧酸中—COOH上的氢,产物分别为:
![]() ;
;
![]()
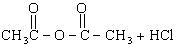
答案:(1)A、B;C、F;D、E
(2)都有![]() 标记。因为反应中间体在消去一分子
标记。因为反应中间体在消去一分子![]() 时,有两种可能,而乙氧基(
时,有两种可能,而乙氧基(![]() )是保留的。
)是保留的。
(3)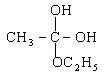 (或答中间体),因为这个碳原子上有4个原子团。
(或答中间体),因为这个碳原子上有4个原子团。
(4)![]() ;
;
![]()
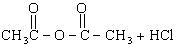
例6、根据图示回答下列问题:
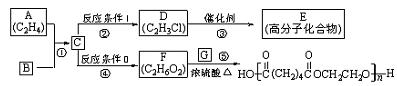
(1)写出A、E、G的结构简式:A_____________,E_____________,G_____________。
(2)反应②的化学方程式(包括反应条件)是__________________________,反应④化学方程式(包括反应条件)是_______________________________________;
(3)写出①、⑤的反应类型:①_____________、⑤_____________。
解析:根据A、D、F之间的关系,可知:A与![]() 发生加成反应,生成1,2—二氯乙烷(C),C在NaOH的醇溶液作用下发生消去反应生成氯乙烯,氯乙烯发生加聚反应生成高分子化合物E;C在NaOH的水溶液作用下发生的水解(取代)反应生成二元醇(乙二醇)。再根据高分子化合物,可知是由乙二醇与己二酸
发生加成反应,生成1,2—二氯乙烷(C),C在NaOH的醇溶液作用下发生消去反应生成氯乙烯,氯乙烯发生加聚反应生成高分子化合物E;C在NaOH的水溶液作用下发生的水解(取代)反应生成二元醇(乙二醇)。再根据高分子化合物,可知是由乙二醇与己二酸![]() 发生缩聚反应得到的。故本题的答案为:
发生缩聚反应得到的。故本题的答案为:
(1)![]() ,
,![]()
(2)![]()
![]() 。
。
(3)①加成反应;⑤缩聚反应。
【模拟试题】(答题时间:60分钟)
1、在H2O、![]() 、
、![]() 、CH3COOH、HCl的排列中,
、CH3COOH、HCl的排列中,![]() 内应填入的物质是( )
内应填入的物质是( )
A、H2SO4 B、CH3CH2OH C、H2CO3 D、CH3COOCH3
2、在一定条件下,下列物质既能发生取代反应、氧化反应,又能发生酯化反应和消去反应的是( )
A、CH3CH2OH B、CH3OH C、CH3CHO D、CH3COOH
3、关于酯的组成,下列叙述错误的是( )
A、酯的一般通式![]() 可以相同,也可以不同。
可以相同,也可以不同。
B、![]() 可以是脂肪烃基,也可以是芳香烃基。
可以是脂肪烃基,也可以是芳香烃基。
C、![]() 中,当
中,当![]() 在均为-CH3时,这种酯叫甲酸甲酯。
在均为-CH3时,这种酯叫甲酸甲酯。
D、碳原子数相同的饱和一元羧酸和饱和一元酯互为同分异构体。
4、分子式为C8H16O2的有机物A,它能在酸性条件下水解生成B和C,且B在一定条件下能转化成C。则有机物A的可能结构有( )
A、1种 B、2种 C、3种 D、4种
5、用括号内试剂除去下列各物质中的少量杂质,正确的是:
A、溴苯中的溴(KI溶液) B、溴乙烷中的乙醇(水)
C 、乙酸乙酯中的乙酸(饱和Na2CO3溶液) D、苯中的甲苯(Br2水)
6、乙酰水杨酸(阿司匹林)是一种常见的解热、消炎、镇痛药物,它是一种有机弱酸,其结构简式为:![]() ,易溶于水,能和碱反应。当1mol阿司匹林和足量氢氧化钠溶液反应时最多需氢氧化钠( )
,易溶于水,能和碱反应。当1mol阿司匹林和足量氢氧化钠溶液反应时最多需氢氧化钠( )
A、2mol B、3mol
C、4mol D、5mol
7、某有机物X能发生水解反应,水解产物为Y和Z。同温同压下,相同质量的Y和Z的蒸气所占体积相同,化合物X可能是:
A、乙酸丙酯 B、甲酸乙酯 C、乙酸甲酯 D、乙酸乙酯
8、绿色化学提倡化工生产应提高原子利用率。原子利用率表示目标产物的质量与生成物总质量之比。在下列制备环氧乙烷的反应中,原子利用率最高的是:
A、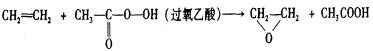
B、![]()
C、![]()
D、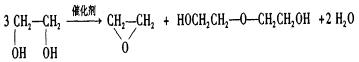
9、营养学研究发现,大脑的生长发育与不饱和脂肪酸密切相关,深海鱼油中提取的“DHA”就是一种不饱和程度很高的脂肪酸,被称为“脑黄金”,它的分子中含有6个碳碳双键,学名为二十六碳六烯酸,它的化学式应是( )
A、C25H50COOH B、C26H41COOH
C、C25H39COOH D、C26H47COOH
10、最近,传媒连续在头版显著版面作了关于“900吨致癌大米”的报道,其中部分已经检验证实含致癌物黄曲霉素:AFTB,其分子式如下,它是污染食物的真菌霉素,人体的特殊基因在黄曲霉素的作用下会发生突变,有转变成肝癌的可能性,跟1mol该化合物起反应的H2或NaOH的最大值分别是( )
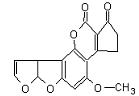
A、6mol,2mol B、7mol,2mol
C、6mol,1mol D.7mol,1mol
11、可以判断油脂皂化反应基本完成的现象是( )
A、反应液使红色石蕊试纸变蓝色 B、反应液使蓝色石蕊试纸变红色
C、反应后静置,反应液分为两层 D、反应后静置,反应液不分层
12、A、B、C、D都是含碳、氢、氧的单官能团化合物,A水解得B和C,B氧化可以得到C或D,D氧化也得到C。若M(X)表示X的摩尔质量,则下式中正确的是( )
A、M(A)=M(B)+M(C) B、2M(D)=
M(B)+M(C)
C、M(B)<
M( D)<M(C) D、M(D)<M(B)<M(C)
13、有机物A是一种含溴的酯,分子式为C6H9O2Br。已知A有如下的转化关系:
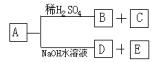
其中B、C含相同数目的碳原子,B既能使溴水褪色,又能与Na2CO3溶液反应放出CO2气体,C进行氧化反应后,不可发生消去反应,经测定E是一种二元醇。
(1)写出A、B、C、D的结构简式:
A
;B ;
C
;D
。
(2)写出A在NaOH水溶液中水解的化学方程式:
。
14、如图在试管甲中先加入2mL 95%的乙醇,并在摇动下缓缓加入2mL浓硫酸,充分摇匀,冷却后再加入2g无水乙酸钠,用玻璃棒充分搅拌后将试管固定在铁架台上。在试管乙中加入5mL饱和碳酸钠溶液。按下图连接装置,用酒精灯对试管甲加热,当观察到试管乙中有明显现象时停止实验
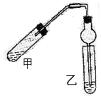
(1)试管乙中观察到的现象是
;
(2)加入浓硫酸的目的是
。
(3)该实验装置中使用球形管除起冷凝作用外,另一重要作用是
。
(4)试管乙中饱和碳酸钠的作用是
。
15、某有机物A(C4H6O5)广泛存在于许多水果内,尤以苹果、葡萄、西瓜、山楂内为多。该化合物具有如下性质:
① 在25℃时,电离常数K1=3.99×10-4,K2=5.5×10-6
②A+RCOOH(或ROH)![]() 有香味的产物。
有香味的产物。
③1molA![]() 慢慢产生l.5mol气体。
慢慢产生l.5mol气体。
④A在一定温度下的脱水产物(不是环状化合物)可和溴水发生加成反应。
试回答:(l)根据以上信息,对A的结构可作出的判断是
(多选扣分)
(a)肯定有碳碳双键 (b)有两个羧基
(c)肯定有羟基 (d)有-COOR官能团
(2)有机物A的结构简式(不含-CH3)为:
。
(3)A在一定温度下的脱水产物和溴水反应的化学方程式:
。
(4)A的一个同类别的同分异构体是;
。
16、通过粮食发酵可获得某含氧有机化合物X,其相对分子质量为46,其中碳的质量分数为52.2%,氢的质量分数为13.0%。
(1)X的分子式是________________;
(2)X与金属钠反应放出氢气,反应的化学方程式是____________________________(有机物用结构简式表达);
(3)X与空气中的氧气在铜或银催化下反应生成Y,Y的结构简式是______________;
(4)X与高锰酸钾酸性溶液反应可生成Z。在加热和浓硫酸作用下,X与Z反应可生成一种有香味的物质W,若184
g X和120 g Z反应能生成106 g W,计算该反应的产率。(要求写出计算过程)
17、以石油裂解气为原料,通过一系列化学反应可得到重要的化工产品增塑剂G。
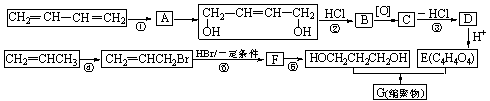
请完成下列各题:
(1)写出反应类型:反应①
反应④
。
(2)写出反应条件:反应③
反应⑥
。
(3)反应②③的目的是:
。
(4)写出反应⑤的化学方程式:
。
(5)B被氧化成C的过程中会有中间产物生成,该中间产物可能是__________________(写出一种物质的结构简式),检验该物质存在的试剂是
。
(6)写出G的结构简式
。
18、参考下列(a)—(c)项的叙述并回答有关问题。
(a)皂化值是使1g油脂皂化所需要的氢氧化钾的毫克数。
(b)碘值是使100g油脂加成碘的克数。
(c)各种油脂的皂化值、碘值列表如下:
(假设下述油脂皆为(RCOO)3C3H5型的单甘油酯)
|
|
花生 油 |
亚麻 仁油 |
牛 油 |
黄 油 |
硬
化 大豆油 |
大豆 油 |
|
皂化值 |
190 |
180 |
195 |
226 |
193 |
193 |
|
碘值 |
90 |
182 |
38 |
38 |
5 |
126 |
(1)主要成分皆为(C17H33COO)3C3H5(相对分子质量884)形成的油,其皂化值是
。
(2)硬化大豆油的碘值小的原因是
。
(3)碘值为180的鱼油100g硬化所需要吸收的氢气在标准状况下的体积至少是
。
(4)比较油脂的皂化值大小,可推知油脂
。
![]()
【试题答案】
1、C 2、A 3、C 4、B 5、BC 6、B
7、AB 8、C 9、C 10、A 11、D 12、D
13、(1)A:![]()
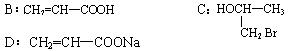
![]() 14、(1)液体分层;
14、(1)液体分层;
(2)制乙酸,作催化剂和吸水剂;
(3)防止液体倒吸;(4)中和乙酸,溶解乙醇,降低乙酸乙酯的溶解度,有利于液体分层。
15、(1)b、c;
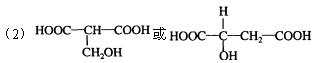
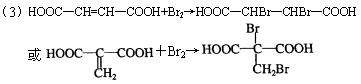
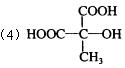
16、(1)C2H6O
(2)2CH3CH2OH+2Na![]() 2CH3CH2ONa+H2↑
2CH3CH2ONa+H2↑
(3)CH3CHO。
(4)生成的有香味的W就为酯,即:Z为CH3COOH,W为CH3COOC2H5,所以有下列反应。用十字交叉法可确定CH3CH2OH过量。设该反应的产率为α,所以有:
CH3CH2OH+CH3COOH![]() CH3COOC2H5+H2O
CH3COOC2H5+H2O
![]() =
=![]() 解得α= 60.2%
解得α= 60.2%
17、(1)加成反应;取代反应。
(2)NaOH/醇溶液(或KOH醇溶液); NaOH/水溶液。
(3)防止双键被氧化(合理即给分)。
(4)CH2=CHCH2Br+HBr![]() CH2Br—CH2—CH2Br。
CH2Br—CH2—CH2Br。
(5)![]() 或
或![]() 或
或![]() (合理即给分); 新制Cu(OH)2悬浊液。
(合理即给分); 新制Cu(OH)2悬浊液。
![]()
18、(1)190;(2)分子中所含碳碳双键较少;(3)15.9L;(4)相对分子质量大小。