![]()
【本讲教育信息】
一、教学内容
中考第一轮复习——第三单元 溶液
二、学习目标
1、理解溶液、溶质、溶剂的概念,并能判断溶质和溶剂(重点);认识溶液的基本性质——均一性和稳定性(难点)。能初步区分溶液、乳浊液和其它分散体系。
2、理解物质的溶解过程和溶解的实质(难点)。初步了解食盐等物质在水中的电离。
3、了解物质溶解过程的能量变化,以及能量发生的原因(重点、难点)。
4、了解乳化作用及洗发液的去污原理。了解水溶液的一些重要性质(重点)。
5、学会定量表示溶液组成的一种常用方法——溶质的质量分数;学会有关溶质的质量分数的基本计算方法;掌握在实验室中配制一定溶质质量分数的溶液的方法。(重点)
三、全面突破
知识专题(一):物质在水中的溶解
(一)溶解的过程
1、溶液
(1)形成:一种或几种物质分散到另一种物质中形成的。
(2)特征:均一性、稳定性
(3)组成:溶质(可以有多种)和溶剂(只有一种)
(4)溶质、溶剂的确定:固液混合, 为质;气液混合, 为质;
液液混合, 为质;若有水在, 为剂;混合有变, 为质。
(5)溶液的质量、体积
溶液的质量 溶质质量+溶剂质量,或溶液的质量=溶液的体积×溶液的密度
溶液的体积 溶质体积+溶剂体积
(6)溶液的分类:
①按含溶质多少分类:浓溶液和稀溶液
②根据一定条件下,溶质是否能够继续溶解分为:饱和溶液和不饱和溶液
③根据溶液的酸碱性分为:酸性溶液、中性溶液、碱性溶液
2、电离
(1)定义:物质溶解在水中时产生自由移动的离子的过程,叫做电离。
(2)酸、碱、盐在溶解于水时都能电离出自由移动的离子。
如HCl==H+ + Cl- NaOH==Na+ + OH- Na2CO3==2Na+
+ CO32-
(3)酸、碱、盐之间发生的复分解反应,其实质是离子之间的互换反应。
3、溶解过程的分析及溶解时温度的变化

溶解过程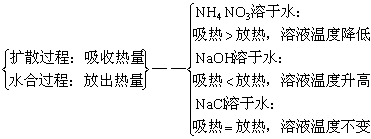
小结:物质溶解时通常伴随着能量的变化。
4、溶液、悬浊液、乳浊液的比较
|
|
溶 液 |
悬浊液 |
乳浊液 |
|
形 成 |
溶于水的物质分 散于水中 |
不溶于水的固体小颗 粒悬浮于水中 |
不溶于水的小液滴分散到水中 |
|
分散微粒及直径大小 |
分子、离子,直 径小于10- |
巨大数目的分子集合体,直径大于10- |
巨大数目的分子集合体,直径大于10- |
|
特 征 |
均一、稳定 |
不均一、不稳定,长期放置固体小颗粒下沉 |
不均一、不稳定,长期放置小液滴易上浮分层 |
|
实 例 |
氯化钠溶液 |
黄泥水 |
油水 |

5、乳化作用
乳化作用:洗涤剂等使植物油等物质以细小的液滴比较均匀地分散于水中,形成乳浊液的现象。
注意:乳化和溶解的原理不同,溶解是溶质在溶剂中以分子或离子形式存在,而乳化则是被分散的物质以小液滴的形式存在,两种现象物质粒子存在的形式不同。
(二)水溶液的某些性质
水中溶解其他物质形成溶液后,某些性质会发生改变:
1、某些物质溶于水,形成的水溶液的凝固点会降低。
2、某些物质溶于水,形成的水溶液的沸点会升高。
3、某些物质的水溶液具有良好的导电性,例如氯化钠等物质的水溶液能导电。
思考:食盐溶液导电的原因:
食盐固体不导电的原因:
蔗糖溶液不导电的原因:
小结:溶液导电或不导电的原因:溶液中是否存在自由移动的离子。
【典型例题】
例1、下列各组物质不能形成溶液的是
( )
A. 蔗糖和水 B. 植物油和汽油 C. 碘和酒精 D. 植物油和水
解析:溶液是均一、稳定的混合物。蔗糖溶于水能形成溶液;植物油不溶于水,当分散于水中时会形成乳浊液,但植物油能溶于汽油形成溶液;碘能溶于酒精形成溶液。
答案:D
例2、日常生活中去除油污的方法很多,下列现象不属于乳化的是( )
A. 修车工用汽油洗去手上的油污 B. 洗发精洗去头发上的油脂
C. 洗面奶洗去皮肤上的油脂 D. 洗洁精洗去餐具上的油污
解析:汽油能洗去油污属于溶解,溶解和乳化的根本区别在于分散颗粒的大小不同,溶解是以分子或离子形式分散,而乳化是以小液滴即巨大分子的集合体形式分散。
答案:A
例3、下列有关溶液性质的说法中错误的是
( )
A. 煮沸的咸汤比煮沸的水温度高
B. 溶液一定是无色透明的
C. 食盐水能导电是因为食盐水中含有较多自由移动的离子
D. 消除路面上的积雪可以撒些盐,使冰雪较快融化
解析:该题考查水溶液的某些性质。水中溶解其他物质形成溶液后,某些性质会发生改变,如某些物质溶于水,形成的水溶液的凝固点会降低,沸点会升高。某些物质的水溶液具有良好的导电性。溶液不一定是无色透明的,如硫酸铜溶液是蓝色的。
答案:B
例4、为了探究物质在溶解于水时溶液温度的变化,两同学分别设计了如下装置,小白的方案为甲装置,其过程为:先在广口瓶中加入氢氧化钠,塞进橡皮塞,把导管插入烧杯中的水面以下,把分液漏斗中的水放入广口瓶内,小白认为通过观察烧杯中的导气管是否有气泡冒出,或在导管内是否形成一段水柱,就可判断氢氧化钠溶解于水时是吸热还是放热。小兰的方案为乙装置,其过程为:向烧杯内的水中加入氢氧化钠固体,观察另一烧杯中的导管口是否有气泡冒出,就可判断氢氧化钠溶解于水时是吸热还是放热。
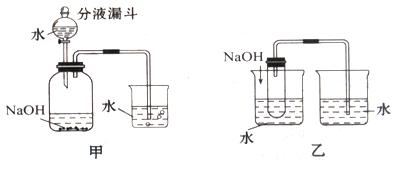
思考:
(1)你认为这两个同学的设计合理的是 ,原因是
。
(2)用正确装置实验时:
如把氢氧化钠固体换成硝酸铵,产生的现象是
。
如把氢氧化钠固体换成氯化钠,产生的现象是
。
如把氢氧化钠固体换成氧化钙,产生的现象是
;与氢氧化钠溶于水的现象 (填“相同”或“不相同”),原理
(填“相同”或“不相同”)。如何解释?
解析:该题重在考查物质在溶解于水时溶液温度的变化,以及对实验装置设计的评价,有一定的综合性和难度。(1)小兰同学的设计合理,对甲装置,当把分液漏斗中的水放入广口瓶内,即使氢氧化钠溶于水不会放出热量,随着加入的水量的增加,也会将瓶内的部分空气排出而导致导气管有气泡冒出,因此会造成对氢氧化钠溶解于水是吸热还是放出热量的错误判断。(2)硝酸铵溶于水会吸收热量,导致溶液的温度降低,因此如把氢氧化钠固体换成硝酸铵,则产生的现象是导管内会形成一段水柱;若换成氯化钠,由于氯化钠溶于水温度基本不变,所以导管口无明显现象发生;若换成氧化钙,由于氧化钙与水反应会放出热量,因此导管口会有气泡产生,与氢氧化钠溶于水的现象相同,但原理不同。
答案:(1)小兰(或乙装置),对甲装置,当把分液漏斗中的水放入广口瓶内,随着加入的水量的增加,导气管有气泡冒出,因此会造成对氢氧化钠溶解于水时是吸热还是放热的错误判断。(2)导管内会形成一段水柱;导管口无明显现象发生;导管口会有气泡产生;相同,不相同。氧化钙与水发生化学反应会放出大量的热,使导管口有气泡产生。
知识专题(二):溶液组成的定量表示
(一)溶液组成的表示方法
1、溶液中溶质的体积分数
如:75%的消毒酒精。
2、溶液中溶质的质量分数
(1)定义:
(2)涵义:
(3)公式:
![]()
溶液的质量、体积、密度之间的关系:溶液的质量=溶液的体积×溶液的密度(m=Vρ)
![]() (4)应用——有关计算
(4)应用——有关计算
①溶质、溶剂及溶液质量之间的换算(直接用公式)
②溶液去水浓缩或加水稀释的计算(把握一点:浓缩或稀释前后溶质的质量不变)
③不同质量分数的同种溶质的溶液相混合的计算(两溶液中溶质的质量和等于混合后溶液中溶质的总质量)
④涉及到溶液的体积和密度的计算(先由体积换算成质量,再利用公式计算)
⑤溶质的质量分数与化学方程式的综合计算
(二)溶液的配制
1、配制溶液的步骤:
①计算 ②称量(或量取) ③溶解(或稀释) ④装瓶存放(贴标签)
2、主要仪器:
3、误差分析:
【典型例题】
例5、对质量分数为“20%的KNO
A.
B.
C.
D. 将KNO3与水按1:5的质量比配成的溶液
解析:根据溶质的质量分数的定义可知:20%的KNO3溶液的涵义就是,每100份质量的KNO3溶液中含有20份质量的KNO3,80份质量的水。
答案:BC
例6、
(1)蒸发
(2)加入10gNaCl后,溶质的质量分数为
。
(3)增加10gNaCl和
(4)加入
解析:(1)
(2)(
(3)(
(4)
答案:(1)5.6% (2)13.6%
(3)12.5% (4)10%
例7、将
A. 蒸发掉
C. 加入
解析:增大溶质质量分数的方法有
(1)加入溶质:
设需加入硝酸钠固体质量为x
![]()
![]()
(2)蒸发水:
设需蒸发水的质量为y
![]()
![]() 克
克
答案:AC
例8、鸡蛋壳的主要成分是碳酸钙。某兴趣小组为了测定鸡蛋壳中CaCO3的含量,现取
(1)产生CO2的质量为__________ g;
(2)该鸡蛋壳中CaCO3的质量分数。
(3)所用稀盐酸中溶质的质量分数。
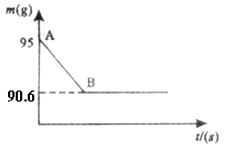
解析:⑴
⑵设鸡蛋壳中CaCO3的质量为x,设参加反应的HCl质量为y
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 73
44
x y
![]()
![]()
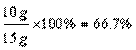
(3)![]() ≈18.3%
≈18.3%
答案:(1)4.4 (2)66.7% (3)18.3%
四、考场清单
本单元知识的考查从命题内容上主要表现在以下几个方面:1、结合实际生活或所学具体实例考查对溶液、溶剂、溶质、乳化作用的理解。2、借助生活实际问题,考查溶液配制过程、操作及有关问题。3、单纯考查溶质质量分数计算的题型较少,往往结合化学反应,考查反应前后溶液中溶质的质量分数。
基本题型:选择、填空、实验探究、计算等。
基本考点:
1、溶液、溶质、溶剂、乳化作用的理解及判断
2、溶液、悬浊液、乳浊液等分散体系的区分
3、食盐等物质的电离,物质溶解过程、溶解的实质及其能量的变化
4、水溶液的某些性质及其实际应用
5、溶质质量分数的含义及其相关计算
6、溶液的配制
五、本讲小结
知识结构:
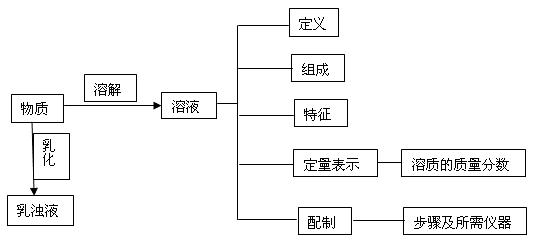
复习指导:
1、复习溶解与乳化作用时,必须抓住关键词“分散”,可运用图片或动画等方式展现分散体系颗粒的大小与分散的结果,通过分析实例,来理解溶液、乳浊液,从而弄清溶解作用与乳化作用的区别。
2、关于溶液的配制,要明确配制的步骤及各仪器的作用,通过实验原理弄清错误操作所导致的可能后果。
3、复习溶质质量分数的计算,要熟记计算公式,明确计算类型,解答综合计算题时,要认真审题,分析题意,理解题中变化的过程,找出已知量和未知量的关系,形成解题的步骤、方法。要善于总结各类综合计算题的解题规律,培养自己灵活应用知识的解题能力。
【模拟试题】(答题时间:35分钟)
一、选择题
1、小明在做家庭小实验时,把下列物质分别放入适量水中并充分搅拌,其中不能得到溶液的是
( )
A. 面粉
B. 纯碱 C. 食盐 D. 白酒
2、下列关于溶液的说法:①无色;②混合物;③化合物;④均一;⑤稳定;⑥各部分性质相同,其中正确的是
( )
A. ①③④⑤
B. ②④⑤⑥
C. ①②④⑤
D. ①③⑤⑥
3、下列有关洗涤问题的说法不正确的是
( )
A. 洗洁精可使餐具上的油污乳化 B. 汽油可溶解衣服上的油渍
C. 酒精能洗去瓷砖上的水锈 D. 加酶洗衣粉中的酶有助于洗去衣服上的血渍
4、如图所示,向小试管中分别加入下列一定量的物质,右侧U型管中的液面a高于b,该物质是
( )
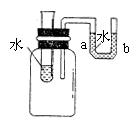
A. 氢氧化钠固体 B. 生石灰 C. 硝酸铵晶体 D. 氯化钠晶体
5、现有100mL 20%的硫酸溶液,其密度为
A.
该溶液含溶质
B.
该溶液中,溶质质量:溶液质量=1:6
C.
该溶液中,溶质质量:溶剂质量=1:5
D.
该溶液中,溶液质量:溶剂质量=5:4
6、制作“叶脉书签”需要配制
A. 称量前调节天平平衡时发现指针向右偏转,可调节游码
B. 在左右托盘上垫滤纸称取12.0gNaOH固体
C. 将准确称取的NaOH固体直接倒入装有水的量筒中溶解
D. 选用100mL量筒量取88.0mL的水
7、在寒冷(-
A. ①② B. ②④ C. ①②③ D. ①②③④
8、配制
A. 托盘天平
B. 量筒 C. 烧杯 D. 漏斗
9、要配制
A. 将
B. 量取90mL水时,俯视读数
C. 为加快固体溶解,用温度计搅拌溶液
D. 将配好的溶液倒入细口瓶中,盖紧瓶塞,并贴上标签
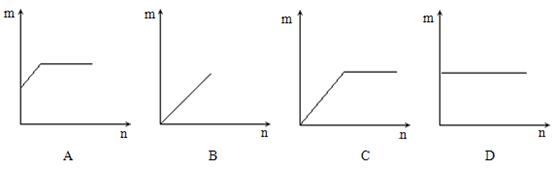
10、在一定温度下,在一定量的氯化钠不饱和溶液中不断加入氯化钠固体,并搅拌,在此过程中,加入的氯化钠质量(n)和溶液的质量分数(m)的关系变化为 ( )
11、回答下列问题:
(1)实验室配制
①称量时如果用质量为
②下列仪器中,量取水时需要用
到d和 仪器(填序号),溶解时需要用到e和 仪器(填序号)。
a. 烧杯、b. 10mL量筒、c. 100mL量筒、d. 滴管、e. 玻璃棒、f. 药匙、g. 蒸发皿。
(2)在粗盐提纯中,将氯化钠溶液蒸发至有较多量固体析出后,应
,并用玻璃棒不断搅拌,利用余热将余下溶液蒸发至干。
*12、实验室要配制
|
|
配制方案(只要说明配制时所需的各种药品及用量即可) |
|
方案一 |
|
|
方案二 |
|
|
方案三 |
|
13、下图是配制
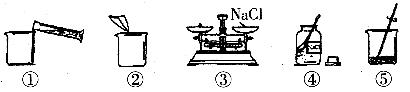
请回答下列问题:
(1)该实验的正确操作顺序为________(填序号);
(2)称取
14、![]() 溶液中溶质的质量分数?
溶液中溶质的质量分数?
*15、制铅蓄电池时往往要用到稀硫酸,现要配制500mL 20%(密度为
*16、将150mL稀盐酸(密度为
计算:(1)反应生成二氧化碳的质量;
(2)石灰石中含碳酸钙的质量分数;
(3)生成物溶液中溶质的质量分数。
![]()
【试题答案】
一、选择题:
|
题号 |
1 |
2 |
3 |
4 |
5 |
|
答案 |
A |
B |
C |
C |
D |
|
题号 |
6 |
7 |
8 |
9 |
10 |
|
答案 |
D |
A |
D |
D |
A |
11、(1)10 ① B ② c a (2)停止加热(或熄灭酒精灯)
12、
|
|
|
|
方案一 |
硝酸钾固体: |
|
方案二 |
|
|
方案三 |
|
13、④③②①⑤ 称量物和砝码位置放反了 偏小
14、解析:NaCl质量分数为:
15、解析:不同的溶液或液体进行混合,混合后溶液的体积并不等于混合前各液体的体积之和。本题易犯错误是用总体积减去浓溶液的体积得到水的体积。事实上由于分子大小不同,分子之间有间隙,溶液混合前后体积是不守恒的。
解:设98%的浓硫酸的体积为x
![]()
![]()
需水的质量=稀溶液的质量-浓溶液的质量
![]()
![]()
水的体积=
16、