![]()
【本讲教育信息】
一. 教学内容:
一定物质的量浓度的溶液的配制
二. 教学目标
1. 知识与技能目标
通过亲自实验,学会配制物质的量浓度的溶液的方法和技能。
2. 过程与方法目标
(1)使学生掌握配制一定物质的量浓度的溶液的实验方法,并且可以初步进行实验误差分析。
(2)培养学生根据具体的实验要求自己设计实验步骤,选择实验方案和实验仪器的能力。
(3)通过实验的教学培养学生仔细观察实验现象,发现问题的本质以及独立探讨解决问题的方法。
3. 情感态度与价值观目标
(1)通过亲自实验配制溶液,培养学生理论联系实际的学习自然科学的思想。
(2)体会实验中的相互合作,学会与他人的合作学习。
三. 教学重点、难点
一定物质的量浓度的溶液的配制
四. 教学方法
讨论+探究+实验
五. 教学过程
〔课前〕学生预习(学生看书,做预习资料):附预习资料(见后面附件)
学生在预习中设计实验方案,并对容量瓶的使用有所了解,明确实验目的及操作。
〔教师〕检查学生预习资料,并对学生的实验方案提出置疑,对学生的实验方案作一定的指导。
〔教师〕请同学们检查自己的实验仪器和药品。今天我们将用到一种新仪器,那就是容量瓶。请同学们仔细观察实验桌上的容量瓶,注意它的构造、规格、容量瓶上的标识。

〔讨论〕容量瓶怎么使用?容量瓶的使用有哪些注意事项?
〔学生归纳〕
1. 容量瓶的结构:细颈、梨形的平底玻璃瓶,瓶口配有磨口玻璃塞或塑料塞
2. 容量瓶的标识:温度和容积,刻度线。
3. 容量瓶的规格:50ml、100ml、250ml、1000ml等多种。
4. 容量瓶的使用注意事项:
A. 容量瓶在使用前,首先要检查是否完好,瓶口处是否漏水。检查方法如下: 往瓶内加入一定量水,塞好瓶塞。用食指摁住瓶塞,另一只手托住瓶底,把瓶倒立过来,观察瓶塞周围是否有水漏出。如果不漏水,将瓶正立并将瓶塞 旋转180°后塞紧,仍把瓶倒立过来,再检查是否漏水。经检查不漏水的容量 瓶才能使用。
B. 容量瓶是配制溶液的专业仪器,不能长期存放溶液或进行化学反应。
C. 溶解或稀释的操作不能在容量瓶中进行。
〔教师〕根据你的实验方案,现在开始做实验,请同学们把自己的操作步骤和实验操作中出现的问题记录在表格上,并分析问题导致的结果和出现的原因。
〔学生实验〕 边实验边记录
实验操作
|
记录你的实验操作 |
实验中出现的问题 |
问题导致的结果 |
分析原因 |
|
|
|
|
|
(教师观察学生实验,并对学生实验中出现的问题及时提醒和置疑,让学生领悟自己实验操作的不规范会出什么问题,对出现的问题进行分析并想办法解决。)
(学生实验完毕)
〔教师〕请同学们根据自己的实验情况和实验记录分组进行归纳总结,并且汇报:
1. 第一组汇报实验操作步骤及实验操作中要注意的问题;
2. 第二组误差分析:汇报实验的哪些操作中可能会产生误差;
3. 第三组误差分析:根据第二组的误差分析,说明这些误差产生的原因及导致的结果,避免或解救措施。
〔汇报成果〕
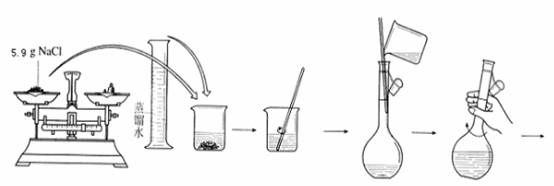
一、操作步骤
1. 计算溶质的质量
2. 称量
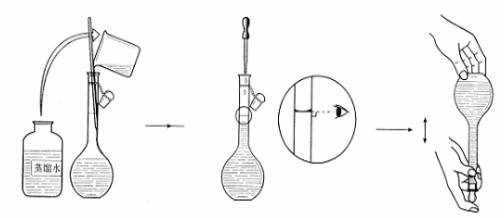
3. 溶解+转移
4. 洗涤+转移
5. 定容
6. 摇匀
7. 装瓶贴标签
二、误差分析
1. 称量中可能产生的误差:
砝码生锈 → 浓度偏大
托盘天平的精确度为
2. 操作中可能产生的误差:
没有洗涤 → 浓度偏小(洗涤)
转移中洒落 → 浓度偏小(重新配制)
玻璃棒靠在刻度线上方 → 浓度偏小(用蒸馏水冲洗进入溶液)
3.
定容可能产生的误差:
仰视 → 浓度偏小
俯视 → 浓度偏大
液面超过刻度线 → 浓度偏小(重新配制)
课堂练习:
1. 用98%的浓硫酸(![]() =
=
2. 在配制一定物质的量浓度溶液的实验中,下列操作对所配得溶液无影响的是(写序号)_________;会使所配溶液的浓度偏大的是_________;会使所配溶液的浓度偏小的是_________。
(1)在烧杯中溶解溶质,搅拌时不慎溅出少量溶液;
(2)未将洗涤烧杯内壁的溶液转移入容量瓶;
(3)容量瓶中所配的溶液液面未到刻度线便停止加水;
(4)将配得的溶液从容量瓶转移到干燥、洁净的试剂瓶中时,有少量溅出;
(5)将烧杯中溶液转移到容量瓶之前,容量瓶中有少量蒸馏水;
(6)容量瓶中液面将达到刻度线时,俯视刻度线和液面;
(7)NaOH固体称量时在空气中暴露时间过长;
(8)易潮解物质称量时未用玻璃仪器;
(9)配制稀硫酸时,用蒸馏水洗涤量筒,洗液注入容量瓶;
(10)加水溶解后的NaOH的溶液在空气中暴露时间过长。
【模拟试题】(答题时间:60分钟)
高一化学第一单元检测
一、选择题 (本题包括10小题,每小题4分,共40分。)
1、下列实验操作中正确的是 ( )
A. 用浓硫酸配制一定物质的量浓度的稀硫酸时,浓硫酸溶于水后,应冷却至室温才能转移到容量瓶中
B. Ba(NO3)2 溶于水,可将含有Ba(NO3)2 的废液倒入水槽中,再用水冲入下水道
C. 用蒸发方法使NaCl 从溶液中析出时,应将蒸发皿中NaCl 溶液全部加热蒸干
D. 用试管取出试剂瓶中的Na2CO3溶液,发现取量过多,为了不浪费,又把过量的试剂倒入试剂瓶中
2、下列说法中正确的是( )
A. 在一定的温度和压强下,各种气态物质体积大小由构成气体分子大小决定
B. 在一定温度和压强下各种气态物质体积的大小由构成气体的分子数决定
C. 不同的气体,若体积不同,则它们所含的分子数一定不同
D. 气体摩尔体积是指1 mol任何气体所占的体积约为
3、通过加入过量的化学药品,采用恰当的分离混合物的方法,除去某溶液里溶解着的杂质,下列做法中正确的是(括号内的物质为杂质) ( )
A. NaCl溶液(BaCl2)。加Na2SO4溶液,过滤
B. KNO3溶液(AgNO3)。加NaCl溶液,过滤
C. NaCl溶液(I2)。加酒精,分液
D. KNO3溶液(I2)。加四氯化碳,分液
4、用NA表示阿伏加德罗常数的值,下列叙述正确的是 ( )
A. 含有NA个氦原子的氦气在标准状况下的体积约为
B. 在常温常压下,
C. 1molCH3+(碳正离子)中含有电子数为10NA
D. 100mL 0.1mol·L-1的稀硫酸中含有SO42—个数为0.1NA
5、如果
A. n/1mol-1
B. 9n mol-
6、将0.1 mol/L的K2SO4溶液0.2 mol/L
Al2(SO4)3溶液和纯水混合,要使混合溶液中
K+、Al3+、SO![]() 的浓度分别为0.1 mol/L、0.1
mol/L、0.2 mol/L,则所取K2SO4溶液、Al2(SO4)3溶液、纯水三者体积比是( )
的浓度分别为0.1 mol/L、0.1
mol/L、0.2 mol/L,则所取K2SO4溶液、Al2(SO4)3溶液、纯水三者体积比是( )
A.1∶1∶1
B.2∶1∶
7、在标准状况下,若![]() L甲烷中含有的氢原子个数为
L甲烷中含有的氢原子个数为![]() ,则阿伏加德罗常数可表示为( )
,则阿伏加德罗常数可表示为( )
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
8、将标准状况下的![]() LHCl(g)溶于
LHCl(g)溶于
A. ![]() mo1·L-1 B.
mo1·L-1 B. ![]() mol·L-1
mol·L-1
C. ![]() mol·L-1 D.
mol·L-1 D. ![]() mol·L-1
mol·L-1
9、下列各物质所含原子数目,按由大到小顺序排列的是( )
①0.5mol NH3 ②标准状况下
A. ①③④② B. ④③②①
C. ②③④① D. ①④③②
10、科学家刚刚发现了某种元素的原子,其质量是a g,
A. 该原子的摩尔质量是aNA g B. Wg该原子的物质的量一定是 ![]()
C. Wg该原子中含有![]() 个该原子
D. 由已知信息可得:
个该原子
D. 由已知信息可得:![]() mol-1
mol-1
二、填空题:(46分,11-13每空2分,14题计20分,15题计12分)
11、若某原子的摩尔质量是M g /mol,则一个该原子的真实质量是 g。
12、
13、在同温同压下,若A容器中的O2和B容器中的SO2所含的分子总数相等,则A容器和B容器的体积比是____ ___;若它们所含的原子总数相等,则A容器和B容器的体积比是____ ____。
14、某同学欲用98%的浓H2SO4(ρ=
(1)填写下列操作步骤:
①所需浓H2SO4的体积为 (2分)
②如果实验室有10mL、20mL、50mL量筒,应选用 mL量筒量取。(1分)
③将量取的浓H2SO4沿烧杯内壁慢慢注入盛有约100mL的水里 ,并不断搅拌,目的是 。(3分)
④立即将上述溶液沿玻璃棒注入 中,并用50mL蒸馏水洗涤烧杯2~3次,并将洗涤液注入其中,并不时轻轻振荡。(2分)
⑤加水至距刻度 处,改用 加水,使溶液的凹液面正好跟刻度相平。盖上瓶塞,上下颠倒数次,摇匀。(2分)
(2)请指出上述操作中的一处明显错误:
。(2分)
(3)误差分析:(填偏大、偏小、不变)(8分)
操作②中量取时发现量筒不干净,用水洗净后直接量取,所配溶液浓度将
;
若容量瓶中洗净后未干燥,残留少量水,则所配制的溶液浓度将 ;
操作⑤中,若定容时,眼睛俯视,则所配制的溶液浓度将 。
若定容后发现液面高于刻度线,应如何处理? 。
15、粗食盐中除含有钙离子、镁离子、硫酸根离子等可溶性杂质外,还含有泥砂等不溶性杂质。我们食用的精盐是用粗食盐提纯而得到的。通过教材中“粗盐的提纯”及你做过的该实验回答下列问题。
(1)实验室进行NaCl溶液蒸发时,一般有以下操作过程 ①固定铁圈位置;②放置酒精灯 ;③放上蒸发皿(蒸发皿中盛有NaCl溶液);④停止加热; ⑤加热搅拌。其正确的操作顺序为 。(3分)
(2)除去钙离子、镁离子、硫酸根等离子杂质,实验中应加入何种试剂除去?(3分)
如何运用最简方法检验溶液中有无SO42-离子? 。(3分)
(3)将经过操作(2)后的溶液过滤。请问这一操作能除掉哪些杂质?
。(3分)
三、计算题(14分)
16、取
求(1)稀盐酸物质的量浓度(2)Na2CO3·xH2O的摩尔质量(3)x值
※附加题(共20分):
1、(5分)在甲、乙、丙、丁四个烧杯里分别放入0.1mol的钠,氧化钠,过氧化钠和氢氧化钠,然后各加入100mL水,使固体完全溶解,则甲、乙、丙、丁的溶液中溶质的质量分数大小的顺序为( )
*提示:2Na + 2H2O = 2NaOH + H2↑;Na2O + H2O = 2NaOH;2Na2O2 + 2H2O = 4NaOH + O2↑
A. 甲>乙>丙>丁 B. 丁<甲<乙=丙
C. 甲=丁<乙=丙 D. 丁<甲<乙<丙
2、(8分)在
(1)若剩余气体的体积是
(2)若剩余气体的体积是a L,则原CO和H2混合气中V(CO):V(H2)= ;
(3)若剩余气体的体积是a L ,则a的取值范围是 。
3、(7分)取1.5mol·L-1的硫酸11.5mL,投入
附件:
第一章 从实验中学化学
一定物质的量浓度溶液的配制 (预习资料)
配制100ml
1.00mol/L NaCl溶液
一、实验方案:
1. 实验室为你准备了以下实验仪器和药品
烧瓶、酒精灯、玻璃棒、钥匙、天平、容量瓶(50ml、100ml、500ml)、烧杯、冷凝管、温度计、滤纸、称量纸、胶头滴管;NaCl(A.R)、粗盐;NaOH(A.R)、5mol·L-1 NaCl溶液(100ml)
请选择所需仪器______、______、______、_____、______、______
(!!!容量瓶使用的注意事项)
所需药品______
2. 请根据所选仪器和药品设计配制100ml 1.00mol/L NaCl溶液的实验方案:
3. 一位同学设计了配制100ml 1.00mol/L NaCl溶液的实验方案,他的实验步骤如下:
(1)称量NaCl固体(A.R)……………………………………………………称量
(2)将称好的NaCl放入纸槽,再倒进100ml的容量瓶中,用蒸馏水溶解,玻璃棒搅拌;NaCl溶解完后,玻璃棒放于桌上………………………………溶解
(3)计算NaCl固体的质量:______g…………………………………………计算
(4)向容量瓶里的NaCl溶液中加蒸馏水,不小心加多了,用吸管吸出多余的蒸馏水。盖好瓶塞,反复上下颠倒,摇匀………………………………定容
(5)最后,贴上标签
(6)摇匀后静止,发现液面在容量瓶刻度线以下,于是再加蒸馏水补上。
A. 请为这位同学选择正确的实验顺序______→______→______→______→______→______
B. 请分析这位同学的操作是否正确,哪些步骤的操作错误____________,这样操作会导致什么后果:________________________________________________________________
_________________________________________________
应该怎样改正?________________________________________________________
![]()
【试题答案】
一、1. A 2. B 3. D 4. D 5. B 6. D 7. D 8. D 9. D 10. BC
二、11. M/NA 12. 1 NA 17:18 18:17 13. 1:1 3:2
14. (1)①13.6mL ② 20 ③ 散热,防止液体飞溅 ④500ml容量瓶 ⑤1
(2)第④步,立即将上述溶液倒入容量瓶
(3)偏小 偏小 偏大 重新配制
15. (1)②①③⑤④
(2)BaCl2、Na2CO3 、NaOH 取少量样品溶液(或上层清液),滴加盐酸酸化的BaCl2溶液,看是否有沉淀产生;如果有沉淀生成,说明有SO42-
(3)Ca2+、 Mg2+ 、SO42-和泥沙
三、16. (1)5mol/L (2)
附加题:
1. B
2. (1)5 5 (2)(a-10) : (20-a) (3)a大于等于10,小于等于20。