![]()
【本讲教育信息】
一、教学内容
物质在水中的溶解
二、考点清单
1. 掌握溶液的概念,能区别溶液、悬浊液、乳浊液。
2. 了解溶液的组成,知道溶液的特征,学会分析溶液中的溶质和溶剂。
3. 能够区别饱和溶液和不饱和溶液。
4. 理解溶解度的含义和特征。
5. 会计算溶液中溶质的质量分数,掌握配制溶液的方法。
三、全面突破
知识点一:溶液、溶质和溶剂的区别与联系
1. 实验引入:生活中,将蔗糖放入水中,发现蔗糖不见了,水变成了甜甜的糖水,说明:蔗糖溶解在水中了。通过实验还会发现许多物质能溶解在其它物质里。
2. 演示实验现象:
1)将深紫色的高锰酸钾晶体放入水中,有什么现象?
——高锰酸钾固体不见了,得到深紫色的液体
2)将固体碘(黑紫色)加入酒精中,又有什么现象?
——碘消失,得到暗黄色的液体
结论:高锰酸钾固体能溶解在水中,碘能溶解在酒精中。
3. 归纳:①溶质:像蔗糖、食盐、高锰酸钾等被溶解的物质称为溶质。
②溶剂:能溶解其他物质的物质(如水、酒精等,水是较好的溶剂,许多物质能溶在其中)。
③溶液:溶质在溶剂中溶解后得到的物质(碘酒、高锰酸钾溶液、糖水、盐水)
溶液特点:稳定性、均一性。
不同的物质在不同的溶剂中的溶解能力是不同的。溶质可以是固体也可以是气体或液体,如果两种液体相互溶解时,量多的叫溶剂,如果有一种是水,一般把水叫做溶剂。
溶质和溶剂是相对的,如10%的酒精溶液。
4. 思考:以上溶质是固体或液体,那么溶质可否是气体呢?
回答:可以。举例:汽水中溶有二氧化碳;泉水中除溶有矿物质外,还溶有氧气、二氧化碳等。
思考:果汁能溶于水中,果汁是溶质吗?
——不是,果汁中已经溶有许多物质,本身就是溶液。
思考:河水中溶解了哪些物质,能用来养鱼。冷开水不能养鱼,浇花花不开,又是为什么?
——河水中溶有矿物质,还溶有氧气等,冷开水中的氧气、矿物质很少,不能提供鱼生活所必需的物质。
知识点二:悬浊液、乳浊液
1. 悬浊液:固体小颗粒悬浮在液体里形成的物质。
人生病时需喝药水,有些药水上层是澄清液,下层是很细的不溶于水的药粉。这类药水的瓶上常常标有“服时摇匀”的字样。在摇动瓶子时,瓶里的液体会变得浑浊而不透明。如“钡餐”服用时需要摇匀,液体会变得浑浊不透明,就是悬浊液。
2. 乳浊液:小液滴分散在(不相溶的)液体里形成的物质。
牛奶,乳白色,不透明,放的时间长一些,会出现一层白色油脂,这就是乳浊液。
3. 混合物:有多种物质组成的物质。生活中很多像糖水一样的物质,它们有很多的成分混合在一起,就是混合物。溶液、悬浊液、乳浊液都是混合物。
4. 思考:将泥浆水、牛奶与高锰酸钾水溶液、蔗糖溶液情况比较,能不能说出溶液、悬浊液、乳浊液的区别与联系?
|
物质 |
悬浊液 |
乳浊液 |
溶液 |
|
是否透明 |
不透明,浑浊 |
透明 |
|
|
久置是否分层 |
久置分层 |
久置不分层 |
|
|
特点 |
不均一、不稳定 |
均一、稳定 |
|
|
类型 |
混合物 |
||
小结:(1)溶液有均一、稳定(放置一段时间也不会分层)的特点。溶液、悬浊液和乳浊液的本质区别是在水里颗粒的大小不同。
(2)色拉油在汽油中形成溶液。说明,同一物质在不同的溶剂中的溶解能力是不同的。
(3)常用的溶剂:水能溶解很多种物质,是最常用的较好的溶剂。常用的溶剂还有酒精、汽油、丙酮等。实例:碘酒溶液,酒精是溶剂;汽油是有机溶剂,能溶解油脂。
【典型例题】
例题1. 把洗衣粉、味精、色拉油、粉笔灰等分别放入4个装有清水的小烧杯中。用放大镜观察并记录现象,再用玻璃棒搅拌、静置,会出现怎样的现象。
解析:此题考查不同物质在水中的分散情况。
答案:将出现以下现象:味精不断地向水中扩散,溶解在水中。洗衣粉和色拉油与水形成的混合物浑浊、不均匀,静置后分层。
例题2. 如何将衣服上沾有的油污洗去?服装干洗的原理是什么?为什么干洗的衣物不能即日领回?
解析:此题考查油污易溶于汽油等有机溶剂的常识。
答案:用汽油擦。服装干洗原理为:我们穿的有些衣服的衣料是由天然纤维,如羊毛、真丝等制造的,湿水后会缩水、变形甚至褪色。遇到这类衣服或衣物沾上墨汁、指甲油等用水难洗的污渍,就需要干洗。干洗时,干洗店使用一些有机溶剂作为干洗液,把油性污渍洗掉。由于干洗溶剂都是一些致癌物质或具有中度毒性,对人体有害。所以,拿去干洗的衣物要相隔数天才可领回,使残留的干洗溶剂先挥发掉。
例题3. 以下是一些关于溶液的说法:①无色,②混合物,③化合物,④均一的,⑤稳定的,⑥各部分的性质相同。其中正确的是( )
A. ①③④⑤ B. ②④⑤⑥ C. ①②④⑤ D. ①③⑤⑥
解析:此题考查溶液的特性。
答案:B
例题4. 下列物质中不属于溶液的是( )
A. 食盐水 B.
汽水 C.
泥水 D.
澄清石灰水
解析:通过学习我们知道溶液是由溶质和溶剂两部分组成的,根据教材上的概念我们可以知道,溶液具有均一、稳定的特点。此题目中C项泥水中的泥沙无法溶解,因此无法形成均一、稳定的混合物。故C项是错误的。
答案:C
知识点三:饱和溶液和不饱和溶液
1. 说明在一定的条件(一定量的溶剂中,一定量的水中)下,溶质不可以无限地溶解在溶剂里。在一定温度下,在一定量的溶剂里,根据溶质是否能够继续溶解把溶液分成不饱和溶液和饱和溶液
2. 饱和溶液:在一定温度下,在一定量的溶剂里,不能继续溶解某种溶质的溶液,称为这种溶质的饱和溶液。
3. 不饱和溶液:在一定温度下,在一定量的溶剂里,还能继续溶解某种溶质的溶液,称为这种溶质的不饱和溶液。
4. 讨论:怎样将不饱和溶液转变成饱和溶液?如何将饱和溶液转变为不饱和溶液?
转变方法:

5. 浓溶液和稀溶液:
在溶液中,溶有较多溶质的叫做浓溶液;
有的溶有较少溶质,称为稀溶液。
6. 思考:饱和溶液是否一定是浓溶液,不饱和溶液是否一定是稀溶液?
实验说明:蔗糖、熟石灰在同样多的水中溶解的实验
现象:
结论:饱和溶液不一定是浓溶液,不饱和溶液不一定是稀溶液;在同一条件下,对同一物质而言,饱和溶液比不饱和溶液浓一些。
7. 讨论:饱和溶液跟溶液的浓、稀有关系吗?它们之间存在着什么关系?
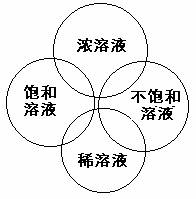
1)饱和溶液不一定是浓溶液;2)不饱和溶液不一定是稀溶液;
3)稀溶液不一定是不饱和溶液;4)浓溶液不一定是饱和溶液
5)在一定温度下,某一溶质的饱和溶液一定比不饱和溶液浓。
【典型例题】
例题1. 如果在一定温度下的硝酸钠饱和溶液中,加入硝酸钠晶体,那么( )
A. 晶体质量不变 B. 溶液质量增加
C. 溶液将变得比原来浓 D. 溶质的质量增大
解析:此题考查饱和溶液的特征,某温度下在饱和溶液中继续加入溶质晶体,晶体不能溶解,溶液不发生改变。
答案:A
例题2. 在一定温度下,在下列物质足量混合并充分振荡,其中肯定不能形成饱和溶液的是( )
A. 氯化钠与水 B. 硫酸铜与水
C. 氢氧化钙与水 D. 酒精与水
解析:此题考查饱和溶液的含义。酒精与水可以按照各种比例混合溶解,不会形成饱和溶液。
答案:D
知识点四:溶解度
1. 溶解度的定义和特点
实验:室温下,10克食盐和
现象:食盐未全溶,已达到饱和;氯酸钾全溶解完,未达到饱和。
结论:这两种溶质的溶解能力不一样。
思考:两种物质在相同的条件下,溶解能力是不同的,能否用定量的方法来表示物质的溶解能力呢?
概念:用溶解度来表示物质的溶解能力,即在一定的温度下,某物质在
强调:溶解度能够定量地表示物质的溶解能力的强弱。
(1)理解这个概念,抓住四个词:一定的温度,
(2)溶解度值越大,表明该温度下,物质的溶解能力越强
例如:
2. 物质的溶解性等级:
|
|
大于 |
1- |
0. 01- |
小于 |
|
溶解性等级 |
易溶 |
可溶 |
微溶 |
难溶 |
说明:所谓的易溶、可溶、微溶、难溶是相对的。自然界没有绝对不溶的物质。习惯上称作“不溶”的物质,只是溶解度很小,一般忽略不计而已。
3. 探究实验:影响固体溶解度大小的因素
(一)提出问题:影响固体溶解度大小的因素有哪些?
(二)建立假说:根据已有的知识和经验,我们猜测:
猜测1:溶解度可能与温度有关
猜测2:溶解度可能与 压强
有关
猜测3:溶解度可能与 溶剂 有关
猜测4:溶解度可能与 固体本身 有关
(三)设计实验进行检验:(控制变量法)
|
目的 |
验证溶解度是否与温度有关 |
|
条件控制 |
温度不同,溶质、溶剂一样 |
|
实验方案 |
(1)称量一定质量的硝酸钾固体M克,在室温下用一定量 (2)或配制较高温度时的硝酸钾饱和溶液,降温进行实验 |
|
实验数据 |
M克,N克,P克, |
|
结论 |
对于同一种溶质,温度改变,溶解度改变 |
通过几次实验,得出影响固体溶解度的因素有:溶质和溶剂的性质(内因)
温度(外因)
4. 观察比较物质的溶解度曲线
溶解度曲线:以温度为横坐标,溶解度为纵坐标形象地看出物质的溶解度随温度变化的情况。
1)溶解度曲线上每一点表示该物质在不同温度下的不同的溶解度。
2)溶解度曲线上的任意一点表示在该温度下某物质的溶解度是多少克。
3)不同物质溶解度曲线的交点处,表示不同物质在相对应的同一温度下的溶解度相同。
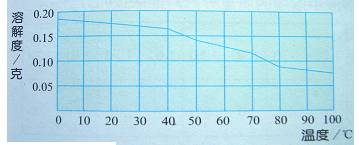
氢氧化钙(熟石灰)的溶解度曲线
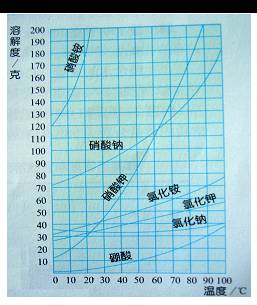
几种固态物质的溶解度曲线
4)溶解度曲线上方的一点,表示在指定温度下,溶液中的溶质质量已超过该物质的溶解度,溶液是过饱和的;溶解度曲线下方的一点,表示在指定温度下,溶液中溶质质量还没有达到溶解度的量,溶液是不饱和的。
分析说明:
硝酸钾与熟石灰的溶解度特点上有什么不同?
硝酸钾与食盐的溶解度特点上有什么不同?
硝酸钾溶解度随温度升高而增大,熟石灰溶解度随温度升高而减小,食盐溶解度随温度升高变化不大。可见不同物质的溶解度随温度升高变化情况不同。
归纳:(1)大部分固体物质的溶解度曲线左低右高,溶解度随温度的升高而增加;
(2)少数固体物质的溶解度曲线较平缓,溶解度受温度的影响小,如食盐;
(3)极少数固体物质的溶解度曲线是左高右低,溶解度随温度的升高而降低,如熟石灰。
溶解度曲线的应用:
(1)判断某一种物质在不同温度下的溶解度大小
(2)比较同一温度下,不同物质溶解度的大小
(3)判断不同物质溶解度受温度影响变化趋势
(4)确定混合物的分离、提纯的方法
(5)判断析出晶体量的多少
5. 溶解度计算
![]()
![]()
【典型例题】
例题1. 一定温度下,将
A.
解析:此题考查溶解度的计算,原溶液不能确定是否为饱和溶液,所以第一次蒸发掉![]() 计算得S=
计算得S=
答案:B
例题2. 已知
解析:
设:
则有关系式:
![]() 即
即 ![]()
答案:最多能溶解碘化钾
例题3. 已知
解析:首先要通过计算得知该硝酸钾溶液是不是饱和溶液?根据硝酸钾在
![]()
![]()
由于
蒸发水时,溶液首先应由不饱和溶液变成饱和溶液,在这一过程蒸发掉的水,并不能引起硝酸钾结晶析出。当溶液达到饱和后,继续蒸发掉水才能使硝酸钾晶体析出。
如果蒸发掉
设
![]()
![]()
原溶液里所含的水为:
使溶液由不饱和溶液变为饱和溶液,在这一过程所蒸发掉的水为:
溶液达到饱和后,继续蒸发的水为:
![]()
答:能析出硝酸钾晶体
例题4. 一定温度下,取某固体物质的溶液mg,分成等质量的两份,将一份溶液恒温蒸发达饱和时,其质量减轻一半。给另一份溶液里加入原溶质的晶体(该晶体不含结晶水),当达到饱和时,所加晶体的质量恰好是此份溶液质量的1/8,求此温度下该物质的溶解度。
解析:从题意可知,![]() 溶剂中溶解
溶剂中溶解![]() 该物质达到饱和。
该物质达到饱和。
设该物质的溶解度为S克。
![]()
解之:S=25(g)
答案:溶解度为
例题5. 一定温度下,溶质的质量分数为a%的硝酸钾溶液取其等质量的溶液两份,在温度不变的情况下,将一份蒸发掉
解析:蒸发水时,溶液首先应由不饱和变成饱和,在这个过程蒸发掉的水,并不能引起硝酸钾结晶析出。当溶液达到饱和后,继续蒸发掉的水才能使硝酸钾晶体析出。
第二次比第一次多蒸发
解答:设该温度下KNO3的溶解度为S克。
则:(
解之:S=
答案:溶解度为
知识点五:溶液质量分数的计算
溶质的质量分数
1. 溶质的质量分数是一种溶液组成的定量表示方法。即一定量的溶液里所含溶质的量。
2. 公式:
溶液中溶质的质量分数=![]() (常用百分数表示)
(常用百分数表示)
3. 注意:溶质质量与溶液质量的比,而不是溶质质量与溶剂质量之比。这个比必须用%表示。
表达式中有三个量:溶液质量、溶质质量和溶质的质量分数,利用这个式子可“知二求一”。
4. 明确关系:明确溶质的质量分数、溶质、溶剂、溶液的关系:
|
溶质的质量 |
不变 |
不变 |
增加 |
减少 |
|
溶剂的质量 |
减少 |
增加 |
不变 |
不变 |
|
溶液的质量 |
减少 |
增加 |
增加 |
减少 |
|
溶质的质量分数 |
变大 |
变小 |
变大 |
变小 |
5. 说明计算类型:(1) 计算有四种类型:
A. 已知溶质和溶剂的质量,求溶质的质量分数
B. 计算配制一定溶质的质量分数的溶液所需溶质和溶剂的质量
C. 溶解度与此温度下饱和溶液中溶质的质量分数的计算
D. 溶液稀释或浓缩和配制的计算
(2)注意点:
溶液通常是用量筒量取体积来计算的,要注意溶液体积与质量之间的换算,即密度的应用。
对于溶液的稀释或蒸发浓缩的计算,要抓住溶液的稀释或蒸发浓缩前后,溶质的质量不变,即浓溶液的质量×浓溶液中溶质的质量分数=稀溶液的质量×稀溶液中溶质的质量分数
【典型例题】
例1. 把
解析:此题是一个稀释问题,要注意在此稀释过程中,哪些量发生了变化?(溶剂质量、溶液的质量、溶液的溶质的质量分数。)什么量未变呢?(溶质的质量)。抓住溶液稀释前后其溶质质量不变,根据稀释关系:A×a%=B×b%;
设需要水的质量为x
则可列出方程:
解得x=
答案:需要水
例2. 配制溶质的质量分数为10%的氯化钠溶液
解析:根据溶液质量和溶质的质量分数,可求得溶质和溶剂的质量。
溶质=
水的质量=
答案:
知识点六:溶液的配制
配制一定溶质质量分数的溶液步骤:计算——称量——溶解——装瓶
【例】要配制20%的NaOH溶液
解:已知溶质的质量分数为20%,溶液质量为
计算:溶剂和溶质的质量或体积:
溶质质量(NaOH)=
溶剂质量(H2O)=
称量:称取(天平):NaOH
量取(量筒):H2O
溶解:用玻璃棒搅拌加速溶解,待完全溶解形成均一、稳定的NaOH溶液。
装瓶:贴标签。
四、应考锦囊
关于物质在水中的分散和溶解这块内容,既有非常抽象的理论知识,又有巧妙的实验设计,既有实际生活应用知识的考查,又有数学图象的逻辑分析考查,更重要的是我们在下学期要学习到的酸碱盐部分的知识,相关的化学反应几乎都是在溶液中进行的,因此学好这部分的知识是十分重要的。
溶液的概念及特征、判断给定物质或化学反应的产物是不是溶液、判断溶液中的溶质和溶剂等内容,都是中考的考点,主要以选择题、填空题的形式出现。
溶质质量分数的概念理解和计算、配制一定溶质质量分数溶液的实验也是中考的热点,多以选择题、实验题、计算题的形式出现。
五、本讲小结
本讲中我们学习了溶液的概念,要求大家能区别溶液、悬浊液、乳浊液。了解溶液的组成,知道溶液的特征,学会分析溶液中的溶质和溶剂。能够区别饱和溶液和不饱和溶液,并理解溶解度的含义和特征,利用溶解度进行计算。并会计算溶液中溶质的质量分数,掌握配制溶液的方法。请同学们在课后进行练习,加强复习巩固。
六、超前思维(物质在水中的结晶、水的利用和保护)
(一)自学成才
1. 晶体具有 的几何形状,而非晶体则没有。
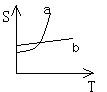
2. 获得晶体的两种方法是: 和 。对于下图中获得a物质晶体可采用: ,获得b物质晶体可采用:
3. 色的硫酸铜晶体受热会变成 色的无水硫酸铜粉末,同时有 生成。无水硫酸铜遇水变 。
4. 硫酸铜晶体的生成中利用的结晶方法是: 。
5. 目前人类利用较多的是 水、 水和 水。它们都是由 水最后汇集而成的。
6. 对于一个区域来说,可供人们使用的水相当于该区域在一段时间内
的总量和同期
水总量之差。即是可提供
的水。
7. 一个地区的 越活跃,水资源就越丰富。从全球范围来看,在 地区和 比较近的地区水资源相对比较丰富。
8. 我国水资源的特点有:总量居世界第 位,但人均占有量只有世界平均水平的 ,尤其是在北纬 度的海流域和华北地区,供水严重不足;分布从时间上看, 丰富, 欠缺,江河径流量的年际变化 ;从空间上看,南 北 ,东 西 。
9. 污水中含有有利于水中微生物生长的物质,会使这些微生物大量繁殖,从而消耗了溶于水中的 ,使得水生动物难以生存。
10. 把水静置,使水中的杂质沉淀到水底的方法称为 ,为了使沉淀的效果更好,常用 或 作凝聚剂。过滤法适用于分离 的混合物,过滤操作有严格的要求,一贴是指 ,二低是指 、 ,三靠是指 、 、 。
11. 把水加热,至水沸腾变成水蒸气,再经冷凝管冷却成水滴,这种净化水的方法称作 。蒸馏水是 (纯净物或混合物)。
12. 粗盐提纯为精盐的主要操作步骤有 、 、 ,最后所得的精盐是 (纯净物或混合物)。
(二)思考题
1. 为什么冷却热饱和溶液可以得到晶体?
2. 为什么水资源丰富的国家也会发生供水困难?
3. 净化水的方法有哪些?哪种效果较好?
4. 怎样精制粗盐?
【模拟试题】(答题时间:40分钟)
A. 难溶物质 B. 微溶物质 C. 可溶物质 D. 易溶物质
2. 某温度下,a克溶质溶解在a克水中恰好饱和,此溶质在该温度下的溶解度是( )
A.
*3. 要使
A. 再加入
C. 蒸发掉
*4. 可以证明烧杯中的硝酸钾溶液是饱和溶液的方法是( )
A. 蒸发掉
B. 降低温度,有少量固体析出
C. 加入少量硝酸钾固体,固体不溶解
D. 加入少量水,没有固体析出
5. 某温度下硝酸钾的溶解度为
6. 一瓶接近饱和的硝酸钾溶液,在温度不变的情况下,欲使其成为饱和溶液,可采用的方法有 、 、 。
7. t℃将
8. 将
9. 配制
10.
11.
*12. t℃时某饱和溶液的溶质质量分数为20%,则该温度下该物质的溶解度为
克;要使
13. t℃时某硝酸钠溶液
**14. 一定温度下,在质量都是
|
加入的硝酸钾质量/克 |
30 |
40 |
50 |
60 |
70 |
|
所得溶液的质量/克 |
80 |
90 |
100 |
105 |
105 |
则该温度下硝酸钾的溶解度为 克。
**15. 将一定质量的质量分数为5%的氢氧化钠溶液,加热蒸发掉
**16. 有
**17. 某物质溶解度曲线如图所示。现有该物质的A、B两种不同浓度的不饱和溶液,当A冷却至
![]()
【试题答案】
1. C 2. A 3. B 4. C 5. 1:5 1:6 6. 蒸发溶剂 增加溶质 降低温度
7. 40 60 150 8. 10% 37.5 150 300
9. 5 45 (1)天平 5 (2)量筒 45毫升
(3)玻璃棒 完全溶解
15. (1)144 (2)136.8 (3)7.2 (4)1.2
16. 分析:由于两次蒸发等量的溶剂,析出晶体质量不同. 可以断定原溶液是不饱和溶液,根据第二次蒸发掉溶剂的质量与析出晶体的质量求溶解度。
解答:设
则10∶6=100∶S
解之 S=60(g)
17. 分析:从图可以看出,温度与溶解度在数值上始终相同。据题意知,结晶后残留在母液中的溶质质量与析出的
解答:设需降温到x℃时能析出
依题意得:
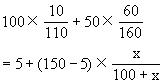
解之:x=18.8(g) 则:x℃=